
婴儿期是肠道菌群形成和发展最为关键的时期,作为肠道菌群演替速度较快的重要阶段,稳定的肠道菌群定植对机体健康、免疫系统的建立及完善有着重大且长远的意义。母乳中富含人乳低聚糖(HMOs),能够有效促进婴儿肠道中有益细菌的生长,抑制病原菌的侵袭,改善肠道菌群组成,提高菌种多样性,促进婴儿生长发育。现就HMOs的研究现状及其对婴儿肠道菌群的影响进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
母乳是促进婴儿健康生长发育的最佳天然食物,除为婴儿提供理想、均衡的营养外,其所含的众多生物活性成分,如免疫球蛋白、细胞因子、低聚糖等对促进婴儿未成熟的消化及免疫系统的发育具有不可替代的作用[1,2]。母乳中含200余种人乳低聚糖(HMOs)[3,4],是母乳功能性成分的重要组成部分。HMOs为不易消化的非营养性碳水化合物,是具有独特多样性结构的复杂低聚糖,也是母乳中仅次于乳糖和脂质的第3大成分[5]。HMOs在肠道中不能被消化吸收,但有利于婴儿肠道微环境的形成和稳定,而稳定、健康的肠道内环境有助于促进婴儿的体格生长发育、构建完善的免疫系统及消化系统等。现就HMOs的研究现状及其对婴儿肠道菌群影响的研究进展进行综述。
HMOs为一类低聚碳水化合物,通常以乳糖为核心,即一种由β1,4-糖苷键连接葡萄糖分子和半乳糖分子所组成的二糖结构[1],然后通过不同的糖苷键在酶促作用下连接5种基本单糖:L-岩藻糖(Fuc)、D-半乳糖(Gal)、D-葡萄糖(Glc)、N-乙酰葡萄糖胺(GlcNAc)和唾液酸衍生物N-乙酰神经氨酸(Neu5Ac),形成一个由3个及3个以上的单糖组成的水溶性多聚糖。这种连接方式不仅扩展了HMOs的多样性,同时其抗酶消化的稳定性也得以提高[6]。
HMOs主要在乳腺腺泡细胞的高尔基体中合成[7],但不同母乳中HMOs的组成和含量存在个体差异,这主要与母体Se基因和Le基因的表达密切相关。Se基因编码α1,2-岩藻糖转移酶(FUT1),具有该基因活跃表达的母亲被称为"分泌型",其乳汁富含2′-岩藻糖基乳糖(2′-FL)、乳酸-N-岩藻糖Ⅰ(LNFP Ⅰ)及其他α1,2-岩藻糖基化的HMOs,而"非分泌型"母亲的乳汁中缺乏或只有微量α1,2浓缩寡糖,因此含有较少种类和数量的HMOs[8]。Le基因编码α1,3/4-岩藻糖基转移酶(FUT3),具有该基因活跃表达的母亲被称为"Le阳性",其乳汁中富含乳酸-N-岩藻糖Ⅱ(LNFP Ⅱ)。根据Se基因和Le基因表达的不同,可将母乳大致分为4组:Le阳性分泌型(Le+Se+)、Le阴性分泌型(Le-Se+)、Le阳性非分泌型(Le+Se-)和Le阴性非分泌型(Le-Se-),人群中70%的母亲基因型为(Le+Se+),仅1%为(Le-Se-)。除上述遗传因素外,生理和环境因素(如孕产妇的营养状况、饮食结构、体质量指数、所属地区或分娩类型等)也会影响HMOs的组成和含量[9]。
婴儿经口摄入HMOs,因其对胃酸、胰腺酶及刷状边缘酶的消化降解作用抵抗力强,且肠道内缺乏糖苷水解酶和肠膜转运体,故HMOs不能在婴儿的上消化道消化,约99%以完整的形式到达结肠和远端小肠,其中约45%被肠道微生物群发酵,剩余1%~4%和40%~50%分别通过尿液和粪便排出,摄入的HMOs总量中仅1%被吸收入血[10]。
研究显示,到达肠道的HMOs可在局部发挥多种生物活性效应,具体如下(图1)[7,11]:(1) HMOs作为益生元可刺激共生菌的生长,调节肠道菌群;其发酵过程中产生的短链脂肪酸(SCFA)可增强肠上皮屏障的完整性,并局部和系统地调节免疫反应;同时HMOs中的唾液酰化分子可被唾液酸依赖病原体识别和结合,抑制病原体黏附婴儿的肠上皮细胞,降低肠道感染风险[12]。(2)HMOs可促进肠上皮细胞增殖及产生黏液,同时可改变上皮细胞糖萼结构,调节紧密连接蛋白的表达,从而降低肠道黏液屏障的通透性[13]。(3) HMOs可直接影响机体的免疫功能,通过结合聚糖受体,如树突状细胞上的C型凝集素、嗜酸性粒细胞和肥大细胞上的唾液酸结合免疫球蛋白样凝集素(Siglecs)和肠上皮细胞上的可溶性半乳糖凝集素以及Toll样受体(TLR),参与调节T淋巴细胞,使参与免疫反应的辅助性T淋巴细胞1与辅助性T淋巴细胞2的比例(Th1/Th2)更平衡,以及减少病原菌的抗原呈递作用并抑制过敏及炎症反应[11]。(4)少量完整的唾液化HMOs可从肠道吸收,并以足够高的浓度停留在婴儿的血液中,从而在细胞水平上调节免疫。
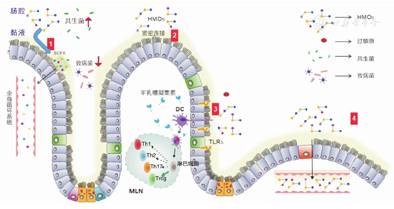
注:HMOs:人乳低聚糖;SCFA:短链脂肪酸;TLRs:Toll样受体;DC:树突状细胞;MLN:肠系膜淋巴结;Th1、Th2、Th17:1型、2型、17型辅助性T淋巴细胞;Treg:调节性T淋巴细胞 HMOs:human milk oligosaccharides;SCFA:short-chain fatty acids;TLRs:Toll-like receptors;DC:dendritic cells;MLN:mesenteric lymph nodes;Th1,Th2,Th17:type 1 ,2 ,17 helper T-lymphocyte;Treg:regulating T-lymphocyte
肠道菌群定义为定植于肠道内,对机体生长发育、免疫调节及抗感染等起重要作用的一类微生物的总称。健康人群的肠道中约有500余种微生物,其数量高达1013~1014个,是机体真核细胞数的10倍以上,在机体持续进行的生理性演替中始终处于相对平衡的状态。越来越多的证据表明,生命早期暴露于共生细菌对免疫系统的发育至关重要[14],而破坏这种共生关系易导致肠道炎症等的发生[15]。同时,微生物种群失调和多样性的缺失会提高机体的易感性继而引发疾病。临床研究结果证实,婴儿肠道菌群失调会引发坏死性结肠炎、炎症性肠病等,并在婴儿成长过程中增加其肥胖、过敏、糖尿病及免疫性疾病发生的概率[16]。
许多因素都会影响婴儿肠道菌群的组成。研究发现,双歧杆菌属在母乳喂养期间是婴儿肠道微生物群中的优势细菌,但断奶后相对丰度迅速下降,粪便中HMOs的显著下降也与肠道高水平的双歧杆菌含量呈正相关[17]。同时实验表明,来自长双歧杆菌的特定β-半乳糖苷酶在体外分解代谢HMOs后,其分解代谢的片段与婴儿粪便样本中鉴定的化合物相匹配[18]。另有研究显示,乳糖-N-二糖(LNB)、半乳糖-N-二糖(GNB)、岩藻糖基α1,3-乙酰葡萄糖胺(3FN)和岩藻糖基α1,6-乙酰葡萄糖胺(6FN)在体外可被从母乳喂养婴儿粪便样本中分离出的微生物群发酵,而LNB、GNB和3FN可显著促进特定双歧杆菌菌株的生长,3FN可显著促进乳酸杆菌的生长[19]。这些研究均证实HMOs能够促进特定菌株在婴儿肠道中的富集。同时,健康人乳中富含多种微生物,包括双歧杆菌、乳酸杆菌、葡萄球菌等常见菌属,可通过母乳喂养垂直传递给婴儿,直接促进婴儿肠道菌群的定植及建立[20]。除喂养方式外,分娩方式、饮食组成、抗生素使用、孕期母亲健康(如产前是否暴露于抗生素或毒素)、固体食物引入、遗传基因及环境因素等[21,22,23],也可通过不同作用影响婴儿肠道菌群的建立。
HMOs对于肠道菌群的选择,本质上是某些细菌对其具有强大的利用能力。以双歧杆菌为例,主要通过2种方式对HMOs进行利用,一种是经转运蛋白将完整的HMOs运输到细胞质中进一步分解,而另一种方式则依赖于细胞外的水解酶水解HMOs并释放单糖和双糖。但不同种类的双歧杆菌利用HMOs的具体方式也不同。如两歧双歧杆菌利用细胞外水解酶水解HMOs并释放LNB,这是1型HMOs的核心结构,而婴儿双歧杆菌和短双歧杆菌则使用寡糖转运蛋白将HMOs转运至细胞内利用。长双歧杆菌的HMOs降解模式主要取决于乳糖-N-二糖苷酶非分类酶(LnbX)的存在。LnbX阴性长双歧杆菌利用寡糖转运蛋白在细胞内分解HMOs,而LnbX阳性长双歧杆菌则利用细胞外水解酶消化分解HMOs。同时,不同的婴儿肠道菌群对于HMOs的利用能力及特点各不相同(表1)[24]。
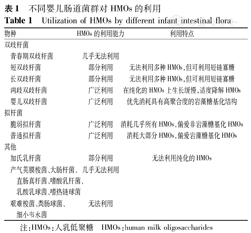
不同婴儿肠道菌群对HMOs的利用
Utilization of HMOs by different infant intestinal flora
不同婴儿肠道菌群对HMOs的利用
Utilization of HMOs by different infant intestinal flora
| 物种 | HMOs的利用能力 | 利用特点 | |
|---|---|---|---|
| 双歧杆菌 | |||
| 青春期双歧杆菌 | 几乎无法利用 | ||
| 短双歧杆菌 | 部分利用 | 无法利用多种HMOs,但可利用短链寡糖 | |
| 长双歧杆菌 | 部分利用 | 无法利用多种HMOs,但可利用短链寡糖 | |
| 两歧双歧杆菌 | 广泛利用 | 在纯化的HMOs上生长缓慢,适度降解HMOs | |
| 婴儿双歧杆菌 | 广泛利用 | 优先消耗具有高聚合度的岩藻糖基化结构 | |
| 拟杆菌 | |||
| 脆弱拟杆菌 | 广泛利用 | 消耗几乎所有HMOs,偏爱非岩藻糖基化HMOs | |
| 普通拟杆菌 | 广泛利用 | 消耗大部分HMOs,偏爱岩藻糖基化HMOs | |
| 其他 | |||
| 加氏乳杆菌 | 部分利用 | 无法利用纯化的HMOs | |
| 产气荚膜梭菌、大肠杆菌、直肠真杆菌、嗜酸乳杆菌、乳酸乳球菌、嗜热链球菌 | 几乎无法利用 | ||
| 艰难梭菌、粪肠球菌、细小韦永菌 | 无法利用 | ||
注:HMOs:人乳低聚糖 HMOs:human milk oligosaccharides
虽然不同婴儿肠道菌群利用HMOs的能力不同,但他们可通过"cross-feeding",即微生物群落间的协同行动,顺序降解并代谢结构复杂的HMOs[25]。研究显示,同一婴儿肠道菌群中分离出的多样的双歧杆菌菌株(长双歧杆菌、短双歧杆菌和假链状双歧杆菌)彼此间可通过利用对方的代谢产物最大限度地利用HMOs[26]。
此外,双歧杆菌作为婴儿肠道中最主要的细菌,与拟杆菌、乳酸杆菌等均可将HMOs作为能源产生SCFA[27,28]。SCFA主要包括乙酸、丙酸及丁酸,与有机酸类似均为肠道内细菌的代谢产物,可作为结肠细胞及某些微生物群的能量来源,且均可降低管腔pH值,形成肠道酸性环境,进而抑制病原体生长[29],如降低大肠杆菌和产气荚膜梭菌的比例[30],同时也有利于其他有益双歧杆菌菌株的生长。
多数病原微生物的毒力取决于他们黏附宿主上皮细胞表面的能力,HMOs可直接作为抗黏附剂,通过特异性识别结合病原菌,减少病原微生物对肠黏膜的侵袭[31,32,33](图2)。
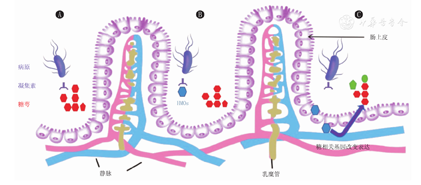

注:HMOs:人乳低聚糖 HMOs:human milk oligosaccharides
研究发现,HMOs中的2′-FL和LNFP Ⅰ不仅可减少细菌的黏附,如减少幽门螺杆菌与上皮细胞的结合,还可通过与不耐热的Ⅰ型肠毒素结合来降低肠道细菌的致病性,岩藻糖基化的HMOs还可抑制侵入性空肠弯曲杆菌菌株与肠上皮细胞的结合和感染[34]。同时体外研究表明,HMOs可抑制尿路致病性大肠杆菌与结肠上皮细胞的结合,抑制肺炎链球菌和流感嗜血杆菌黏附到口腔和咽部上皮细胞等[24]。
对于病毒感染,已发现HMOs可提高婴儿对轮状病毒和诺如病毒引起的胃肠道感染的抵抗力,同时2′-FL已被证明可减少呼吸道合胞病毒的病毒载量[35]。对于寄生虫感染,HMOs中含有末端Gal结构的乳糖-N-四糖(LNT)可作为可溶性诱饵受体,防止溶组织内阿米巴附着在肠上皮人结直肠腺癌细胞(HT-29细胞)上[36]。对于真菌感染,HMOs能够下调编码白色念珠菌菌丝特异性黏附和新生菌丝表达的ALS3基因数量,减少早期感染阶段白色念珠菌和肠上皮细胞之间的黏附[37]。
婴儿配方奶粉作为不能母乳喂养或母乳不足婴儿喂养的首选替代品,应尽可能模拟母乳的营养成分以满足婴儿生长发育的需求。在婴儿配方奶粉中添加HMOs或模拟HMOs成分,能在一定程度上促进婴儿肠道菌群的定植和生长,使其更接近母乳喂养婴儿的肠道微环境,促进婴儿肠道发育和机体健康。
迄今为止,仅2′FL和乳糖-N-新四糖(LNnT)已添加到婴儿配方奶粉中[38],其良好的耐受性和安全性也得到证实。在健康足月儿中实施的随机、双盲、对照临床试验表明,相比食用未添加HMOs配方奶粉的对照组婴儿,出生早期喂养添加2′FL和LNnT的配方奶粉,能够使婴儿肠道微生物组成更接近母乳喂养婴儿,可增加其粪便中双歧杆菌的丰度、减少潜在致病菌,同时可软化婴儿大便、降低其下呼吸道感染的发病率、延长抗生素作用效果等[39]。
综上,HMOs是母乳中结构独特的低聚糖,能够促进婴儿肠道菌群的定植与生长,提高肠道菌群的多样性,抑制病原菌侵袭,并调节肠道免疫等,对婴儿的健康和生长发育具有重要作用。
所有作者均声明不存在利益冲突



























