
脊髓性肌萎缩症(spinal muscular atrophy,SMA)本文特指5q-SMA,属常染色体隐性遗传病,临床特征为脊髓前角α运动神经元退行性病变和神经肌肉接头发育异常导致的肌无力和肌萎缩。SMA常累及呼吸系统,引起呼吸系统病理生理改变,导致低通气、咳嗽减弱、痰液堵塞等一系列呼吸问题。呼吸衰竭是SMA患儿最常见的致死原因。近年来,随着国内外SMA多学科管理专家共识的相继发表和新药上市,SMA呼吸管理策略将会转变。本共识由中国医师协会儿科医师分会及中国医师协会儿科医师分会儿童呼吸学组组织我国相关领域的专家,总结国内外指南/共识和相关临床研究,结合中国人群实际临床情况,最终达成共识,以促进SMA患儿规范呼吸管理。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊髓性肌萎缩症(spinal muscular atrophy,SMA)是由于脊髓α-运动神经元变性,导致近端肢体和躯干进行性、对称性肌无力和肌萎缩的神经变性病[1,2]。本共识中的SMA特指5q-SMA,即位于5q13.2区域的运动神经元存活基因1(survival motor neuron,SMN1;OMIM 600354)致病性变异所导致的常染色体隐性遗传病,包括0~3型以及呈常染色体隐性遗传的4型SMA(成人型)。该病在新生儿中的发病率约为1/10 000[3],携带者频率约为1/50~1/40。儿童型SMA(1~3型)的患病率为2.78/10万人~6.56/10万人[4,5,6,7],常染色体隐性遗传的4型SMA患病率为0.32/10万人[8]。SMA居2岁以下儿童致死性遗传病首位,其中疾病累及呼吸系统导致的呼吸衰竭是最常见的致死原因[9]。
合理有效的呼吸管理策略对稳定SMA患者的呼吸功能,降低呼吸系统相关并发症的发生率与疾病死亡率均有重要意义。2018年以来,国内外相继发表了SMA多学科管理专家共识,其中呼吸管理策略已由被动治疗转变为早期开始的主动治疗[1,2,10]。随着新药的获批上市,中国SMA患者和家庭已有新的治疗选择,同时也将进一步推动国内SMA临床规范诊疗,改变呼吸管理方案。基于此,由中国医师协会儿科医师分会及中国医师协会儿科医师分会儿童呼吸学组牵头,组织呼吸内科、神经内科、急诊科、重症医学科等专业领域内专家,参考国内外指南/共识和最新临床研究结果,结合临床实践,共同制定了《脊髓性肌萎缩症呼吸管理专家共识(2022版)》,以期为SMA患者的呼吸管理提供指导与参考。
SMN蛋白在各组织细胞中广泛表达,参与剪接体蛋白复合体的组装,是真核细胞生物生存所必需的管家蛋白。SMN蛋白主要由SMN1基因编码产生,当SMN1第7或第7、8外显子发生纯合缺失或点突变时引起SMN蛋白表达缺失,通常会导致SMA的发生[11]。同源基因SMN2较SMN1在第7外显子存在碱基差异(c.840 C>T),可以表达约10%的具有正常功能的全长SMN蛋白。SMN2拷贝数是公认的SMA修饰因子,与SMA表型的严重程度具有相关性。一般当SMN2的拷贝数越多,疾病症状表现越轻;多数1型SMA患儿的SMN2基因拷贝数≤2(表1)[12,13]。

脊髓性肌萎缩症的临床分型
Clinical classification of spinal muscular atrophy
脊髓性肌萎缩症的临床分型
Clinical classification of spinal muscular atrophy
| 分型 | 起病年龄 | 最大运动里程碑 | 临床表现 | 自然病程 | 比例 | SMN2拷贝数 |
|---|---|---|---|---|---|---|
| 0型 | 胎儿/新生儿期 | 无任何运动功能 | 除眼球外,几乎无面部、躯干、肢体的任何活动,无吸吮动作 | 数月 | 很少 | 1 |
| 先天性关节挛缩、肌肉萎缩、反射消失 | ||||||
| 出生后即需要机械通气 | ||||||
| 1型 | <6个月 | 不能独坐 | 严重的全身肌张力减退,颈部、四肢无力 | 大部分存活≤2岁 | 40%~50% | 1~3 |
| 无反射、伴有舌肌纤颤 | ||||||
| "钟形"胸廓,矛盾呼吸 | ||||||
| 容易反复呼吸道感染及呼吸衰竭 | ||||||
| 2型 | 6~18个月 | 可独坐、不能独走 | 轻~中度的全身性肌张力减退和肌无力 | 大部分可生存至成年 | 30%~40% | 主要为3 |
| 运动发育落后,手指的多肌束痉挛震颤 | ||||||
| 伴关节挛缩及脊柱侧弯,影响呼吸功能 | ||||||
| 3型 | >18个月 | 可独走 | 儿童期逐渐出现近端肌无力,随疾病进展丧失行走能力 | 寿命不缩短或轻度下降 | 10%~20% | 3或4 |
| 运动发育平稳,可见肌束颤 | ||||||
| 后期出现脊柱侧弯、关节畸形、呼吸功能不全等表现 | ||||||
| 4型 | 成人期 | 可独走、跑跳 | 下肢起始的四肢近端无力,轻微运动障碍 | 寿命一般不受影响 | 较少 | 主要为4 |
SMA特征性的呼吸系统病理生理改变主要为肋间肌无力、胸廓变形以及肺容量和通气能力降低。1型SMA患儿表现为特殊的"钟形"胸廓,这是由于呼吸肌肌力减弱而呼吸负荷增加,肋间肌无法抵抗膈肌的向下拉力,上胸部无法充分扩张所形成[1]。2型和3型SMA患者因合并脊柱侧凸导致胸廓畸形,进一步限制了肺的扩张。由于呼吸肌无力,机体只能通过增加呼吸频率来代偿,表现为浅快呼吸[15]。
1型、2型SMA患儿由于肺部扩张不足等原因会致肺组织存在广泛微小的肺不张,肺顺应性下降,加上胸廓畸形共同加剧了肺发育不良。尸检多报道SMA患儿死于肺不张而非结构性肺损伤导致的呼吸衰竭[16]。动物研究显示,SMA小鼠肺组织具有深红色斑点、肺泡隔膜破裂等病理表现,提示肺不张或肺梗死以及肺气肿相关病变[17]。携带3拷贝数SMN2的SMA模型小鼠表现出肺发育不良和呼吸障碍,在7日龄时即出现呼吸频率降低、呼吸暂停和横膈膜神经肌肉连接缺陷[18]。
低通气是SMA患者最早表现出的呼吸问题。由于SMA患者本身存在呼吸肌乏力与呼吸浅快,最早在快动眼睡眠期(rapid eye movement,REM)出现低通气。随着化学感受器的敏感性降低与肌肉无力,使得中枢对呼吸的驱动减弱以及呼吸肌肌张力进一步下降,加剧了潮气量降低,导致肺泡通气不足,出现低氧血症和高碳酸血症,临床表现为晨间头痛、疲劳、日间困倦、食欲下降等症状。随着肌无力的进展,REM期的低通气常扩展到非快速动眼睡眠期(non-rapid eye movement,NREM),并最终发展为日间低通气。在病情稳定情况下,机体尚能够代偿,但在发生肺部感染或麻醉过程等并发症或急性应激时,患者极易出现呼吸衰竭。
咳嗽主要由肋间内肌和腹肌完成,腹肌无力会减弱咳嗽反射的应答,增加分泌物吸入的风险。咳嗽过程涉及声门关闭、呼吸肌收缩、肺内压升高,然后声门张开,肺内空气喷射而出。而SMA患者由于存在呼吸肌无力导致咳嗽减弱,无法完成有效咳嗽动作,使分泌物潴留在肺部,当分泌物堵塞气道时,可引起肺不张。在2型和3型SMA患者自然病程12个月时,最大呼气压力(maximum expiratory pressure,MEP)和咳嗽峰流速(peak cough flow,PCF)轻微下降,故出现咳嗽减弱[19]。
黏液的分泌和清除对于维持气道稳态和肺部健康至关重要。生理情况下,气道黏液具有气道加温加湿、清除气道有害物质(吸入的病原体、粉尘颗粒、化学毒素)等作用。但在病理状态下,气道黏液的分泌量增多、纤毛清除功能受损、咳嗽能力不足,黏液潴留于气道,与鼻咽/口咽分泌物、细胞碎片和微生物共同形成痰液。在SMA等神经肌肉疾病初期,患者有正常的黏液/纤毛清除功能;随着呼吸肌无力加重,咳嗽减弱,长期声门无法闭合,导致纤毛损伤,产生高黏度的病理性痰液堵塞气道。SMA患者长期痰液堵塞或偶有误吸将并发慢性支气管炎伴有黏液脓痰,还会导致白细胞浸润继发炎症级联反应。通常在临床实践中,呼吸道感染期间经鼻吸气压力(sniff nasal inspiratory pressure,SNIP)和咳嗽时胃内压(gastric pressure,Pgas)低于预计值50%时,预示与痰液阻塞的更高风险相关[20]。
对于SMA患者的胃食管反流病(gastroesophageal reflux disease,GERD),在年长儿最常见的典型症状是胃灼热(胸骨后烧灼感)和反流(为胃内容物向咽部或口腔方向流动的感觉);不典型症状有胸痛、上腹烧灼感、上腹痛、上腹胀、嗳气等。而婴幼儿的症状还包括拒食、反复呕吐、进食时弓背体位、体质量增长不良、易激惹、睡眠障碍、咳嗽、喘息、呼吸暂停、反复发作性肺炎、咽痛、声嘶、慢性鼻窦炎、喉炎、牙蚀症等。
吞咽通常涉及吮吸、舌根缩紧、环咽肌开放、舌骨喉复合体运动、上食道括约肌打开等过程。SMA患者由于存在颅内神经病变,上述吞咽功能严重缺陷,反流与误吸的风险增加,可导致唾液、食物、胃内容物等误吸入肺部,引起呼吸窘迫、吸入性肺炎、营养不良而需住院治疗,甚至导致窒息[21]。几乎所有1型SMA患儿1岁前会出现喂养时间短、进食饮水诱发的咳嗽、喂养前后喉中痰鸣等症状,致使纳奶量不足,需喂养支持[22]。2型和3型SMA患者中,约62%和23%存在吞咽障碍,增加长期营养不良、体质量增长缓慢和吸入性肺炎的发生风险[21]。不能独坐的SMA患儿在条件反射缺失及体质量增长缓慢的情况下,当胸部X线片出现右上叶病变时,无论是否合并支气管炎(如呼吸道合胞病毒感染),均应考虑存在误吸。
SMA患者呼吸系统的临床表现不一,受其肌无力和萎缩程度影响,故进行呼吸状况检测与评估的重点应根据疾病分型和最大运动里程碑而定[1]。对于不能独坐者,建议每3个月进行1次体格检查,重点评估脉搏血氧饱和度(pulse oximetry,SpO2)、二氧化碳分压(partial pressure of carbon dioxide,PCO2)、吞咽功能,并应行胸片检查以了解肺发育的情况。对于能独坐、不能独站者,建议每6个月进行1次检查,重点集中在肺功能和呼吸肌肌力(含咳嗽功能)。对于能独站的SMA患者行肺功能、咳嗽功能和呼吸道感染的评估,并寻找任何睡眠呼吸暂停或通气不足的症状,评估周期为每年评估1次。相较于正常儿童,SMA患儿由于呼吸肌肌力弱,呼吸系统更脆弱、呼吸道更狭窄、胸腔容积也更小,易发生呼吸道感染、阻塞,甚至呼吸衰竭,因此呼吸状况检测与评估标准需结合实际情况综合考虑(表2)[28]。
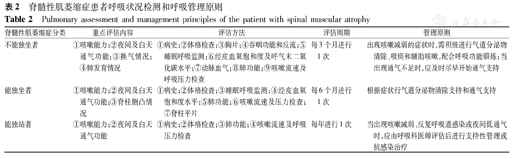
脊髓性肌萎缩症患者呼吸状况检测和呼吸管理原则
Pulmonary assessment and management principles of the patient with spinal muscular atrophy
脊髓性肌萎缩症患者呼吸状况检测和呼吸管理原则
Pulmonary assessment and management principles of the patient with spinal muscular atrophy
| 脊髓性肌萎缩症分类 | 重点评估内容 | 评估方法 | 评估周期 | 管理原则 |
|---|---|---|---|---|
| 不能独坐者 | ①咳嗽能力;②夜间及白天通气功能;③换气情况;④肺发育情况 | ①病史;②体格检查;③胸片;④吞咽功能和反流;⑤睡眠呼吸监测;⑥经皮血氧饱和度及呼气末二氧化碳水平;⑦动脉血气;⑧肺功能;⑨咳嗽流速及呼吸压力检查 | 每3个月进行1次 | 出现咳嗽减弱的症状时,需积极进行气道分泌物清除、吸痰和辅助咳嗽,配合呼吸功能锻炼;当出现通气不足时,应及时尽早开始通气支持 |
| 能独坐者 | ①咳嗽能力;②夜间及白天通气功能;③脊柱侧凸情况 | ①病史;②体格检查;③睡眠呼吸监测;④经皮血氧饱和度水平;⑤肺功能;⑥咳嗽流速及压力检查;⑦脊柱平片 | 每6个月进行1次 | 根据症状行气道分泌物清除支持和通气支持 |
| 能独站者 | ①咳嗽能力;②夜间及白天通气功能 | ①病史;②体格检查;③肺功能;④咳嗽流速及呼吸压力检查 | 每年进行1次 | 当出现咳嗽减弱、反复呼吸道感染或夜间低通气时,应由呼吸科医师评估后进行支持性管理或抗感染治疗 |
各型SMA患者应定期进行临床评估,即体格检查,以便及时发现和干预相关并发症,并根据病情决定随访周期和后续辅助检查[2]。体格检查主要包括呼吸的频率和幅度、胸围、胸围/头围比、胸腹是否存在矛盾呼吸、胸廓变形程度、脊柱侧凸程度、皮肤颜色(发绀或苍白),为评估呼吸功能提供重要依据[29]。1型SMA患儿在出生数周后胸围显著降低;当胸围/头围比<0.85,提示患儿将于3个月内死亡[30]。
在患者入院时,胸部X线片作为基线水平对照,可用于判断呼吸系统疾病恶化[29]。当SMA患者出现呼吸急促、咳嗽、发热等症状时,建议行胸部X线片,检查肺部感染情况。胸片检查是目前肺不张诊断的主要手段,有助于及时准确地发现肺实变情况[31];必要时可行CT检查。对于严重脊柱侧凸挤压肺组织的SMA患者,应行脊柱X线片以评估脊柱侧凸情况并指导器械矫正[1]。
维持正常吞咽功能对于不能独坐的SMA患儿非常重要。婴儿期的喂养和吞咽功能由营养专家进行全面评估,包括既往进食时间和方式、口腔及咽腭部结构,并给予治疗建议和指导,如进食姿势调整、食物质地增稠等。若存在吸吮无力、疲乏、湿啰音或肺炎等症状,可行吞咽动态透视录像造影检查(videofluoroscopic swallowing study,VFSS)评估吞咽困难及误吸情况,但不推荐作为常规检查项目[1,2]。VFSS用于检查是否存在食物残留、鼻穿孔、食管囊袋、下颌挛缩、进食时间增加等吞咽困难情况,常配合吞咽障碍造影评分量表(videofluoroscopic dysphagia scale,VDS)、Logemann′s造影检查吞咽功能表、吞咽生命质量量表(ALSFRS-R bulbar-related subscores and swallowing scale,SWAL-QOL)、Rosenbek渗透误吸量表、神经肌肉疾病吞咽状态量表(neuromuscular disease swallowing status scale,NdSSS)等进行定量评估[32,33,34,35]。此外,对于小年龄组、不能配合测量的患儿可采用高分辨测压(high resolution manometry,HRM)的被动方法测量气道咽腔的压力[36]。对于能独坐的SMA患者,若存在吞咽和喂养困难、进食呛咳等症状时也需要行VFSS;而能独站的SMA患者最大的营养健康问题为肥胖、超重、营养不良及相关并发症,一般不进行VFSS[2]。
多导睡眠监测(polysomnography,PSG)可持续监测患者的睡眠和呼吸情况,判断是否存在夜间低通气及SpO2下降[1]。所有l型及2型SMA患儿(包括不能独坐和能独坐者)确诊后,均需进行PSG监测,以便早期发现夜间低通气问题[29]。PSG检查尤其对于不能独坐的患儿更为重要,可判断患儿是否需要行夜间无创通气治疗。一旦出现夜间低通气和持续低氧血症,建议使用呼吸机辅助通气治疗[多采用双水平正压通气(bilevel positive airway pressure,BiPAP)],进一步预防日间低通气的发生[26]。PSG能够监测脑电图、眼电图、肌电图、心电图、口鼻气流、胸腹运动、SpO2、体位等指标,并得出呼吸暂停低通气指数(apnea hyponea index,AHI)、阻塞性呼吸暂停指数(obstructive apnea index,OAI),以全面评估呼吸肌无力的状况[39]。除了PSG,还可采用呼吸感应体积描记器(respiratory inductive plethysmography,RIP)记录SpO2、经皮PCO2、氧减饱和指数(oxygen desaturation index,ODI4)、AHI和睡眠时胸壁运动(相位角)等[40,41]。若无PSG和RIP等监测CO2的设备,夜间可采用脉搏血氧仪以发现持续或严重的SpO2下降[29]。
可在院外进行SpO2监测,有条件者可以同时进行呼气末二氧化碳分压(end-tidal carbon dioxide partial pressure,PETCO2)监测[1]。当SpO2<0.94,提示存在通气不足,首先启动气道分泌物清除[29];当SpO2<0.92或PCO2≥50 mmHg(1 mmHg=0.133 kPa)时,尽早给予无创通气(noninvasive ventilation,NIV)呼吸支持治疗[26];当患儿在NIV呼吸支持治疗下仍然不能维持氧合时,则需转为有创机械通气治疗。
在急性加重期,应在动态监测SpO2和/或PETCO2的基础上行ABG检查。制定通气方案需综合患者基础状况和平时耐受缺氧的情况。若出现pH<7.3或PCO2≥50 mmHg,应考虑给予NIV支持治疗。NIV后,应继续观察ABG、呼吸状况和一般情况,若仍未有缓解,可启动有创气管插管通气;若出现以下几种情况,如严重低氧血症、吸入氧浓度(fraction of inspire O2,FiO2)>0.5、PO2<50 mmHg、严重CO2潴留、明显呼吸困难、气道分泌物无法清除、频繁呼吸暂停,此时可启动机械通气呼吸支持治疗。由于ABG为侵入性检查,疼痛刺激可能会导致患者窒息或假性通气过度,不推荐作为常规检查项目[29]。
SMA患者的肺功能障碍主要是限制性通气功能障碍[1]。肺活量(vital capacity,VC)是神经肌肉疾病常用的检测指标,研究显示,2型和3型SMA患者用力肺活量(forced vital capacity,FVC)%预测值分别在5~13岁和8~13岁以4.2%/年和6.3%/年的速度下降[42]。当VC或FVC、第1秒用力呼气量(forced expiratory volume in the 1 s,FEV1)下降,而FEV1/FVC正常,呼吸流速容量环(tidal breath flow volume curve,TFV curve)面积减小时,提示SMA患者存在呼吸肌无力。通常使用呼吸面罩测量VC,避免因面部肌肉无力或开口困难而无法有效吹气;对于膈肌功能障碍患者,常检测坐位和仰卧位VC,数值下降>25%提示膈肌无力[26]。绝大多数SMA患儿均存在不同程度的口腔开合困难,因此,常规肺通气功能检测方法测得的肺功能结果往往较实际低,不能完全反映患儿实际通气功能状态。建议在评估患儿缺氧状态、呼吸支持、手术前呼吸功能评估等方面与临床实际的SpO2等指标相结合进行综合考虑。
呼吸肌肌力的评估除了可以通过观察呼吸模式及检测VC外,还可以通过其他无创或有创的方法来检测[26]。无创检测方法简单便捷,但其准确性与患者的配合度有关,对8岁以上的SMA患儿(多为2~3型)参考的价值更大。呼吸肌肌力指标主要包括最大吸气压力(maximal inspiratory pressure,MIP)/ MEP、SNIP、呼气流量峰值(peak expiratory flow,PEF)及PCF等。MIP/MEP指深吸气/呼气时经口所测的压力,通常使用肺功能仪或呼吸肌力测试仪分别在患者处于残气量(residual volume)位和肺总量(total lung capacity)位时测量MIP和MEP。呼吸肌力测试仪还可以检测SNIP,这对于3~4岁及以上的SMA患儿更简便易行。在患者做短、快、用力的鼻吸气动作时,检测鼻孔处的压力以表征SNIP。MIP及SNIP反映吸气肌肌力,MEP反映呼气肌肌力。PEF是指深吸气后用力呼气的最大瞬时流速,该指标和咳嗽时的呼气流量峰值(即PCF)均可使用便携式肺活量计、呼气峰值流量计、呼吸机评估。当上述指标低于预期值时,应怀疑存在呼吸肌无力。值得注意的是,当存在气道梗阻的情况时,尽管呼吸肌肌力正常,仍可测得较低的SNIP值[43]。
咳嗽能力也是评估呼吸肌肌力的重要部分。一般情况下,PCF<160 L/min或MEP<45 cmH2O(1 cmH2O=0.098 kPa)时,无法完成咳嗽。对于无法配合的婴幼儿,建议行有创测量方法,即于食管下括约肌和胃部置入导管(外径2.1 mm)和压力传感器,检测食管内压(esophageal pressure,Poes)和Pgas。Pgas与Poes变化的比值(ΔPgas/ΔPoes)反映了静息时呼吸肌的相对作用程度,健康人群ΔPgas/ΔPoes<-1;当-1<ΔPgas/ΔPoes<1时,出现潮式呼吸,且比值越大,说明胸腔及呼气肌的作用越大,膈肌的作用越小;当ΔPgas/ΔPoes=1时,说明已进展至完全性膈肌麻痹[26]。对于可配合的儿童而SNIP不能正确评估呼吸肌肌力时,可进一步测量最大鼻吸气时Poes和Pgas,也可通过测量咳嗽时Pgas和哭泣时经膈膜压力(transdiaphragmatic pressure,Pdi)加以辨别。Pdi计算公式为Pgas减去Poes。当呼吸肌无力时,这些指标均降低。此外,呼吸肌疲劳(respiratory muscle fatigability,RMF)也可影响SMA患者的呼吸功能,呼吸耐力测试(respiratory endurance test,RET)可通过不断增加吸气阻力直到力竭时的负荷值来评估呼吸肌疲劳状态[44]。
SMA患者的呼吸管理最终目标为延长生存,并达到正常气体交换,缓解睡眠呼吸问题,延长居家护理时间,提高生活质量。管理原则已由过去的被动治疗转变为主动管理,即尽早开始积极地呼吸管理[10]。研究显示,1995年至2006年比1980年至1994年出生的1型SMA患儿生存期显著延长,与机械通气和胃造瘘等有效干预措施的应用相关[45]。不同疾病分型和最大运动里程碑的SMA患者其管理策略各异,具体的管理方法应与呼吸问题评估的结果相对应。不能独坐者出现咳嗽减弱的症状时,需积极进行气道分泌物清除、吸痰和辅助咳嗽,配合呼吸功能锻炼;当出现通气不足时,应及时尽早开始通气支持。能独坐者亦推荐根据症状行气道清除支持和通气支持。而对于能独站者,当出现咳嗽减弱、反复呼吸道感染或夜间低通气时,应由呼吸科医师评估后进行支持性管理或抗感染治疗(表2)。
NIV能够通过吸气时提供气道正压以维持足够的潮气量和每分通气量,发挥稳定气体交换并纠正肺泡通气不足的作用[26]。有夜间或日间低通气症状或不能独坐的SMA患者均应尽早行NIV,以延缓呼吸衰竭进程,减轻"钟形"胸廓病变和肺发育不良,并减少重症监护住院次数。对于无吞咽功能障碍的SMA患者,在急性呼吸道感染期间使用NIV可缓解呼吸道症状,降低呼吸负担。推荐使用BiPAP进行NIV,可设置高吸气相气道正压和低呼气相气道正压以保证呼吸肌无力患者呼吸充足。非必要不推荐使用持续气道正压通气(continuous positive airway pressure,CPAP)。建议使用压力滴定方法来启动NIV,由经验丰富的临床医师为患者选择和安装接口装置(鼻罩、口鼻罩、全面罩等)[10]。
对于NIV不足以改善病情,或无法进行NIV的患者,可以选择气管切开术的有创通气方法。长期有创通气的选择应在关注临床状况、预后和生活质量的基础上,充分参考家属意见后决定[46]。
气道廓清技术包括大气道清除技术(辅助吸气技术、辅助呼气技术和辅助吸呼气技术)和小气道清除技术[胸部叩击、体位引流、肺内振荡通气(intrapulmonary percussive ventilation,IPV)和高频胸壁振动等]。对于所有不能独坐者,推荐采用大气道联合小气道清除技术,再通过口鼻吸痰清除气道分泌物。辅助吸气技术通过增加肺容积而增加PCF,用间歇正压呼吸(intermittent positive pressure breathing,IPPB)装置或有单向阀的肺容量补充装置可实现辅助吸气。辅助呼气技术可通过手法辅助咳嗽(manually-assisted cough,MAC)实现,MAC时,治疗师在患者咳嗽时用手按住患者腹部,施加向上压力,使膈膜向上移动,以增加呼气气流。辅助吸呼气技术是将辅助吸气技术与MAC相结合,或使用咳嗽辅助机[即机械性吸-呼气技术(mechanical insufflation-exsufflation,MI-E)],以更好地改善PCF。咳嗽辅助机通过向肺部充气以膨胀肺部,迅速转换为负压,产生快速的呼气气流完成模拟咳嗽过程,从而将分泌物向上气道移动;咳嗽辅助机可连接面罩或气管插管或气管造口管使用,不仅可以辅助咳痰,而且可以帮助肺扩张,延缓胸廓发育畸形的发生。MI-E能够产生足够的PCF,对低PCF(<160 L/min)者非常有效,可用于部分无法配合MAC或MAC无效的患儿。PCF较高者还可选择辅助吸气技术和MAC相结合使用。
SMA患者应根据病情进行气道分泌物清理[10,46]。1型SMA患者由于咳嗽无力,建议日常积极地进行气道分泌物清理,推荐胸部叩击、胸部振动、体位引流等与MI-E联合应用,同时应进行口鼻吸痰,可2次/d,呼吸道感染时要加强分泌物清理[10]。MI-E使用时,正负压压力设置应逐渐增加至30~40 cmH2O或最大耐受压力[10]。2型SMA患者若咳嗽无力,可按需进行气道分泌物清理。3型SMA患者在呼吸道感染、咳嗽无力时需要进行气道分泌物清理。
SMA患者会出现GERD及吞咽功能障碍,吞咽功能障碍会增加反流与误吸风险。减少SMA患者反流与误吸可减少相关呼吸道症状,减少吸入性肺炎的发生。减少反流可通过抬高体位及幽门后喂养(即在超声引导下,将鼻肠管置入幽门后给予肠内营养的方式)或胃底折叠术实现。对严重反流者,可考虑行空肠造瘘或胃底折叠术配合胃造瘘以减少反流发生。吞咽功能障碍者需要喂养支持,可短期应用鼻饲管或长期经胃造瘘或空肠造瘘喂养。研究显示SMA患者通过胃造瘘喂养可增长体质量,减少因吸入性肺炎的住院次数,延长生存期[47]。
积极的呼吸功能锻炼是延缓疾病进展的重要手段,应贯穿治疗的全过程。呼吸功能的锻炼,包括呼吸肌训练、维持胸廓顺应性训练、咳嗽和排痰训练等[1]。数据库调研显示,神经肌肉疾病患者进行呼吸肌训练可提高部分神经肌肉疾病患者的VC和呼吸肌的力量[48,49],可通过吹气球、大声朗诵和唱儿歌等游戏类活动来进行,也可在评估膈肌活动度后通过卧位时剑突下放置适当重量的沙袋来训练膈肌,还可用专门的呼吸肌训练器进行。主动或被动的肋间肌牵伸与肋骨活动可延缓胸廓畸形和胸部顺应性的下降。用有单向阀的肺容量补充装置进行空气堆叠,不仅能提高咳嗽能力,还可减缓FVC的下降[50]。呼吸功能锻炼的方法及强度要根据患儿情况个体化选择,避免出现呼吸困难及疲劳。
居家管理对1型、2型和体质虚弱的3型SMA患者至关重要,合理的居家护理有助于改变疾病轨迹,提高患者及其家庭获益[10,51,52]。在疾病确诊后应给予患儿家人家庭护理方案的指导;存在慢性呼吸功能不全者,应予家庭机械通气支持;在患儿出院前专科医师组织多学科会诊,制订家庭支持方案,应系统地培训家长及其照护者相关技能,包括危急状态的识别及处理、日常监测指标(呼吸、心率、脉氧、呼吸机参数等)、心肺复苏术、氧疗术、气道廓清技术、气切护理、营养支持(鼻饲)、无菌概念、家庭呼吸机的操作、设备故障应急处理等。
目前,我国SMA患者使用无创呼吸机或咳嗽辅助机的比例明显低于国外平均水平,除了家庭经济状况的原因,家人对呼吸机使用的正确认知尚有待提高[46]。因此,临床工作者需对患者家人给予家庭护理方案的培训和指导,包括了解SMA的疾病特征和临床表现以及患者生命体征和呼吸功能的监测,并熟知呼吸道分泌物清除和MAC的流程以及呼吸机、咳嗽辅助机的使用方法[10]。此外,家庭成员还应掌握SMA患者需急诊救治的时机,SpO2下降、心动过速、发绀等现象预示着出现呼吸抑制;必要时签署心肺复苏同意书,供急诊救治所用。最重要的是SMA患儿需要复杂的医学支持,然而目前尚无完善的社区-家庭-医院-医保的社会综合保障系统。
在SMA急症管理过程中,应优先考虑加强分泌物清除和辅助咳嗽[10]。如前所述,可根据SpO2的变化以确定咳嗽辅助机的使用需求;若SpO2<0.94,应行经口腔/气道吸痰、纤维支气管镜、胸部理疗和体位引流[53]。具体SMA的分泌物清除方法可参考威斯康星大学推荐的方案,即行4组咳嗽辅助机辅助咳嗽(5次/组)后吸痰,拍背振荡痰液或CPT 10 min,再行4组咳嗽辅助机辅助咳嗽(5次/组)和吸痰,能耐受的情况下体位引流15~20 min,再行4组咳嗽辅助机辅助咳嗽(5次/组)和吸痰。推荐居家每4 h 1次、住院期间可每2 h 1次行上述分泌物清除方案。
建议急症期间尽早进行NIV以保证充足的气体交换。推荐使用BiPAP,相比于CPAP,BiPAP可通过增加患者潮气量和降低呼吸频率来减少呼吸肌做功,在患者清醒期间缓解呼吸肌疲劳,与分泌物清除术联用还能减少插管次数[10]。
如果气道清除技术和呼吸支持已达最大化,低氧血症继续存在,可以考虑进行氧疗。但氧疗不是一线治疗,且在没有进行正压通气或CO2气体交换监测的情况下,不建议经验性吸氧。
SMA患者入院时即应评估是否符合气管切开术标准,需考虑下颌骨挛缩、颈部活动受限、体位限制、患者及家属偏好等因素[10]。气管切开术后插管进行有创通气治疗,可改善通气不足,提高患者舒适度,便于气道吸痰。气管插管的指征一般为NIV后仍出现SpO2持续下降,或出现高碳酸血症,即在观察到PCO2升高10~20 mmHg时进行插管。还可根据"20/30/40规则",当出现FVC<20 mL/kg、MIP<30 cmH2O、MEP<40 cmH2O时,提示可行气管插管。短期有创通气在急性期疾病好转,即吸入空气状态下SpO2恢复正常,且满足胸片清晰、辅助咳痰的痰液量显著减少且24 h内未使用镇静剂的条件后,应尽快拔管并恢复NIV[54]。SMA患者拔管期间,应维持NIV作为过渡支持,同时需要注意痰液阻塞和SpO2水平,建议每10 min使用MI-E或MAC以清除分泌物并维持SpO2水平于95%,可进行口腔吸痰;撤机前确保未发生高碳酸血症[55]。若拔管后在持续使用NIV的情况下SpO2仍持续下降,虽无高碳酸血症,也应考虑再次插管[55]。
此外,SMA急症期间的营养支持应采用持续肠内营养喂养或静脉营养的疗法,保证适当补充水分和维持电解质平衡;避免禁食>6 h,防止代谢性酸中毒、高/低血糖或脂代谢异常[10]。
不能独坐和能独坐SMA患者因咳嗽减弱和分泌物清除障碍易并发反复上、下呼吸道感染,能独站的SMA患者亦会并发通气障碍和手术期间呼吸道感染[29]。常见引起呼吸道感染的病毒包括呼吸道合胞病毒、流感病毒等,细菌包括肺炎链球菌、金黄色葡萄球菌等,还有肺炎支原体、肺炎衣原体[56]。对于感染的评估可根据临床表现和辅助检查初步判断感染的病原种类,进一步的病原学检测有助于精准诊断呼吸道感染,指导药物合理应用。血常规联合C反应蛋白(C-reactive protein,CRP)对于鉴别是否为细菌感染具有一定的诊断价值。此外,根据病情需要可实施免疫学检测与其他辅助检测手段,包括耳镜、鼻境、咽喉镜以及相关影像学检查等[57]。
由于SMA患者存在咳嗽无力,不易获取合格的痰样本,痰培养的诊断价值有限。建议采集鼻咽吸取物或鼻咽拭子检测呼吸道病毒感染。儿童尿液样本中的肺炎链球菌定植率高,可用于肺炎链球菌尿抗原检测、军团菌尿抗原检测。支气管肺泡灌洗或吸出物或血液样本适合免疫力低下的重症患者,肺炎伴胸腔积液患儿的病原学可采用胸腔积液样本。上述样本检测除病原体阳性不一定代表呼吸道感染,还需根据病原体种类和载量谨慎判断。SMA患者应结合感染病原体分布特征和检测方法选择合适的临床标本,尽可能采集多种类型的样本和/或连续多个时间点采集样本,以提高检测敏感度。
当SMA患者出现急性呼吸失代偿、呼吸道感染、误吸和严重分泌物清除障碍时,应实施紧急转运。若患有常规疾病(如胃肠炎、阑尾炎)或发生骨折,亦需紧急转运住院和外科手术治疗。制定紧急转运方案时,应具体问题具体分析,充分考虑个体疾病状况、治疗目标、医疗中心距离和急救配置。建议1型和2型SMA患儿在三级医疗中心或儿童专科医院进行住院治疗,急救时应配备心肺复苏、无创通气相关仪器,急救人员需熟知无创通气和气管切开术操作方法。在急症管理期间,神经内科、儿科、呼吸内科、康复科等多学科医师的参与至关重要[10]。遵循"转运途中安全第一、不安全不转运"原则,转运前生命指征应基本稳定,通气有保障,必要时转运前进行气管插管或气管切开术。
据统计,中国1~3型SMA患者因肺部感染住院比例为24.7%~61.5%[58]。当SMA患者出现肺部感染时,原则上应综合具体情况进行病原学检查和感染评估[46]。推荐患者急症期使用抗生素,以安全有效为原则,可以根据药代动力学、药效学、组织分布浓度及不良反应等选择,重症肺炎可适当加大剂量。抗生素使用时长可至全身和呼吸道症状改善、热退且平稳后3~5 d;疗程为普通肺炎链球菌肺炎7~10 d,有肺部并发症者至少4~6周[46,56]。不能独坐的SMA患者若频繁出现急性肺部感染,可考虑进行气管切开和机械通气的呼吸管理,并配合药物治疗(如阿奇霉素治疗肺炎支原体感染)。但合并感染新型冠状病毒肺炎时,应慎用羟氯喹和阿奇霉素,可能会导致肌无力恶化和心律失常[59]。目前没有证据表明常规使用广谱抗生素预防呼吸道感染可使无呼吸道感染及无气管切开的SMA患者临床获益,反而过度使用抗生素可能导致细菌耐药的发生。
如果SMA患者合并有哮喘或气道高反应性,可使用支气管扩张剂及糖皮质激素雾化治疗,具体使用需遵从儿童哮喘防治指南的推荐[60]。
当SMA患者存在流涎时,可以考虑药物治疗。目前尚无证据支持长期使用痰液溶解剂、3%或7%高渗盐水、阿法链道酶雾化吸入剂。过度使用盐水会稀释正常黏度的分泌物,增加分泌负担。还应谨慎使用格隆溴铵治疗唾液分泌过多,小心调整剂量,避免分泌物过度干燥堵塞气管。关于是否可采用唾液腺中注射肉毒杆菌毒素以减少口腔分泌物的产生尚未达成共识[10]。
此外,当出现GERD时应进行积极检查和治疗,同时需通过鼻胃管或鼻十二指肠管或胃造瘘给予适当的营养支持和补液[46]。
早期对SMA患者的呼吸系统问题进行干预和管理可显著降低患者呼吸系统疾病的发病率和死亡率,此外,病因治疗仍然至关重要[10]。近年来,SMA病因治疗进展迅速,主要目的为增加功能性SMN蛋白含量。疾病修正药物的一种策略为通过修饰SMN2基因外显子7的pre-mRNA,促进外显子7的转录,其代表性药物利司扑兰(Risdiplam)、诺西那生钠(Nusinersen)已在中国获批上市;另一种策略为通过腺相关病毒(adeno-associated virus,AAV9)衣壳载入SMN1启动子,向患者体内引入一个拷贝数的外源SMN1基因,Zolgensma(Onasemnogene abeparvovec)于2019年获美国食品药品监督管理局(FDA)批准上市。此外,独立于SMN蛋白表达,作用于肌肉的小分子药物瑞地生替(Reldesemtiv)、SRK-105正在进行Ⅱ期临床试验。相关研究结果的公布揭示了在呼吸管理方面的获益。
利司扑兰是目前全球首个用于治疗SMA的口服小分子化合物,可穿过血脑屏障分布于中枢和外周[61,62]。利司扑兰的呼吸相关临床研究终点为无事件生存率(无死亡或使用永久辅助通气)。研究显示,接受利司扑兰治疗12个月后,患儿的存活率显著提高,85%~90%存活且无需永久性辅助通气[63,64]。同时,大部分存活患儿保留吞咽功能[64]。
诺西那生钠是一种反义寡核苷酸,通过鞘内注射给药。诺西那生钠无法穿过血脑屏障,SMN蛋白含量的提高主要分布在中枢神经系统[65]。诺西那生钠在其临床试验中包含了呼吸相关临床研究终点[66,67]。研究表明[66],诺西那生钠治疗提高了患儿的无事件生存率,永久辅助通气需求低于对照组。
随着疾病修正类药物临床研究结果的揭示和真实世界的应用,SMA患者结局得到改善,对于呼吸管理的依赖性亦发生变化。普及新生儿筛查,对有症状和症状前患儿进行早期诊断和治疗尤为重要[12]。当使用利司扑兰、诺西那生钠和Zolgensma治疗时,应基于SMA患者的分型和临床表现,包括呼吸相关表型,以全面评估药物的疗效,同时需严密监测呼吸相关结局,包括肺功能、夜间低通气情况等。目前,相对年长的非1型SMA患者或具有严重的神经肌肉和肺部疾病的患者使用疾病修正药物的呼吸相关临床获益仍不明确;并且,尚缺乏对这些疾病修正药物联合治疗或单药治疗的比较研究[72]。故治疗药物的选择,还需考虑SMA患者的具体情况,并在与家属充分沟通、获得一致同意的情况下进行。
在疾病康复期间,需加强对住院时长、氧气需求、呼吸支持升级等数据的监测和记录。在SMA患儿的呼吸功能稳定,生活质量得到提高后,仍需注意居家护理,预防急症出现,有条件的家庭可配备相应仪器设备。另外,注意跟踪患儿心理健康状态同样重要。
对于易反复呼吸道感染的SMA患儿来说,建议按计划接种各种疫苗,疫苗接种可预防肺炎发生或降低肺炎及流感的发生次数[73]。SMA患儿2岁前可接种全程4针的13价肺炎球菌疫苗,其中2.5、3.5、4.5、12.5月龄各1针;2岁以后,每5年接种1次23价肺炎球菌疫苗[1]。感染流感对SMA患儿是致命的,故建议每年接种流感疫苗。在呼吸道合胞病毒流行的冬季,6个月~1岁的SMA患儿可考虑使用帕利珠单抗进行防护;有条件还可接种呼吸道合胞病毒疫苗。
呼吸衰竭一直是SMA患儿死亡的主要原因。我国一些地区已开展SMA的新生儿筛查,这一举措促成了治疗窗口的提前[74,75]。近年来上市的疾病修正治疗药物延长了1型SMA患儿的生存,并降低了通气管理时长,但仍需关注用药的长期疗效和对呼吸系统的影响。治疗药物的选择需考虑患者实际情况,康复期间仍需注意居家护理。目前,我国尚缺乏针对SMA患者呼吸系统疾病诊断和治疗的循证医学研究,相关诊疗方案的制定亦刚刚起步。故积极进行呼吸功能管理可能大幅度改善患者预后。期待本共识有助于提高临床SMA的呼吸管理水平,提高患儿生活质量,最终改变疾病轨迹。
(常丽 执笔)
参与本共识制定的专家(按汉语拼音排序):安淑华(河北省儿童医院);鲍燕敏(深圳市儿童医院);常丽(首都儿科研究所附属儿童医院);陈强(江西省儿童医院);陈星(山东第一医科大学附属省立医院);陈艳萍(湖南省儿童医院);符州(重庆医科大学附属儿童医院);侯舒(安徽医科大学第一附属医院);韩志英(山西省儿童医院);姜源(浙江大学医学院附属儿童医院);刘长山(天津医科大学第二医院);卢根(广州市妇女儿童医疗中心);刘瀚旻(四川大学华西第二医院);李建华(中华实用儿科临床杂志);农光民(广西医科大学第一附属医院);彭晓音(首都儿科研究所附属儿童医院);任晓旭(首都儿科研究所附属儿童医院);尚云晓(中国医科大学附属盛京医院);陶金好(复旦大学附属儿科医院);王家勤(新乡医学院第三附属医院);吴谨准(厦门大学附属妇女儿童医院);徐保平(首都医科大学附属北京儿童医院);徐佩茹(新疆医科大学儿科学院);殷晓荣(福建医科大学附属协和医院);殷勇(上海交通大学医学院附属上海儿童医学中心);张建华(上海交通大学医学院附属新华医院);钟礼立(湖南省人民医院);张琴(南京医科大学附属儿童医院)
所有作者均声明不存在利益冲突

吞咽障碍造影评分量表
吞咽障碍造影评分量表
| 项目 | 评分标准 |
|---|---|
| 1.唇闭合 | 0=正常(食团无溢出唇);2=不充分(<50%食团从唇间溢出);4=不闭合(>50%的食团从唇间溢出) |
| 2.食团成形 | 0=正常(食团聚集在一起);3=不完全成形(小部分食物未聚集成食团);6=不成形(大部分食团分散于口腔中) |
| 3.咀嚼 | 0=正常(快速、有效的咀嚼);4=不充分咀嚼(小部分食团进人咽部前未被咀嚼);8=不咀嚼(大部分食团进入咽部前未被咀嚼) |
| 4.吞咽失用 | 0=正常(舌、唇、下颌协调);1.5=轻度失用(舌、唇、下颌轻度不协调);3=中度失用(舌、唇、下颌中度不协调);4.5=重度失用(舌、唇、下颌重度不协调) |
| 5.舌与硬腭接触 | 0=正常(舌与硬腭完全接触);5=不充分接触(舌与硬腭接触面积>50%);10=不接触(舌与硬腭接触面积<50%) |
| 6.食团后漏 | 0=正常(整个食团控制在舌与软腭之间);1.5=<10%的食团后漏(诱发吞咽启动前<10%的食团通过舌根与下颌支的交点);3=10%~50%的食团后漏(诱发吞咽启动前10%~50%的食团通过舌根与下颌支的交点);4.5=>50%的食团后漏(诱发吞咽启动前>50%的食团通过舌根与下颌支的交点) |
| 7.口腔运送时间 | 0=正常(在舌推动下食团开始变形至食团头部到达舌根与下颌支交点的时间≤1.5 s);3=异常(在舌推动下食团开始变形至食团头部达到舌根与下颌支交点的时间>1.5 s) |
| 8.咽期吞咽启动 | 0=正常(舌骨首次位移时,食团到达舌根与下颌支的交点);4.5=延迟(舌骨首次位移时,食团头部超过舌根与下颌支的交点) |
| 9.会厌谷残留 | 0=正常(会厌谷无食团残留);2=少量残留(会厌谷食团残留量<10%);4=中等量残留(会厌谷食团残留量10%~50%);6=大量残留(会厌谷食团残留量>50%) |
| 10.喉上抬 | 0=正常(甲状软骨向上运动完全,杓状软骨与会厌谷柄完全接近);9=异常(甲状软骨向上运动不完全,杓状软骨与会厌谷柄不完全接近) |
| 11.梨状隐窝残留 | 0=正常(梨状隐窝无食团残留);4.5=少量残留(梨状隐窝食团残留量<10%);9=中等量残留(梨状隐窝食团残留量10%~50%);13.5=大量残留(梨状隐窝食团残留量>50%) |
| 12.咽后壁残留 | 0=正常(咽后壁无食团残留);9=残留(咽后壁有食团残留) |
| 13.咽期通过时间 | 0=正常(舌骨开始位移时至食团尾部到达上食管括约肌的时间<1 s);6=异常(舌骨开始位移时至食团尾部到达上食管括约肌的时间>1 s) |
| 14.误吸 | 0=正常(食团未进入喉前庭);6=渗透(食团进入喉前庭未进入声门);12=误吸(食团进入声门) |
注:量表共0~100分;非严重误吸:≤24分;严重误吸:>24分


























