
探讨重症腺病毒肺炎患儿静脉注射丙种球蛋白(IVIG)的治疗时机、剂量选择对疾病转归的影响及安全性评估。
回顾性分析2019年1月至2020年1月广州医科大学附属广州市妇女儿童医疗中心呼吸科使用IVIG治疗的重症腺病毒肺炎患儿临床资料。根据IVIG治疗的时间分层,分为早期应用(病程5~10 d)和晚期应用(病程11~15 d);再根据不同剂量的丙种球蛋白分组,方案1组:1 g/(kg·d),共2 d;方案2组:0.4~0.5 g/(kg·d),共3~5 d,收集患儿的临床资料进行分析。连续变量的2组分析采用非参数Mann-Whitney U检验;分类变量采用Fisher′s精确检验。
共202例患儿入组,中位年龄为12(12,36)个月,其中128例(63.37%)为早期应用者,74例(36.63%)为晚期应用者。晚期应用患儿发热时长较早期应用患儿更长[18.00(14.00,23.25) d比11.00(9.00,14.00) d],对机械通气的需求增加(33.78%比20.31%),后遗症支气管扩张的发生率更高(9.46%比1.56%),差异均有统计学意义(均P<0.05)。对于早期应用患儿,2种剂量组在高级生命支持的需求、预后和后遗症方面比较差异均无统计学意义(均P<0.05)。而对于晚期应用患儿,方案1组较方案2组患儿发热时间缩短[18.00(14.00,21.00) d比21.00(15.50,30.75) d],体外膜肺(ECMO)的需求率明显降低(2.13%比18.52%),差异均有统计学意义(均P<0.05)。肺部后遗症,如感染后闭塞性细支气管炎和支气管扩张的发生率在2种剂量组间比较差异均无统计学意义(均P>0.05)。IVIG时不良事件发生率为5.77%,2种剂量组比较差异无统计学意义(P>0.05)。
早期给予IVIG治疗对改善重症腺病毒肺炎患儿的预后非常重要。对于晚期应用患儿,高剂量IVIG治疗可缩短发热时间,减少ECMO的使用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人腺病毒(HAdV)是儿童呼吸道感染常见的病原体之一,在急性下呼吸道病毒感染中占3.8%~16.0%[1,2],且发病率有升高趋势。有研究表明,腺病毒感染占重症肺炎的32.2%,也是5岁以下中国儿童肺炎死亡的主要病原[3,4]。重症腺病毒肺炎发病急,病情重,并发症多,病死率可高达10%,14%~60%的存活者可遗留不同程度的后遗症[3,5]。儿童腺病毒呼吸道感染可导致急性呼吸窘迫综合征(ARDS)、肺实变等急性肺损伤以及感染后闭塞性细支气管炎(PIBO)、单侧透明肺、支气管扩张、肺间质纤维化等肺部后遗症[5,6]。但目前尚未见针对腺病毒肺炎的特异性治疗[7,8]。静脉注射丙种球蛋白(IVIG)包括多种免疫球蛋白分子,具有特异的抗菌和抗病毒效果[9,10,11],因此作为重症腺病毒肺炎的辅助治疗近年来广泛应用于临床。然而,目前临床上对重症腺病毒肺炎患儿使用丙种球蛋白时机和剂量等尚无明确共识。因此,本研究针对IVIG治疗儿童重症腺病毒肺炎的时机以及不同剂量对预后的影响与安全性方面进行分析,为临床治疗方案的制定提供依据。
回顾性分析2019年1月1日至2020年1月1日在广州市医科大学附属广州市妇女儿童医疗中心就诊的202例重症腺病毒肺炎患儿。
本研究入组标准:(1) 28 d<年龄≤18岁;(2)选用PCR方法在患儿鼻咽拭子和/或痰液、支气管肺泡灌洗液中检测到腺病毒DNA证实为腺病毒感染;(3)符合《儿童腺病毒肺炎诊疗规范(2019年版)》腺病毒肺炎重症诊断标准[8]。排除标准:(1)丙种球蛋白给药前已进入儿科重症监护室(PICU);(2)已知或疑似活动性肺结核,严重伴发疾病(慢性肺部疾病,如哮喘、严重心血管疾病、肿瘤、肾脏或肝脏疾病等),免疫功能低下状态(原发性免疫缺陷、获得性免疫缺陷、入院前给予免疫抑制药物等)。
收集重症腺病毒肺炎患儿的临床资料,包括性别、年龄、主诉、主要症状体征、治疗经过,预后及IVIG不良事件发生情况等。所有患儿入院后采集鼻咽拭子和/或痰液、肺泡灌洗液进行病原检测。非典型病原体及常见呼吸道病毒采用实时荧光定量PCR检测,细菌培养送检样本按《全国临床检验操作规程(第4版)》进行常规细菌分离培养和鉴定[12]。
本研究获得医院医学伦理委员会批准[批准文号:穗妇儿科伦通字(2020)第49600号],患儿监护人均知情同意。
本研究根据观察性研究的STROBE(Strengthening the Reporting of Observational Studies in Epidemiology)指南(http://strobe-statement.org/)进行设计。为减少时间依赖性偏倚,对重症腺病毒肺炎患儿按丙种球蛋白给药时间进行分层分析,并以发热(体温≥37.5 ℃)作为腺病毒肺炎的初始症状计算病程。患儿就诊时机不同,丙种球蛋白应用时机也有所不同,因此根据就诊后应用丙种球蛋白时间将患儿分为2层:(1)早期应用:病程5~10 d给予丙种球蛋白治疗;(2)晚期应用:在病程11~15 d内给予丙种球蛋白治疗。进一步在各层内,根据不同的丙种球蛋白用法将患儿分为2组:(1)方案1组,1 g/(kg·d),连用2 d;(2)方案2组,0.4~0.5 g/(kg·d),连用3~5 d。每层比较2组患儿的人口统计学特征、实验室检查结果、影像学特征及对疾病转归影响等情况。
主要观察终点:(1)高级生命支持使用情况:机械通气、连续性血液净化(CBP)、体外膜肺(ECMO);(2)发热持续时长;(3)住院时长;(4)死亡率。
次要观察终点:后遗症发生情况包括PIBO和支气管扩张。所有患儿门诊随访至少3个月以上,并定期复查胸部高分辨率CT,PIBO诊断依据《儿童闭塞性细支气管炎的诊断与治疗建议》(2012版)[13],支气管扩张诊断依据《儿童支气管扩张症诊断与治疗专家共识》(2018版)[14]。
最后,比较不同剂量IVIG不良事件的发生率,包括面色潮红、头痛、发热、寒战、恶心呕吐、肌痛、过敏性休克、溶血等。
应用GraphPad Prism 8.0软件进行统计学分析。由于本研究中连续变量的数据为偏态分布,数据采用M(P25,P75)表示。连续变量的2组分析采用非参数Mann-Whitney U检验;分类变量采用Fisher′s精确概率法。P<0.05为差异有统计学意义。
共202例患儿(男123例,女79例)纳入本研究,中位年龄为12(12,36)个月,最小年龄为1个月,最大年龄为12岁。其中,128例(63.37%)为早期应用IVIG,74例(36.63%)为晚期应用IVIG,均有发热、咳嗽和呼吸急促。中位发热持续时间为13(10,18) d。合并感染病原以细菌(65/202例,32.18%)和肺炎支原体(52/202例,25.74%)居多。肺部影像学表现以实变(150/202例,74.26%)最为常见,其次为胸腔积液(62/202例,30.69%)。重症腺病毒肺炎患儿的中位住院时长15(10,20) d,总死亡率为4.95%(10/202例)。
根据给药时间对202例患儿进行分层分析。早期和晚期两层间的人口统计学特征、临床症状体征、IVIG前治疗(抗生素、激素等)等方面比较差异均无统计学意义(均P> 0.05)。在入院时的实验室检查结果中,晚期应用患儿的血红蛋白水平较低,乳酸脱氢酶(LDH)较高,白蛋白水平较低,差异均有统计学意义(均P<0.05)(表1)。转归方面,ARDS是最常见的全身并发症(35/202例,17.33%)。其他全身并发症包括脓毒症休克(27/202例,13.37%)、多器官功能障碍综合征(MODS)(19/202例,9.41%)、噬血细胞综合征(HLH)(3/202例,1.49%)。此外,晚期应用患儿发热时间长,机械通气需求增加,支气管扩张比例增高,差异均有统计学意义(均P<0.05)(表1)。
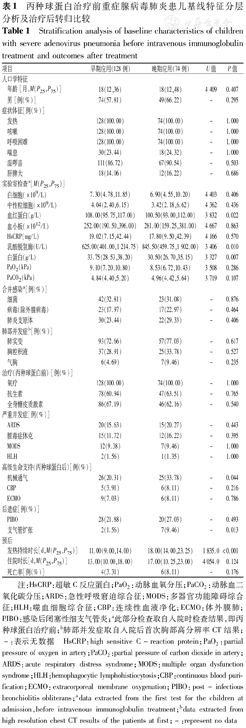
丙种球蛋白治疗前重症腺病毒肺炎患儿基线特征分层分析及治疗后转归比较
Stratification analysis of baseline characteristics of children with severe adenovirus pneumonia before intravenous immunoglobulin treatment and outcomes after treatment
丙种球蛋白治疗前重症腺病毒肺炎患儿基线特征分层分析及治疗后转归比较
Stratification analysis of baseline characteristics of children with severe adenovirus pneumonia before intravenous immunoglobulin treatment and outcomes after treatment
| 项目 | 早期应用(128例) | 晚期应用(74例) | U值 | P值 | |
|---|---|---|---|---|---|
| 人口学特征 | |||||
| 年龄[月,M(P25,P75)] | 18(12,36) | 18(12,48) | 4 409 | 0.407 | |
| 男[例(%)] | 74(57.81) | 49(66.22) | - | 0.295 | |
| 症状体征[例(%)] | |||||
| 发热 | 128(100.00) | 74(100.00) | - | 1.000 | |
| 咳嗽 | 128(100.00) | 74(100.00) | - | 1.000 | |
| 呼吸困难 | 128(100.00) | 74(100.00) | - | 1.000 | |
| 喘息 | 30(23.44) | 18(24.32) | - | 1.000 | |
| 湿啰音 | 111(86.72) | 67(90.54) | - | 0.503 | |
| 肝脾大 | 18(14.06) | 12(16.22) | - | 0.686 | |
| 实验室检查a[M(P25,P75)] | |||||
| 白细胞(×109/L) | 7.30(4.78,11.85) | 6.90(4.55,10.20) | 4 403 | 0.406 | |
| 中性粒细胞(×109/L) | 4.04(2.40,6.15) | 3.42(2.18,6.62) | 4 362 | 0.436 | |
| 血红蛋白(g/L) | 108.00(95.75,117.00) | 100.50(93.00,112.00) | 3 832 | 0.022 | |
| 血小板(×1012/L) | 252.00(190.50,396.00) | 281.00(159.25,381.00) | 4 667 | 0.863 | |
| HsCRP(mg/L) | 19.02(7.15,42.44) | 17.80(9.50,42.39) | 4 166 | 0.570 | |
| 乳酸脱氢酶(U/L) | 625.00(401.00,1 214.75) | 845.50(459.75,1 902.00) | 3 406 | 0.010 | |
| 白蛋白(g/L) | 33.75(28.53,38.20) | 30.50(26.70,35.15) | 3 327 | 0.007 | |
| PaO2(kPa) | 9.10(7.20,10.80) | 8.53(6.72,10.43) | 3 508 | 0.286 | |
| PaCO2(kPa) | 4.84(4.40,5.20) | 4.96(4.42,5.64) | 3 719 | 0.107 | |
| 合并感染a[例(%)] | |||||
| 细菌 | 42(32.81) | 23(31.08) | - | 0.876 | |
| 病毒(除外腺病毒) | 23(17.97) | 17(22.97) | - | 0.464 | |
| 肺炎支原体 | 30(23.44) | 22(29.33) | - | 0.406 | |
| 肺部并发症b[例(%)] | |||||
| 肺实变 | 93(72.66) | 57(77.03) | - | 0.617 | |
| 胸腔积液 | 37(28.91) | 25(33.78) | - | 0.527 | |
| 气胸 | 6(4.69) | 7(9.46) | - | 0.235 | |
| 治疗(丙种球蛋白前) [例(%)] | |||||
| 氧疗 | 128(100.00) | 74(100.00) | - | 1.000 | |
| 抗生素 | 78(60.94) | 47(63.51) | - | 0.765 | |
| 全身糖皮质激素 | 86(67.19) | 46(62.16) | - | 0.540 | |
| 严重并发症[例(%)] | |||||
| ARDS | 20(15.63) | 15(20.27) | - | 0.443 | |
| 脓毒症休克 | 15(11.72) | 12(16.22) | - | 0.395 | |
| MODS | 12(9.38) | 7(9.46) | - | 1.000 | |
| HLH | 2(1.56) | 1(1.35) | - | 1.000 | |
| 高级生命支持(丙种球蛋白后)[例(%)] | |||||
| 机械通气 | 26(20.31) | 25(33.78) | - | 0.044 | |
| CBP | 5(3.91) | 6(8.11) | - | 0.216 | |
| ECMO | 9(7.03) | 6(8.11) | - | 0.786 | |
| 后遗症[例(%)] | |||||
| PIBO | 28(21.88) | 20(27.03) | - | 0.493 | |
| 支气管扩张 | 2(1.56) | 7(9.46) | - | 0.013 | |
| 预后 | |||||
| 发热持续时长[d,M(P25,P75)] | 11.00(9.00,14.00) | 18.00(14.00,23.25) | 1 835.0 | <0.001 | |
| 住院时长[d,M(P25,P75)] | 13.00(10.00,18.00) | 17.00(10.25,23.00) | 4 054.0 | 0.124 | |
| 死亡率[例(%)] | 4(3.31) | 6(8.11) | - | 0.176 | |
注:HsCRP:超敏C反应蛋白;PaO2:动脉血氧分压;PaCO2:动脉血二氧化碳分压;ARDS:急性呼吸窘迫综合征;MODS:多器官功能障碍综合征;HLH:噬血细胞综合征;CBP:连续性血液净化;ECMO:体外膜肺;PIBO:感染后闭塞性细支气管炎;a此部分检查取自入院时检查结果,即丙种球蛋白治疗前;b肺部并发症取自入院后首次胸部高分辨率CT结果;-:表示无数据 HsCRP:high sensitive C-reaction protein;PaO2:partial pressure of oxygen in artery;PaCO2:partial pressure of carbon dioxide in artery;ARDS:acute respiratory distress syndrome;MODS:multiple organ dysfunction syndrome;HLH:hemophagocytic lymphohistiocytosis;CBP:continuous blood purification;ECMO:extracorporeal membrane oxygenation;PIBO:post-infectious bronchiolitis obliterans;adata extracted from the first test for the children at admission,before intravenous immunoglobulin treatment;bdata extracted from high resolution chest CT results of the patients at first;-:represent no data
根据丙种球蛋白不同治疗方案将2层重症腺病毒患儿分别分组,各层的2组之间在人口学特征、实验室检查、肺部并发症及其他治疗方案比较差异均无统计学意义(均P>0.05)(表2)。对于早期应用患儿,2种不同丙种球蛋白治疗方案对高级生命支持的需求及患儿预后方面比较差异均无统计学意义(均P>0.05)。对于晚期应用患儿,应用方案1组发热时间缩短,ECMO使用率降低(P<0.05),而2组PIBO和支气管扩张的发生率比较差异均无统计学意义(均P>0.05)(表2)。
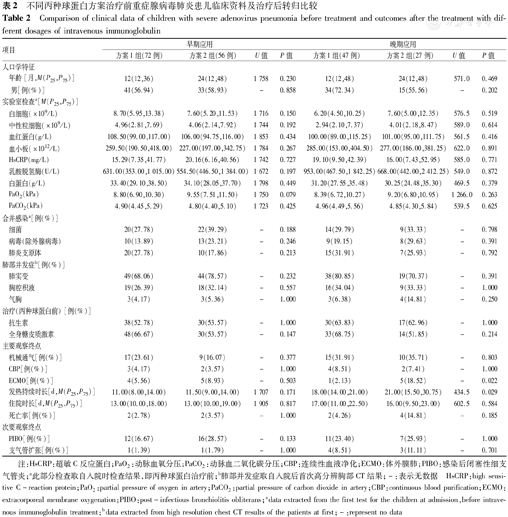
不同丙种球蛋白方案治疗前重症腺病毒肺炎患儿临床资料及治疗后转归比较
Comparison of clinical data of children with severe adenovirus pneumonia before treatment and outcomes after the treatment with different dosages of intravenous immunoglobulin
不同丙种球蛋白方案治疗前重症腺病毒肺炎患儿临床资料及治疗后转归比较
Comparison of clinical data of children with severe adenovirus pneumonia before treatment and outcomes after the treatment with different dosages of intravenous immunoglobulin
| 项目 | 早期应用 | 晚期应用 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 方案1组(72例) | 方案2组(56例) | U值 | P值 | 方案1组(47例) | 方案2组(27例) | U值 | P值 | ||
| 人口学特征 | |||||||||
| 年龄[月,M(P25,P75)] | 12(12,36) | 24(12,48) | 1 758 | 0.230 | 12(12,48) | 24(12,48) | 571.0 | 0.469 | |
| 男[例(%)] | 41(56.94) | 33(58.93) | - | 0.858 | 34(72.34) | 15(55.56) | - | 0.202 | |
| 实验室检查a[M(P25,P75)] | |||||||||
| 白细胞(×109/L) | 8.70(5.95,13.38) | 7.60(5.20,11.53) | 1 716 | 0.150 | 6.20(4.50,10.25) | 7.60(5.00,12.35) | 576.5 | 0.519 | |
| 中性粒细胞(×109/L) | 4.96(2.81,7.69) | 4.06(2.14,7.92) | 1 744 | 0.192 | 2.94(2.10,7.37) | 4.01(2.18,8.47) | 589.0 | 0.614 | |
| 血红蛋白(g/L) | 108.50(99.00,117.00) | 106.00(94.75,116.00) | 1 853 | 0.434 | 100.00(89.00,115.25) | 101.00(95.00,111.75) | 561.5 | 0.416 | |
| 血小板(×1012/L) | 259.50(190.50,418.00) | 227.00(197.00,342.75) | 1 784 | 0.267 | 285.00(153.00,404.50) | 277.00(186.00,381.25) | 622.0 | 0.891 | |
| HsCRP(mg/L) | 15.29(7.35,41.77) | 20.16(6.16,40.56) | 1 742 | 0.727 | 19.10(9.50,42.39) | 16.00(7.43,52.95) | 585.0 | 0.771 | |
| 乳酸脱氢酶(U/L) | 631.00(353.00,1 015.00) | 554.50(446.50,1 384.00) | 1 672 | 0.197 | 953.00(467.50,1 842.25) | 668.00(442.00,2 412.25) | 549.0 | 0.872 | |
| 白蛋白(g/L) | 33.40(29.10,38.50) | 34.10(28.05,37.70) | 1 798 | 0.449 | 31.20(27.55,35.48) | 30.25(24.48,35.30) | 469.5 | 0.379 | |
| PaO2(kPa) | 8.80(6.90,10.30) | 9.55(7.51,11.50) | 1 750 | 0.079 | 8.39(6.72,10.27) | 9.20(6.80,10.95) | 1 266.0 | 0.263 | |
| PaCO2(kPa) | 4.90(4.45,5.29) | 4.80(4.40,5.10) | 1 723 | 0.425 | 4.96(4.49,5.56) | 4.85(4.30,5.84) | 539.5 | 0.625 | |
| 合并感染a[例(%)] | |||||||||
| 细菌 | 20(27.78) | 22(39.29) | - | 0.188 | 14(29.79) | 9(33.33) | - | 0.798 | |
| 病毒(除外腺病毒) | 10(13.89) | 13(23.21) | - | 0.246 | 9(19.15) | 8(29.63) | - | 0.391 | |
| 肺炎支原体 | 20(27.78) | 10(17.86) | - | 0.213 | 15(31.91) | 7(25.93) | - | 0.792 | |
| 肺部并发症b[例(%)] | |||||||||
| 肺实变 | 49(68.06) | 44(78.57) | - | 0.232 | 38(80.85) | 19(70.37) | - | 0.391 | |
| 胸腔积液 | 19(26.39) | 18(32.14) | - | 0.557 | 16(34.04) | 9(33.33) | - | 1.000 | |
| 气胸 | 3(4.17) | 3(5.36) | - | 1.000 | 3(6.38) | 4(14.81) | - | 0.250 | |
| 治疗(丙种球蛋白前) [例(%)] | |||||||||
| 抗生素 | 38(52.78) | 30(53.57) | - | 1.000 | 30(63.83) | 17(62.96) | - | 1.000 | |
| 全身糖皮质激素 | 48(66.67) | 30(53.57) | - | 0.147 | 33(68.75) | 14(51.85) | - | 0.214 | |
| 主要观察终点 | |||||||||
| 机械通气[例(%)] | 17(23.61) | 9(16.07) | - | 0.377 | 15(31.91) | 10(35.71) | - | 0.803 | |
| CBP[例(%)] | 3(4.17) | 2(3.57) | - | 1.000 | 4(8.51) | 2(7.41) | - | 1.000 | |
| ECMO[例(%)] | 4(5.56) | 5(8.93) | - | 0.503 | 1(2.13) | 5(18.52) | - | 0.022 | |
| 发热持续时长[d,M(P25,P75)] | 11.00(8.00,14.00) | 11.50(9.00,14.00) | 1 707 | 0.171 | 18.00(14.00,21.00) | 21.00(15.50,30.75) | 434.5 | 0.029 | |
| 住院时长[d,M(P25,P75)] | 13.00(10.00,18.00) | 13.00(10.00,19.00) | 1 905 | 0.817 | 17.00(11.00,22.50) | 16.00(9.50,23.00) | 602.5 | 0.584 | |
| 死亡率[例(%)] | 2(2.78) | 2(3.57) | - | 1.000 | 2(4.26) | 4(14.81) | - | 0.185 | |
| 次要观察终点 | |||||||||
| PIBO[例(%)] | 12(16.67) | 16(28.57) | - | 0.133 | 11(23.40) | 7(25.93) | - | 1.000 | |
| 支气管扩张[例(%)] | 1(1.39) | 1(1.79) | - | 1.000 | 4(8.51) | 3(11.11) | - | 0.701 | |
注:HsCRP:超敏C反应蛋白;PaO2:动脉血氧分压;PaCO2:动脉血二氧化碳分压;CBP:连续性血液净化;ECMO:体外膜肺;PIBO:感染后闭塞性细支气管炎;a此部分检查取自入院时检查结果,即丙种球蛋白治疗前;b肺部并发症取自入院后首次高分辨胸部CT结果;-:表示无数据 HsCRP:high sensitive C-reaction protein;PaO2:partial pressure of oxygen in artery;PaCO2:partial pressure of carbon dioxide in artery;CBP:continuous blood purification;ECMO:extracorporeal membrane oxygenation;PIBO:post-infectious bronchiolitis obliterans;adata extracted from the first test for the children at admission,before intravenous immunoglobulin treatment;bdata extracted from high resolution chest CT results of the patients at first;-:represent no data
202例患儿共进行了589次丙种球蛋白的静脉注射,其中方案1组236次,方案2组353次。在589次输注过程中有34次(5.77%)发生了明确或可能与丙种球蛋白相关的不良事件。
输注丙种球蛋白不良事件发生率≥1%的为面色潮红(12/589次,2.04%)、发热(7/589次,1.19%)和寒战(6/589次,1.02%)。2组不良事件发生率比较差异无统计学意义(P>0.05)(表3),未发现与丙种球蛋白有关的严重不良事件。
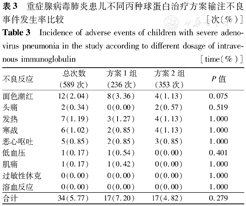
重症腺病毒肺炎患儿不同丙种球蛋白治疗方案输注不良事件发生率比较 [次(%)]
Incidence of adverse events of children with severe adenovirus pneumonia in the study according to different dosage of intravenous immunoglobulin [time(%)]
重症腺病毒肺炎患儿不同丙种球蛋白治疗方案输注不良事件发生率比较 [次(%)]
Incidence of adverse events of children with severe adenovirus pneumonia in the study according to different dosage of intravenous immunoglobulin [time(%)]
| 不良反应 | 总次数(589次) | 方案1组(236次) | 方案2组(353次) | P值 |
|---|---|---|---|---|
| 面色潮红 | 12(2.04) | 8(3.36) | 4(1.13) | 0.075 |
| 头痛 | 2(0.34) | 0(0.00) | 2(0.57) | 0.519 |
| 发热 | 7(1.19) | 3(1.27) | 4(1.13) | 1.000 |
| 寒战 | 6(1.02) | 2(0.85) | 4(1.13) | 1.000 |
| 恶心呕吐 | 5(0.85) | 2(0.85) | 3(0.85) | 1.000 |
| 低血压 | 1(0.17) | 1(0.54) | 0(0.00) | 0.401 |
| 肌痛 | 1(0.17) | 1(0.42) | 0(0.00) | 1.000 |
| 过敏性休克 | 0(0.00) | 0(0.00) | 0(0.00) | 1.000 |
| 溶血反应 | 0(0.00) | 0(0.00) | 0(0.00) | 1.000 |
| 合计 | 34(5.77) | 17(7.20) | 17(4.82) | 0.279 |
腺病毒肺炎是一种常发生于儿童的肺部感染性疾病[15,16]。多数患儿病情轻,病程呈自限性,但重症腺病毒肺炎可引起儿童相当高的发病率和死亡率[17]。目前已知HAdV-7B型与儿童重症肺炎相关[18]。到目前为止,重症腺病毒肺炎尚无有效的治疗方案,而且在儿科患者中的治疗方案临床研究较少。本研究回顾性分析202例重症腺病毒肺炎患儿接受IVIG治疗的情况,初步评价了该治疗在儿科腺病毒肺炎患者中的潜在疗效和安全性。
临床使用的IVIG具有多种病原体和毒素的抗体以及免疫调节作用(调节细胞因子和调节补体活性)[10]。丙种球蛋白抗感染主要作用是由于具有特异性抗体,可以中和病原体[19]。本研究根据丙种球蛋白应用时机的分层分析显示,晚期应用患儿的血红蛋白和白蛋白水平较低,而LDH水平较高,表明晚期应用患儿的病情更为复杂和严重。根据转归分析结果,早期给予丙种球蛋白对于减少机械通气的使用,缩短发热时间具有重要意义。后遗症方面,早期治疗可降低支气管扩张的发生率。特别需要注意的是,早期应用患儿的死亡率较晚期应用患儿明显降低。因此,对于重症腺病毒肺炎患儿,早期给予丙种球蛋白治疗非常重要。
丙种球蛋白治疗小儿重症腺病毒肺炎尚无统一方案,目前丙种球蛋白应用于感染性疾病,多分为2种方案:0.4~0.5 g/(kg·d),连用3~5 d;1 g/(kg·d)连用2 d[20]。本研究根据患儿住院期间的丙种球蛋白治疗方案分为方案1组[1 g/(kg·d),连用2 d]和方案2组[0.4~0.5 g/(kg·d),连用3~5 d]。研究表明,按方案1使用丙种球蛋白可以抑制免疫系统的部分功能,包括抑制树突状细胞的成熟和功能,降低T淋巴细胞的增殖以及促炎细胞因子的产生[19]。研究发现免疫系统的激活及大量趋化因子和细胞因子的产生可能在腺病毒组织损伤中发挥重要作用[21,22]。本研究结果显示,方案1组和方案2组对于早期应用患儿的临床转归没有影响。而对于晚期应用患儿,应用方案1可以缩短发热时长和降低ECMO使用率,表明方案1组可以在一定程度上减轻重症腺病毒患儿病程后期的病情严重程度。因此,对于晚期就诊的重症腺病毒肺炎患儿建议给予丙种球蛋白1 g/(kg·d),连用2 d输注治疗。
本研究中IVIG耐受性良好,未发现与丙种球蛋白相关的严重不良事件。本研究IVIG的不良事件发生率为5.77%。目前,多数观点认为方案1更易出现不良事件[23]。而在本研究中,观察到2组的丙种球蛋白治疗的不良事件发生率差异无统计学意义,因此认为丙种球蛋白用法与不良事件发生率无明确相关性。
综上,丙种球蛋白是目前治疗儿童重症腺病毒肺炎重要治疗手段。本研究表明,早期给予丙种球蛋白治疗儿童重症腺病毒肺炎对于改善预后非常重要。对于晚期应用患儿,丙种球蛋白1 g/(kg·d),连用2 d的治疗方案在减少ECMO的使用和缩短发热时长方面具有意义。
所有作者均声明不存在利益冲突



























