
运用氢核磁共振(1HNMR)技术对遵义地区1岁以下健康留守儿童和1岁以下锌缺乏症留守儿童尿液进行分析,以期为锌缺乏早期诊断提供新的生物标志物。
横断面研究。2018年1月至8月通过分层抽样的方法选取遵义地区1岁以下健康留守儿童40例[男22例、女18例,年龄(7.78±3.62)个月,身高(65.01±2.67) cm,体质量(7.15±1.59) kg]和锌缺乏症留守儿童40例[男19例、女21例,年龄(7.89±3.57)个月,身高(64.25±2.95) cm,体质量(7.02±1.68) kg]分为健康对照组和锌缺乏组,并进行取样处理测定1HNMR波谱,比较2组儿童年龄、身高、体质量、血清锌含量,应用代谢组学技术,结合多变量统计分析比较2组代谢产物,筛选出锌缺乏患儿差异性代谢产物。
2组儿童年龄、身高、体质量比较,差异均无统计学意义(均P>0.05)。健康对照组血清锌水平[(54.3±3.06) mmol/L]高于锌缺乏组[(39.2±3.77) mmol/L],差异有统计学意义(t=22.65,P<0.05)。尿液1HNMR光谱图结果显示:与健康对照组比较,锌缺乏组儿童尿液中4-羟基苯丙酮酸、苯基乙酰甘氨酸、马尿酸盐水平均明显下降(r=-0.620、-0.689、-0.721),差异均有统计学意义(均|r|>0.602,均P<0.05)。
遵义地区1岁以下留守儿童锌缺乏主要表现为尿液4-羟基苯丙酮酸、苯乙酰甘氨酸、马尿酸盐代谢产物水平下降,提示肠道菌群代谢紊乱,其差异性代谢产物在锌缺乏的早期诊断中具有潜在应用价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
锌是人体必要微量元素[1],其缺乏会导致食欲减退、生长发育迟缓、免疫功能下降、生殖发育迟缓、皮肤代谢障碍、智力低下等[2],严重时可影响儿童行为发育,导致行为异常,影响身心健康[3]。锌缺乏在发展中国家较常见,已影响全球20多亿人口,且发展中国家的疾病加重及儿童死亡率增加大多与锌缺乏有关[4]。贵州省遵义市地处山区,经济相对沿海地区较落后,每年有大量中青年外出务工,导致留守儿童营养水平较差、饮食结构不规范合理和锌缺乏率高等问题。因此,关注遵义地区留守儿童锌缺乏症现状,早期诊断及早期干预至关重要。目前,针对儿童锌缺乏诊断主要依靠测定血清、血浆锌含量,其局限性在于仅能表明近期的体内锌含量,受昼夜变化、取血方法和地理环境的影响,且由于机体平衡系统的整合作用,当锌水平在机体平衡过度时才会发生变化。另外,临床上对血清锌浓度降低是否属于真正的锌缺乏很难确定,且作为有创检查在儿童疾病筛查中接受率较低。近年来,代谢组学技术作为无创筛查已广泛应用于心血管疾病、儿童呼吸疾病、肾病等疾病的研究中,其中核磁共振(NMR)是临床应用中最常见的分析技术[5],能详细、系统、准确地分析疾病发生、发展过程中代谢产物变化,并区别出特异性生物标志物,对疾病及其并发症的病因研究、预防、早期诊断和药物干预评价将可能产生重大影响。基于上述研究成果和工作基础,本研究提出以下假设:锌缺乏儿童中可能存在某些特异性生物标志物,在血清中锌发生改变之前,检测尿液中特异性生物标志物可以预警锌缺乏的发生,有助于锌缺乏的早期干预。因此,本研究采用代谢组学技术对遵义地区1岁以下健康留守儿童和锌缺乏留守儿童尿液进行分析,以期寻找锌缺乏早期筛查的差异性代谢产物,为锌缺乏早期诊断提供新的线索。
横断面研究。于2018年1月至8月通过分层抽样的方法,在遵义市凤冈县、播州区、正安县等地区对<1岁留守儿童进行血液学检测及尿液采集。锌缺乏的实验室纳入标准[6]:1~5个月龄血锌<37.8 mmol/L,6~11个月龄时血锌<46.2 mmol/L,3岁血锌<56.2 mmol/L,6岁血锌<66.2 mmol/L,12岁血锌<72 mmol/L,临床诊断时可同时伴或不伴临床症状。排除标准:排除患有肾病综合征、糖尿病、烫伤、外伤手术、脱屑性皮肤病、慢性炎症、中毒及患有血液系统、肺结核及免疫缺陷病等慢性消耗性疾病的患儿。根据以上标准选取40例(男19例、女21例)锌缺乏患儿为锌缺乏组,年龄(7.89±3.57)个月,身高(64.25±2.95) cm,体质量(7.02±1.68) kg。另选健康留守儿童40例(男22例、女18例)为健康对照组,年龄(7.78±3.62)个月,身高(65.01±2.67) cm,体质量(7.15±1.59) kg。本研究符合《赫尔辛基宣言》及《中国临床试验研究法规》,并经遵义市第一人民医院医学伦理委员会批准通过[批准文号:(2017)1051号],参与研究儿童的监护人均知情同意。
8:00至12:00时,采集2组儿童尿液各2 mL,3 000 r/min离心10 min(离心半径13 cm)进行离心分离,封存后置-80 ℃冰箱中备用。
核磁管(美国norell公司);ST500-7;重水(Deuterium oxide /D2O)(美国CIL公司);离心机(Centrifuge 5415D)(德国Eppendorf公司);Agilent NMRSystem 600 MHz DD2谱仪(美国Agilent公司);液体快速混合器(YKA)(江西医疗器械厂);SIMCA-11.0软件(瑞典Umetrics公司);MestReNova软件(V7.0)(西班牙Mestrelab)。
试验前2 h将样本在室温下解冻摇匀,取1.0 mL尿液样品于离心管中,12 000 r/min离心10 min(离心半径15 cm);取上清液200 μL于1.5 mL离心管中,加入30个单位的尿素酶,振荡30 s,在37 ℃条件下反应15 min后去除尿素;加入800 μL甲醇和10 μL肉豆蔻酸,振荡1 min;13 000 r/min离心10 min(离心半径15 cm),取上清液200 μL于气相色谱瓶中,真空离心浓缩至干;加入50 μL甲氧胺,封盖,振荡1 min,30 ℃摇床(200 r/min)反应90 min进行甲氧氨对羰基的封闭反应,启盖加入50 μL三氟乙酰胺(BSTFA)和10 g/L三甲基氯硅烷(TMCS),封盖,振荡30 s;在70 ℃烘箱中反应60 min,振荡30 s,启盖,加入40 μL庚烷,封盖,振荡30 s。代谢物的检测和分析均委托重庆威斯腾生物医药科技有限责任公司完成,包括样品处理、氢谱测试及数据处理及分析。
对2组尿液行代谢组学检测。选择Agilent DD2 600 MHz核磁共振谱仪(质子的共振频率为599.83 MHz,配备超低温探头)进行氢核磁共振(1HNMR)实验。采用有预饱和压水的1D NOESY脉冲序列,分别检测各个尿液样本的小分子代谢物成分。基本参数如下:90度脉宽值:约10 s;采样点数:32 K;谱宽:20 ppm;采样时间:1.36 s;扫描次数:64;空扫次数:8;温度:298 K。获得一维核磁共振氢谱图。
采用MestReNova软件(V7.0)对氢谱图进行傅里叶变换,以1.33 ppm乳酸双峰校准为血清氢谱图,分别以9.5~0.7 ppm及0.002 ppm为积分间隔及间距,去掉6.0~5.5 ppm处的尿素峰。通过SIMCA-P+软件对标准化数据进行变量分析,应用主成分分析(PCA)并采用集中转换数据标度转换方法获得PCA评分图。采用SIMCA-P +软件对归一化后的数据进行偏最小二乘法-判别分析(PLS-DA),分析数据中(X变量)和其他变量(Y变量,分组信息)间的相关性。采用PLS-DA对数据进行转换。用交叉验证法检验PLS-DA模型的质量,并用模型可解释的变量(R2X)和模型累积预测度(Q2)评估模型的有效性,其R2X模型为可解释变量,Q2为模型的预测能力,R2X越接近于1,Q2>0.5,说明回归模型的效果越好[7]。
通过对PLS-DA模型进行正交偏最小二乘法判别分析(OPLS-DA),分析各代谢物相应的相关系数r。在r图中,每个变量的loading值(即主成分与研究项之间的因子载荷系数值)乘以其标准差的平方根,进修数据的回溯转换。代谢产物通过比较r值临界表所获得。其自由度和P=0.05时确定代谢产物r值,r值越大,其差异越大。当r为正数,锌缺乏组差异性代谢物水平高于健康对照组,r为负数则相反。
采用SPSS 20.0统计学软件对数据进行统计分析,计量资料以 ±s表示,2组间比较采用独立样本t检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
±s表示,2组间比较采用独立样本t检验。计数资料采用χ2检验。P<0.05为差异有统计学意义。
2组儿童年龄、身高、体质量比较,差异均无统计学意义(均P>0.05),具有可比性。健康对照组血清锌含量为(54.3±3.06) mmol/L,高于锌缺乏组[(39.2±3.77) mmol/L],差异有统计学意义(t=22.65,P<0.05)。
选择健康对照组与锌缺乏组尿液样本中具有代表性的代谢物1HNMR氢谱图,根据一维谱图并结合公共数据库对核磁共振信号进行归属,并利用谱峰、化学位移及信号强度进行分析,其中化学位移δ6.2-10(在虚线盒中)的区域较δ0.6~6.2相应区域放大8倍,以达到清晰显示2组不同代谢产物的目的。见图1。
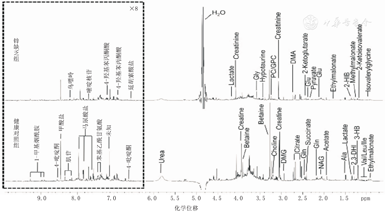

注:1HNMR:氢核磁共振;氢谱图在化学位移δ6.2-10(虚线盒中)的相应区域为健康对照组与锌缺乏组的代谢产物 1HNMR:hydrogen nuclear magnetic resonance;the corresponding area of hydrogen spectrum in chemical shift δ6.2-10 (dotted box) is the metabolites of healthy control group and zinc deficiency group
采用PCA建模方法对样本进行分析,锌缺乏组与健康对照组儿童主成分积分值集中分布于椭圆形散点图(95%置信区间)的第1象限、第2象限和第4象限,结果显示2组有分离趋势(图2)。可行下一步PLS-DA;以期进行模型验证。
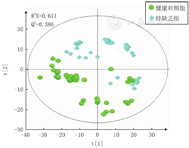

注:横坐标坐标t[1]代表各样品在X空间的得分,纵坐标t[2]代表各样品在Y空间的得分,其中[1]代表第一个主成分,[2]代表第二个主成分 The abscissa t [1] represents the score of each sample in X space,and the ordinate t [2] represents the score of each sample in Y space,where [1] represents the first principal component and [2] represents the second principal component
锌缺乏组和健康对照组儿童尿液的PCA得分图结果表明2组间具有代谢物差异。为验证模型,进一步采用监督性的多维统计方法,即PLS-DA对2组样本进行分析。其模型质量参数为:具有2个主成分,R2X=0.37,R2Y=0.994,Q2=0.976。模型参数(R2Y和Q2)表明当前PLS-DA模型解释和预测数据能力较好,且截距图显示该模型未过拟合,因此可利用该数据进行后期分析(图3)。
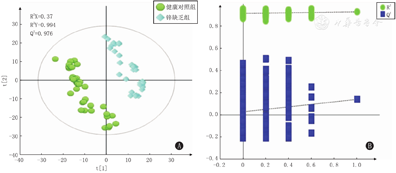

注:A图横坐标t[1]代表各样品在X空间的得分,纵坐标t[2]代表各样品在Y空间的得分,其中[1]代表第一个主成分,[2]代表第二个主成分 In figure A,the abscissa t [1] represents the score of each sample in X space,and the ordinate t [2] represents the score of each sample in Y space,where [1] represents the first principal component and [2] represents the second principal component
健康组对照组与锌缺乏组尿液代谢产物分别以第2象限、第3象限和第1象限、第4象限为主,存在显著差异。其模型质量参数为:R2X=0.37,R2Y=0.994,Q2=0.974。模型Q2较高,说明模型可靠。且OPLS-DA的相关系数负载图显示出2组间存在显著性差异的代谢物,即OPLS-DA得分图和相应的系数负载图是从其尿液一维核磁共振氢谱得到,颜色图显示代谢物变化的意义,正向峰表示其正方向上更丰富的代谢产物,负向峰则相反,可发现在其代谢产物集中在负方向上的峰值(图4)。
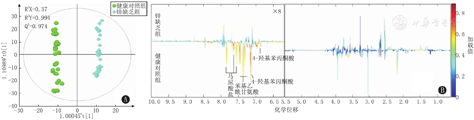

注:A图横坐标t[1]代表各样品在X空间的得分,纵坐标t0[1]代表各样品在Y空间的得分,其中[1]代表第一个主成分 In figure A,the abscissa t [1] represents the score of each sample in X space,and the ordinate t0 [1] represents the score of each sample in Y space,where [1] represents the first principal component
将2组存在显著性差异的代谢物行进一步鉴定,并将其相应的相关系数进行归纳(表1)。与健康对照组相比,锌缺乏组尿液中4-羟基苯丙酮酸(4-HPPA)、苯基乙酰甘氨酸(PAG)、马尿酸盐水平均明显下降,差异均有统计学意义(均|r|>0.602,均P<0.05)。

健康对照组和锌缺乏组差异性代谢产物鉴定比较结果
Identification and comparison of differential metabolites between healthy control group and zinc deficiency group
健康对照组和锌缺乏组差异性代谢产物鉴定比较结果
Identification and comparison of differential metabolites between healthy control group and zinc deficiency group
| 尿液中代谢物 | 化学位移 | r值 | P值 |
|---|---|---|---|
| 4-羟基苯丙酮酸 | 6.89(m), 7.20(m), 3.58(m), 1.37(d) | -0.620 | 0.036 |
| 苯乙酰甘氨酸 | 7.36(m),7.37(m),7.32(m) | -0.689 | 0.041 |
| 马尿酸盐 | 8.03(d),7.84(d),7.64(s),7.56(dd), 3.76(d), 3.68(s) | -0.721 | 0.025 |
注:r正值和负值分别代表浓度正相关和负相关;当P=0.05时,|r|=0.602;s为单峰;m为多重峰;d为双重峰;dd为两个双重峰 Positive and negative values of r correlation coefficient represent positive and negative correlation of concentration respectively;when P=0.05,|r|=0.602;s was single peak;m was multiple peak;d was double peak;dd was two double peaks
4-HPPA是一种苯丙氨酸的代谢中间产物。苯丙氨酸的侧链被苯丙氨酸羟化酶羟化成酪氨酸。酪氨酸再由酪氨酸转氨酶转化为4-羟苯丙酮酸。PAG是苯丙氨酸和4-HPPA的共同代谢产物,苯甲酸为肠道微生物将饮食中的芳香族化合物代谢形成,通过肝肾结合甘氨酸,形成马尿酸盐,研究表明马尿酸盐水平变化与肠道微生态平衡密切相关[8],且4-HPPA、PAG为芳香族氨基酸细菌分解的肠道菌群代谢物,参与调节肠道微生物群[9],尿液中4-HPPA、PAG和马尿酸盐的变化可能为肠道菌群的结构和活性变化的结果。
锌是肠道菌群细菌必备的微量元素,约20%的膳食锌摄入由肠道细菌使用后参与调节肠道功能,肠道中的组氨酸、赖氨酸、甘氨酸、胱氨酸和谷氨酸促进体内锌吸收。锌缺乏时肠道氨基酸丢失增多,导致肠道菌群代谢紊乱[10],提示锌参与调节肠道菌群平衡。Reed等[11]采用宏基因组学揭示慢性锌缺乏时,动物肠道菌群发生显著的组成和功能重塑,由于这种重塑,锌缺乏微生物群有可能进一步从宿主中隔离锌而延续缺锌状态,甚至加重机体缺锌状况。此外,有研究者发现人体锌稳态主要由肠道微生物吸收调节[12],因此,锌缺乏时存在一定程度的肠道菌群紊乱,使胃肠功能紊乱,临床多表现为腹泻、体质量降低等。Giallourou等[13]研究发现,锌缺乏小鼠中存在弯曲杆菌感染,表现为腹泻次数增多,代谢组学结果揭示锌缺乏小鼠存在4-HPPA、PAG、马尿酸盐含量降低,与本研究结果一致。且此研究采用酶联免疫吸附测定进一步表明锌缺乏小鼠中存在肠道形态改变,主要变化为结肠固有层细胞浸润增加,腔内黏液排出显著,该结果进一步证实锌缺乏时机体存在肠道菌群代谢紊乱。
综上,本研究筛选出的差异性代谢产物主要涉及肠道菌群代谢,与1岁以下正常留守儿童对比,1岁以下锌缺乏留守儿童患儿尿液中4-HPPA、PAG、马尿酸盐水平降低,提示遵义地区1岁以下锌缺乏留守儿童可能存在肠道菌群代谢紊乱。这些代谢产物的改变在一定程度反映了锌缺乏患儿体内代谢的变化,为临床早期筛查、诊断及治疗提供理论依据,也为锌缺乏的生物标志物研究提供了一定线索。
所有作者均声明不存在利益冲突



























