
支气管哮喘(哮喘)是儿童时期最常见的慢性病。临床诊疗中发现,部分哮喘患儿常合并不同程度的神经精神疾病,如孤独症谱系障碍、注意缺陷-多动障碍、恐慌症及焦虑等,这给哮喘预后及治疗带来很大困难。部分报道提示,支气管哮喘"肺-脑轴"的关联在于炎症相关机制的暴发,通过抑制炎症因子释放,阻止肺-脑间炎症的沟通可能成为改善哮喘并发神经精神疾病的新思路。NOD样受体热蛋白结构域相关蛋白3(NLRP3)作为研究较多的炎症小体家族成员之一,广泛参与在神经炎症与哮喘发作的机制中,现对NLRP3在哮喘"肺-脑轴"免疫炎症机制中的作用相关报道进行综述,为哮喘与神经精神共患病的攻克提供新的诊疗及研究思路。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(哮喘)是儿科最常见的慢性气道炎症性疾病,严重影响儿童的生长发育及生活质量,其病情预后与患儿治疗依从性紧密相关。临床发现部分患有哮喘的儿童同时伴有或者易并发神经精神疾病,这对预后较差的哮喘患儿病情更是雪上加霜。近年来,随着"肺-脑轴"概念的提出[1,2,3],给哮喘共患神经精神疾病发病机制的探究提供了新思路。发现并切断哮喘与神经精神共患病机制的共同点与交叉点,是提高哮喘预后基础研究的重点。考虑到哮喘的病理生理机制为慢性炎症[4],神经精神疾病绝大部分亦由神经炎症引起[5,6],因此,慢性炎症可能是二者共患病的基础之一。炎症小体是一种多蛋白复合物,其中以NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor pyrin domain-containing protein 3,NLRP3)研究最为成熟,可通过调节多种细胞来合成和分泌白细胞介素(IL)-1β和IL-18,在固有免疫和炎症疾病的发生发展中发挥重要作用[7]。研究表明,NLRP3在哮喘及神经精神疾病中均扮演重要角色[8,9],提示其在哮喘"肺-脑轴"免疫炎症机制中可能占有重要地位。为进一步探讨NLRP3与哮喘共患神经精神疾病的关系,进而为该共患病的诊治提供新的思路和依据,现就NLRP3在哮喘"肺-脑轴"免疫炎症中的作用进行综述。
"肺-脑轴"是指肺脑交互作用,即由肺至脑或肺脑共患的作用方式。肺脑的相互作用关系近期被重症医学界所关注,主要源于临床中发现急性脑损伤后常引起肺损伤,如呼吸机相关性肺炎(ventilator-associated pneumonia,VAP),急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)和神经源性肺水肿(neurogenic pulmonary edema,NPE)等[1]。内部机制大多认同"二次打击"学说[10]:脑损伤后引起颅内感染,由小胶质细胞和星形胶质细胞释放炎症因子,包括IL-6、肿瘤坏死因子-α(TNF-α)和IL-8等,神经炎症引起颅内血脑屏障功能改变,进而扩散至全身,引起颅外器官的损伤,此为一次打击;在此基础上外周器官非常脆弱,更易受感染、机械通气等外部因素损伤,此为二次打击。同理,由肺损伤引起脑部病变的损伤机制亦与此相似,均与炎症相关。在VAP诊疗中,若呼吸机使用不当,引起肺损伤,可能释放炎症因子,融入血液循环至全身,引起肺外器官包括脑部的损伤[3];临床中也常发现ARDS患者康复过程中伴随学习、记忆及认知等神经精神系统的改变,此亦可能与外周炎症风暴引起中枢神经炎症改变相关[11]。
哮喘的"肺-脑轴"包括由哮喘引起或伴随的神经精神疾病。经MalaCards数据库(https://www.malacards.org)搜索发现,与哮喘相关的前260位疾病中,神经精神疾病包括孤独症谱系障碍(autism spectrum disorder,ASD)、注意缺陷-多动障碍(attention deficit-hyperactivity disorder,ADHD)、恐慌症和焦虑等(图1A、图1B),说明哮喘"肺-脑轴"引起的神经精神共患病不可小觑,究其原因,可能与以下两点相关:(1)哮喘发病时炎症因子通过血脑屏障入颅,刺激小胶质细胞等神经炎症细胞释放炎症因子,进而导致神经炎症暴发,引起认知及行为改变;(2)遗传基因的改变,目前本课题组基础研究发现,母鼠孕期致敏后引起子代哮喘的同时伴有部分神经精神行为学的改变。
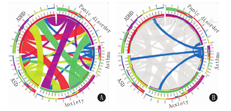

注:各条带宽度表示相关性相对强度。Asthma:哮喘;ASD:孤独症谱系障碍;ADHD:注意缺陷-多动障碍;Anxiety:焦虑;Panic disorder:恐慌症
The width of each band indicates the relative strength of the correlation.ASD:autism spectrum disorder;ADHD:attention deficit-hyperactivity disorder
哮喘的本质是气道慢性炎症,其"肺-脑轴"很大程度上也与炎症因子的产生与释放相关,炎症因子包括IL-6、IL-1β、IL-18等。NOD样受体是免疫炎症机制中的重要调节因子,广泛参与固有免疫和获得性免疫,NLRP3是NOD样受体家族成员之一,目前研究最多,作用机制研究最为深入也最复杂。大量研究证实,NLRP3广泛参与呼吸系统和神经系统疾病[8,9],因此NLRP3可能在哮喘"肺-脑轴"中发挥重要作用。
自2002年Martinon等[12]首次提出炎症小体的概念后,近20年来其被争相研究及报道。炎症小体是一类多蛋白复合体,组成结构包括胞浆分子识别受体(pattern recognition receptor,PRR)、衔接蛋白凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)和效应蛋白半胱天冬酶-1前体(pro-Caspase-1)三部分[13]。目前已报道的炎症小体包括NLRP1、NLRP3、IL-1β转换酶蛋白激活因子(interleukin-1beta-converting enzyme-protease activating factor,IPAF)和黑色素瘤缺失因子2(absent in melanoma 2,AIM2),其中NLRP3研究最多,能被多种病原体所激活[14]。NLRP3炎症小体的活化机制目前尚不清楚,报道显示与活性氧(reactive oxygen species,ROS)产生[15,16]、溶酶体受损[17,18]、K+外流[19]等相关。其活化过程分3个阶段:(1)第一信号与细胞膜上Toll样受体结合,激活核转录因子κB(NF-κB),产生大量炎症因子前体(包括pro-IL-1β和pro-IL-18);(2)第二信号与NLRP3受体结合,通过衔接蛋白ASC结合pro-Caspase-1形成炎症小体,并使无活性的pro-Caspase-1转换为具有酶活性的Caspase-1;(3)活化的Caspase-1加工pro-IL-1β和pro-IL-18生成IL-1β和IL-18,参与促炎作用,另外Caspase-1介导细胞焦亡(图2)。
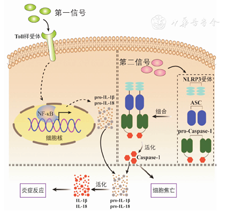

注:NF-κB:核转录因子κB;IL:白细胞介素;NLRP3:NOD样受体热蛋白结构域相关蛋白3;ASC:衔接蛋白凋亡相关斑点样蛋白
NF-κB:nuc-lear tran scription factor-κB;IL:interleukin;NLRP3:NOD-like receptor pyrin domain-containing protein 3;ASC:apoptosis-associated speck-like protein containing CARD
哮喘是由多种细胞及细胞组分参与的气道慢性炎症性疾病,其中细胞因子包括IL-1β、IL-18等,而两者又是NLRP3发挥功能的执行者,提示NLRP3可能与哮喘发作间存在一定联系,并且越来越多的证据表明,NLRP3的激活与哮喘的发病机制密切相关[20,21,22]。Simpson等[20]曾对85例中性粒细胞哮喘患者和27例健康对照者进行临床评估、肺活量测定和痰标本收集,分别检测NLRP3、Caspase-1和IL-1β的基因和蛋白表达,结果发现哮喘患者NLRP3、Caspase-1和IL-1β的基因表达显著升高,且IL-1β蛋白水平升高与痰液IL-8水平呈正相关,推测中性粒细胞哮喘中NLRP3炎症小体过表达的目的可能是通过产生IL-1β来调节该炎症过程。Zhang等[21]进一步在卵清蛋白(OVA)诱导的小鼠哮喘模型中证实哮喘发作后NLRP3、IL-1β和IL-18表达均增加,提示NLRP3可能参与OVA诱导哮喘的发作过程。为深入探究机制,目前众多研究已逐渐从干扰NLRP3的活化方面着手,探究哮喘的保护靶点。在上述研究中,Zhang等[21]进一步探索发现Eph受体酪氨酸激酶A2(EphA2)与NLRP3结合并诱导其在Tyr132处磷酸化,从而干扰ASC斑点的形成,阻断NLRP3炎症小体的激活,发挥减轻哮喘症状的作用;中药是我国的瑰宝,白术内酯作为白术的主要活性成分,是一种治疗哮喘的中草药,已广泛用于临床的抗炎治疗中[23],有研究报道,无论在哮喘的体外或体内动物模型中,白术内酯Ⅲ均可抑制哮喘引起的NLRP3活化,重塑Th1/Th2的平衡,改善炎症反应和气道压力[22]。以上通过阻断或抑制NLRP3的活化均可观察到哮喘症状的明显改善,提示NLRP3可作为哮喘治疗的重要潜在靶点。
神经炎症多是由于应激或感染后所致的神经功能障碍表现,是多种神经发育疾病的重要发病机制[24,25,26]。在神经炎症中,NLRP3炎症小体激活并聚集在小胶质细胞内,促进Caspase-1的切割和提高其活性,导致下游IL-1β的释放[27]。Saresella等[28]对25例孤独症患儿、23例健康兄弟姐妹和30例无血缘关系的健康对照儿童的NLRP3炎症小体活性、炎症小体衍生的促炎细胞因子IL-1β和IL-18浓度进行分析发现,单纯ASD组NLRP3炎症小体表达明显上调,IL-1β和IL-18分泌增加,并伴随抗炎细胞因子IL-33持续降低,故而推测针对炎症小体阻滞的策略可能对ASD的治疗有效;Li等[29]进一步研究发现,槲皮素可以通过抑制NLRP3炎性体的活化降低神经炎症,改善Morris水迷宫中小鼠表现出的空间学习和记忆障碍;Guo等[30]对一种抗多发性硬化症药物芬戈莫德的研究发现,其不仅减轻了神经元损伤和氧化应激,而且通过抑制NF-κB/NLRP3轴的活化,阻断NLRP3炎症小体的组装,提高糖水偏好、强迫游泳、旷场实验和Morris水迷宫测试的得分,改善实验鼠的抑郁样行为和认知功能。故而,NLRP3的活化程度可为中枢神经炎症疾病的活动提供指示作用。
炎症小体是先天性免疫防御的重要前哨,可响应多种刺激而被激活并广泛参与哮喘和神经炎症中[31]。那么NLRP3能否成为哮喘并发神经精神疾病的纽带?有报道证实哮喘可伴神经精神疾病[32,33,34],且NLRP3炎症小体广泛参与哮喘和神经炎症疾病中。但是哮喘如何同时引起神经炎症改变?原因可能与以下因素有关:(1)外周炎性因子通过血脑屏障导致中枢炎症发生进而影响神经精神行为改变。以小胶质细胞活化为特征的神经炎症是神经系统疾病的标志,不充分的炎症不能消除病原体的感染,而过度或高反应性的炎症会引起影响中枢神经系统(CNS)功能的慢性或全身性炎症性疾病的发生[14]。全身性炎症可通过血脑屏障功能影响大脑,并提高脑内促炎细胞因子水平,这已被证明会导致直接和间接的神经毒性效应和随之而来的神经行为改变[26]。Xia等[35]研究发现哮喘在引起外周炎症的同时还引起神经炎症,表现为小胶质细胞活化,海马和前额叶皮质TNF-α和IL-1β水平升高。(2)中枢氧化与抗氧化系统失衡。在慢性炎症性疾病(如哮喘)中,白细胞可侵入CNS,与CNS驻留的细胞一起增加耗氧量并产生过量的ROS,引起抗氧化系统的失衡,导致氧化应激,这在很大程度上加重了神经炎症[36]。(3)NF-κB信号通路活化相关的免疫紊乱。免疫功能障碍和免疫反应异常可能与哮喘并发神经炎症有关,但这种联系的早期证据是基于有孕期母亲感染史的儿童中神经行为改变发生率明显增高。母体免疫激活可诱导子代出现孤独症样行为,并与NF-κB信号的活化相关[37]。观察性研究显示,在ASD及其家人中,免疫相关疾病的患病率上升[38],在母体免疫激活过程中,与NF-κB通路相关的促炎介质从母体血液中释放,增加胎盘屏障和胎儿血脑屏障的通透性,使炎症介质进入胎儿大脑,激活小胶质细胞,释放促炎细胞因子,加剧神经炎症,引起后代神经行为改变[39],这也为哮喘并发神经精神疾病基础研究模型的建立提供了依据。以上TNF-α和IL-1β等炎症细胞因子的释放、ROS的产生及NF-κB信号的活化等均与NLRP3炎症小体激活密切相关,因此切断NLRP3的枢纽功能,可能改善哮喘"肺-脑轴"的免疫炎症。
哮喘是临床常见病,严重哮喘随时危及患儿生命,而目前的治疗方案仍远未能满足临床需求,加之部分哮喘同时并发神经精神症状表现,这给患儿拥有健康的预后带来极大挑战。肺和脑通过复杂的炎症通路发生强烈的相互作用,发现并及时切断哮喘的"肺-脑轴"将成为基础研究的一大亮点。作为目前研究最多且广泛参与哮喘和神经炎症发病机制中NLRP3的活化为从哮喘与中枢神经炎症角度分析"肺-脑轴"的形成增加了新的方向,NLRP3可能是哮喘神经精神共患病的纽带,切断它可能减轻哮喘"肺-脑轴"的免疫炎症,期望未来有更多的研究来证实,以为更好地防控哮喘合并神经精神疾患奠定基础。
所有作者均声明不存在利益冲突



























