
评价阿达木单克隆抗体(ADA)治疗儿童克罗恩病(CD)的疗效和安全性。
回顾性分析2016年9月至2021年9月在首都医科大学附属北京儿童医院诊治的20例应用ADA治疗的CD患儿的临床资料。采用儿童克罗恩病活动指数(PCDAI)和克罗恩病内镜下严重指数(CDEIS)评价CD患儿疾病活动程度及黏膜炎症程度。组间比较采用秩和检验或Fisher′s确切概率法。
共纳入20例CD患儿,其中男12例,女8例;疾病诊断年龄(9.5±4.9)岁(0.9~15.1岁);首次应用ADA年龄(10.4±4.8)岁(1.2~16.7岁);应用ADA前疾病持续时间0.9(0.4,1.7)年。20例CD患儿应用ADA治疗前PCDAI评分为(28.5±19.8)分(0~65.0分),疾病活动程度以重度活动(8/20例,40.0%)为主,疾病缓解期4例(4/20例,20.0%)。15例患儿行CDEIS评估:中重度活动9例,内镜下缓解1例。10例(10/20例,50.0%)CD患儿曾应用英夫利西单克隆抗体(IFX)治疗,IFX停药原因包括:药物失应答8例(8/10例,80.0%),过敏反应2例(2/10例,20.0%)。ADA治疗第6周,20例CD患儿的PCDAI评分中位数为5.0(0,10.0)分,较治疗前明显下降(P<0.001)。16例CD活动期患儿在ADA治疗第6周时的临床缓解率和临床应答率分别为62.5%(10/16例)、87.5%(14/16例);既往未应用IFX组和既往应用IFX组患儿第6周的临床缓解率和临床应答率比较,差异均无统计学意义(均P>0.05)。ADA治疗中位时间为5.5(2.6,17.8)个月,期间6例(6/20例,30.0%)临床复发。随访结束时17例(17/20例,85.0%)维持临床缓解;1例临床原发无应答,2例继发失应答。7例发生不良反应,以肺炎(4例)或上呼吸道感染(2例)为主,无肿瘤及其他严重不良反应。
ADA在儿童CD患者的诱导和维持临床缓解方面具有较好的疗效,且无严重不良反应。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来儿童克罗恩病(CD)的发病率逐年升高[1]。传统CD治疗,包括全肠内营养、糖皮质激素和免疫抑制剂对儿童轻中度CD的诱导和维持缓解有效,但对于中重度CD患者,尤其是具有高危因素者[内镜下深溃疡、充分诱导缓解治疗后仍持续为重度活动、病变广泛、生长迟缓(年龄别身高Z值在-2.5以下)、严重骨质疏松、起病时即存在狭窄或穿孔、严重肛周病变等],需早期采用生物制剂治疗进行诱导缓解[2]。
在儿童CD患者中,应用最为广泛的生物制剂为抗肿瘤坏死因子(TNF)-α单克隆抗体,包括英夫利西单克隆抗体(IFX)、阿达木单克隆抗体(ADA)、赛妥珠单克隆抗体。IFX和ADA先后于2018年和2021年经我国国家食品药品监督管理局正式批准应用于治疗6岁以上CD患者,可有效诱导和维持儿童CD患者缓解。IFX为人-鼠嵌合性单克隆抗体,具有免疫原性,可产生IFX抗体,从而导致疗效丧失或输液反应或延迟的超敏反应。ADA为全人源抗TNF-α单克隆抗体,作用机制与IFX相似。与IFX相比,ADA对可溶性人TNF-α有高度亲和性,免疫原性更低,降低了产生中和抗体的风险,皮下给药更方便,对IFX失应答或不耐受的患者亦具有有效性和安全性[3]。目前国内尚缺乏ADA治疗儿童CD的疗效及安全性相关数据。本研究回顾性分析应用ADA治疗CD患儿的临床资料,旨在评价ADA治疗儿童CD的疗效和安全性。
回顾性分析2016年9月至2021年9月在首都医科大学附属北京儿童医院诊治的20例应用ADA治疗的CD患儿。纳入标准:(1)符合2019年《儿童炎症性肠病诊断和治疗专家共识》[2]制定的CD诊断标准;(2)年龄0~18岁,应用ADA治疗≥3次。排除标准:(1)具有ADA使用禁忌证(严重感染、活动性结核、淋巴瘤或其他恶性肿瘤);(2)曾经使用过ADA治疗;(3)应用ADA治疗<3次。本研究通过首都医科大学附属北京儿童医院医学伦理委员会批准(批准文号:2022-E-038-R),并豁免知情同意。
收集患儿性别,起病年龄,诊断年龄,巴黎分型,儿童克罗恩病活动指数(PCDAI),克罗恩病内镜下严重指数(CDEIS),首次应用ADA年龄、ADA前用药情况、ADA用药剂量、ADA用药时长、ADA合并用药,随访时间,不良反应。
按照巴黎分型[4],CD按病变部位分型如下:回肠末段(L1)、结肠(L2)、回结肠(L3)、上消化道型(L4a上消化道至十二指肠屈氏韧带,L4b十二指肠屈氏韧带至远端1/3回肠以近);按疾病行为分型如下:非狭窄非穿透(B1)、狭窄(B2)、穿透(B3)、狭窄穿透(B2B3)和肛周病变(p)。采用PCDAI评估疾病活动严重程度,分为临床缓解(<10.0分)、轻度活动(10.0~27.5分)、中度活动(30.0~37.5分),重度活动(≥40分)。
采用CDEIS[5]来评估CD内镜下结肠黏膜炎症。CDEIS<3分为内镜下缓解,3~<9分为轻度活动,9~<12分为中度活动,≥12分为重度活动。
采用SPSS 22.0软件进行分析。计量资料经正态性检验,若满足正态性分布,采用 ±s进行描述,若不符合则采用中位数(P25,P75)描述;计数资料采用频数和率进行描述。非正态分布计量资料采用非参数秩和检验进行组间比较。计数资料比较采用Fisher′s确切概率法,P<0.05为差异有统计学意义。
±s进行描述,若不符合则采用中位数(P25,P75)描述;计数资料采用频数和率进行描述。非正态分布计量资料采用非参数秩和检验进行组间比较。计数资料比较采用Fisher′s确切概率法,P<0.05为差异有统计学意义。
共纳入CD患儿20例。其中男12例,女8例;起病年龄(9.0±5.0)岁(0.4~14.9岁),其中<6岁者5例;诊断年龄(9.5±4.9)岁(0.9~15.1岁);首次应用ADA年龄(10.4±4.8)岁(1.2~16.7岁),应用ADA前疾病持续时间0.9(0.4,1.7)年。既往应用IFX组CD患儿10例(10/20例,50.0%),IFX中位注射次数为4.5次(3.0,7.5)次。IFX停药原因包括:药物原发无应答2例(2/10例,20.0%),药物继发失应答6例(6/10例,60.0%),过敏反应2例(2/10例,20.0%),分别发生在第5次和第12次应用IFX过程中。既往未应用IFX组,即ADA作为首选抗TNF制剂者共10例(10/20例,50.0%),用药原因:选择ADA作为初始诱导缓解方案3例,免疫抑制剂不能维持缓解3例,激素抵抗3例,激素依赖1例。
20例CD患儿临床特征见表1。疾病行为以B1型(16/20例,80.0%)为主,9例(9/20例,45.0%)合并肛周病变。病变部位以L3型(12/20例,60%)为主,其中8例同时累及上消化道。疾病活动程度方面,20例CD患儿应用ADA治疗前PCDAI评分为(28.5±19.8)分(0~65.0分)。疾病活动程度以重度活动(8/20例,40.0%)为主,疾病缓解期4例(4/20例,20.0%)。15例患儿在ADA治疗前完成结肠镜检查,按照CDEIS评估内镜下结肠黏膜炎症情况:重度活动5例,中度活动4例,轻度活动5例,内镜下缓解1例。肠外表现:4例合并关节病变,1例合并银屑病。

采用阿达木单克隆抗体治疗的20例克罗恩病患儿的临床特征
Clinical characteristics of 20 patients with Crohn′s disease treated with Adalimumab
采用阿达木单克隆抗体治疗的20例克罗恩病患儿的临床特征
Clinical characteristics of 20 patients with Crohn′s disease treated with Adalimumab
| 项目 | 例(%) | |
|---|---|---|
| 疾病部位 | ||
| L2 | 5(25.0) | |
| L3 | 4(20.0) | |
| L2+L4a | 3(15.0) | |
| L3+L4a | 7(35.0) | |
| L3+L4a+b | 1(5.0) | |
| 疾病行为分型 | ||
| B1 | 16(80.0) | |
| B2 | 3(15.0) | |
| B3 | 1(5.0) | |
| p | 9(45.0) | |
| 疾病活动情况 | ||
| 缓解期 | 4(20.0) | |
| 轻度活动 | 7(35.0) | |
| 中度活动 | 1(5.0) | |
| 重度活动 | 8(40.0) | |
| 应用阿达木单克隆抗体前用药情况 | ||
| 5-氨基水杨酸 | 11(55.0) | |
| 全肠内营养 | 9(45.0) | |
| 糖皮质激素 | 15(75.0) | |
| 甲氨蝶呤 | 2(10.0) | |
| 硫唑嘌呤 | 7(35.0) | |
| 沙利度胺 | 2(10.0) | |
| 环孢素 | 2(10.0) | |
| 英夫利西单克隆抗体 | 10(50.0) | |
| 手术 | 2(10.0) | |
注:L2:结肠型;L3:回结肠型;L2+L4a:结肠+上消化道型(上消化道至十二指肠屈氏韧带);L3+L4a:回结肠+上消化道型(上消化道至十二指肠屈氏韧带);L3+L4a+b:回结肠+上消化道型(上消化道至远端1/3回肠以近);B1:非狭窄非穿透型;B2:狭窄型;B3:穿透型;p:肛周病变 L2:colon type;L3:ileocolic type;L2+L4a:colon + upper digestive tract type (upper digestive tract to duodenal flexor ligament);L3+L4a:ileocolic + upper digestive tract type (upper digestive tract to duodenal flexor ligament);L3+L4a+b:ileocolic + upper digestive tract type (from upper digestive tract to distal 1/3 ileum);B1:non narrow and non penetrating;B2:narrow type;B3:penetrating type;p:perianal disease
20例CD患儿在ADA治疗前用药情况见表1,10例(10/20例,50.0%)曾使用免疫抑制剂如硫唑嘌呤、甲氨蝶呤、环孢素或沙利度胺治疗,其中3例使用过2种免疫抑制剂治疗。共2例(2/20例,10.0%)在ADA治疗前接受手术治疗,1例因肠狭窄、不完全肠梗阻行肠切除肠吻合术,1例因肠穿孔行肠穿孔修补术+回肠造瘘术。
根据体质量分组,≥40 kg组7例,<40 kg组13例。≥40 kg组第0周、第2周ADA剂量为160/80 mg,此后每14 d皮下注射1次ADA 40 mg;<40 kg组第0周、第2周ADA剂量为80/40 mg,此后每14 d皮下注射1次ADA 20 mg。5例患儿在用药过程中进行药物浓度监测,其中4例ADA药物谷浓度在治疗窗内,未检测到抗药抗体;1例ADA联合硫唑嘌呤维持临床缓解的CD患儿,在ADA治疗8个月时,主动监测ADA药物谷浓度低,无抗药抗体产生,粪便钙卫蛋白升高,将ADA用药间隔缩短至每10 d用药1次,6个月后监测ADA药物谷浓度升至正常范围,粪便钙卫蛋白降至正常,再次将ADA用药间隔延长至每14 d用药1次。
ADA治疗的中位持续时间为5.5(2.6,17.8)个月,用药期间联合用药情况:5例(5/20例,25.0%)单用ADA治疗,3例(3/20例,15.0%)联用糖皮质激素治疗,2例(2/20例,10.0%)联用5-氨基水杨酸制剂治疗,13例(13/20例,65.0%)联用免疫抑制剂如硫唑嘌呤(6例)、甲氨蝶呤(5例)、环孢素(1例)或沙利度胺(3例)治疗,其中2例先后或同时使用2种免疫抑制剂治疗。
20例CD患儿在ADA治疗第6周PCDAI评分中位数为5.0(0,10.0)分,较治疗前明显下降,差异有统计学意义(Z=-3.703,P<0.001)。4例缓解期患儿在ADA治疗第6周时仍处于临床缓解期。16例活动期CD患儿ADA治疗第6周的临床缓解率和临床应答率分别为62.5%(10/16例)、87.5%(14/16例)。既往未应用IFX组和既往应用IFX组患儿第6周的临床缓解率和临床应答率比较,差异均无统计学意义(均P>0.05)(表2)。4例临床应答的CD患儿中,2例ADA治疗第10周获得临床缓解,1例治疗12周获得临床缓解,1例治疗2周后仍有疾病活动,加用糖皮质激素、沙利度胺治疗,治疗12周获得临床缓解。2例临床原发无应答CD患儿中,1例ADA治疗6周(4次)后改用IFX治疗;1例ADA治疗8周(5次)加用沙利度胺,治疗第12周获得临床缓解。
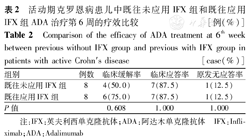
活动期克罗恩病患儿中既往未应用IFX组和既往应用IFX组ADA治疗第6周的疗效比较 [例(%)]
Comparison of the efficacy of ADA treatment at 6th week between previous without IFX group and previous with IFX group in patients with active Crohn′s disease [case(%)]
活动期克罗恩病患儿中既往未应用IFX组和既往应用IFX组ADA治疗第6周的疗效比较 [例(%)]
Comparison of the efficacy of ADA treatment at 6th week between previous without IFX group and previous with IFX group in patients with active Crohn′s disease [case(%)]
| 组别 | 例数 | 临床缓解率 | 临床应答率 | 原发无应答率 |
|---|---|---|---|---|
| 既往未应用IFX组 | 8 | 4(50.0) | 7(87.5) | 1(12.5) |
| 既往应用IFX组 | 8 | 6(75.0) | 7(87.5) | 1(12.5) |
| P值 | 0.608 | 1.000 | 1.000 |
注:IFX:英夫利西单克隆抗体;ADA:阿达木单克隆抗体 IFX:Infli-ximab;ADA:Adalimumab
截至2021年10月,共6例(6/20例,30.0%)出现临床复发,其中3例在自行停用ADA 1.5~6.0个月后出现临床复发,再次应用ADA治疗时,2例联合糖皮质激素,1例联合全肠内营养治疗,均再次获得临床缓解;3例在ADA用药2~5个月出现继发失应答,其中2例停用ADA,改IFX治疗,1例联合全肠内营养治疗,再次获得临床缓解。ADA治疗期间无患儿接受手术治疗。
随访结束时评估疾病活动程度:17例(17/20例,85.0%)维持临床缓解;1例临床原发无应答,2例继发失应答,停用ADA治疗,改IFX治疗。
注射局部皮肤红肿1例,肺炎4例,上呼吸道感染2例。其中2例因肺炎自行停用ADA 1.5~6.0个月后出现临床复发,2例因肺炎或上呼吸道感染延缓ADA用药时间。无恶性肿瘤及其他严重不良反应。
儿童CD患者逐年增加,常合并营养不良、生长迟缓、肛周病变、皮肤、关节等肠外表现,本病病情进展快,手术率高,治疗难度大。研究发现,在起病前2年内采用抗TNF-α单克隆抗体治疗能显著降低CD肠狭窄、手术、肛周病变及其他并发症的发生率,因此早期生物制剂治疗可帮助改善预后[8]。
国外研究报道,ADA治疗儿童CD第4周的临床应答率为50%~87%,临床缓解率为24%~61%;第12周分别为65%~91%、30%~88%[9]。意大利的多中心研究显示,使用ADA治疗IFX失应答的CD患者,第6、12、18个月的临床缓解率分别为55%、78%和52%,提示ADA可作为IFX治疗继发失应答中重度活动性CD患者的二线生物制剂[3]。本研究中CD患儿在ADA治疗第6周的临床缓解率和临床应答率分别为62.5%、87.5%,既往未应用IFX组和既往应用IFX组第6周的临床缓解率和临床应答率比较,差异均无统计学意义(均P>0.0.5)。这也证实了ADA在儿童CD患者诱导临床缓解方面具有较好的疗效,包括对于IFX治疗失应答或出现过敏反应转换为ADA治疗的CD患者。不同研究ADA的临床缓解率及临床应答率存在一定差异,分析原因考虑可能与ADA用药时机、用药前是否应用IFX、是否联合免疫抑制剂以及是否主动药物浓度监测等有关。本研究的短期临床缓解率和临床应答率偏高,可能与本组CD患儿用药时机相较其他研究更早有关,本研究CD患儿应用ADA前疾病持续时间为0.9(0.4,1.7)年,而IMAgINE1研究中的中重度活动CD患者应用ADA治疗前的病程约为3年[6]。另外本研究中既往未应用IFX组CD患者占比50.0%,较其他研究偏高(0~55.9%)[9]。
本研究ADA治疗中位持续时间为5.5个月,随访过程中3例出现继发失应答,其中2例停用ADA,改IFX治疗,1例联合全肠内营养治疗,再次获得临床缓解。对于抗TNF-α单抗治疗的活动性CD患儿,共识建议根据药物浓度监测指导治疗,而不是经验性增加剂量或转换药物[10,11]。根据药物浓度监测结果,如ADA药物谷浓度在治疗窗内,建议转换其他作用机制的药物;如药物谷浓度低于治疗窗浓度,且未检测到抗药抗体或抗药抗体滴度较低,可通过增加ADA剂量或缩短注射ADA间隔时间或联用免疫抑制剂等方式优化治疗方案,使患儿重新获得应答;如药物谷浓度不足,且抗药抗体滴度较高,建议转换其他作用机制的治疗药物。
ADA治疗CD维持临床缓解方面,研究显示6个月临床缓解率为28%~55%,12个月临床缓解率为23%~97%[9]。本研究随访结束时临床维持缓解率(17/20例,85.0%)较高,除与ADA用药时机较早有关,也可能与既往未应用IFX组患儿比例较高、随访时间较短、ADA联合免疫抑制剂比例(13/20例,65.0%)较高有关。
成人的研究已经证实,抗TNF-α单抗联合免疫抑制剂治疗可减少抗抗体产生,提高生物制剂血药浓度,从而提高疗效[12]。但在儿童CD患者中,目前尚缺乏足够的证据确定单药或联合治疗的风险/效益比。Hyams等[13]关于ADA联合或单药治疗中重度儿童CD患者的随机对照临床研究结果显示,与单药治疗相比,联合治疗组26周、52周临床应答率和临床缓解率差异无统计学意义。英国的一项回顾性研究显示,ADA联合免疫抑制剂组缓解率较单用ADA组更高[14]。抗TNF-α单抗与硫唑嘌呤治疗可能会增加血液系统肿瘤(包括淋巴瘤)的风险[15]。因此在临床实践中,需权衡联合用药的利弊,根据具体情况及患者意愿谨慎使用。
ADA治疗安全性方面,IMAgINE 2临床研究报道的ADA常见不良反应有头痛(27.0%)、上呼吸道感染(22.0%)、鼻咽炎(21.0%)、腹泻(19.0%)和机会感染(5.7%,主要为口腔和食管真菌感染),无死亡、活动性结核或恶性肿瘤发生[16]。本研究共7例发生不良反应,包括注射局部皮肤红肿1例,肺炎或上呼吸道感染6例,无恶性肿瘤及其他严重不良反应。
综上,ADA在儿童CD患者的诱导和维持临床缓解方面具有较好的疗效及安全性,包括对于IFX治疗失应答或出现过敏反应转换为ADA治疗的CD患者。由于本研究为单中心研究,存在一定的局限性,样本量较小,随访时间较短,有待更多的随机、双盲、多中心大样本研究来确定ADA治疗的长期疗效和安全性。
所有作者均声明不存在利益冲突



























