
建立支气管哮喘(哮喘)患儿肺功能长期变化的发展轨迹,确定哮喘患儿出现长期肺功能损伤的危险因素。
采用回顾性队列研究,纳入2019年1月至12月在首都儿科研究所附属儿童医院定期随诊,并完成肺功能检测的14岁以上哮喘患儿,收集其肺功能资料及临床信息。采用潜变量增长模型(LCGM)拟合哮喘患儿肺功能发展轨迹,建立不同的轨迹组,组间比较采用t检验、方差分析或χ2检验,确定肺功能长期变化危险因素采用多分类Logistic回归分析。
共纳入哮喘患儿173例,年龄6~17岁,获得肺功能测定1 160例次。拟合4条1秒率(FEV1/FVC)潜分类轨迹:持续高水平组、高于平均水平组、低于平均水平组、持续低水平组,其病例数分别为27例(15.6%)、66例(38.1%)、66例(38.1%)、14例(8.1%)。不同轨迹组患儿的FEV1/FVC在每一年龄组间的差异均有统计学意义(均P<0.05)。持续高水平组各年龄段的FEV1/FVC均在90%以上,其余各轨迹组FEV1/FVC随年龄变化整体呈下降趋势,低于平均水平组的FEV1/FVC在青春期后下降至80%以下;持续低水平组的FEV1/FVC均值在学龄期后即下降至80%以下,至青春期接近70%。最大用力呼气中段流量(MMEF)的轨迹和波动情况与FEV1/FVC相似。危险因素分析显示,与持续高水平组相比,典型哮喘患儿肺功能轨迹处于低于平均水平组的风险是咳嗽变异性哮喘患儿的11.940倍(P=0.008);多重致敏患儿的肺功能轨迹处于低于平均水平组的风险是单一致敏的7.462倍(P=0.015);未规律用药患儿肺功能处于持续低水平组的风险是规律用药者的6.337倍(P=0.035);男童肺功能轨迹处于低于平均水平组的风险是女童的6.186倍(P=0.002)。
6~17岁哮喘患儿的长期肺功能变化可确定4条不同轨迹:持续高水平、高于平均水平、低于平均水平、持续低水平;近半数患儿的长期肺功能轨迹处于低水平,较多患儿在青春期,少数患儿在学龄期出现持续性气流受限;典型哮喘、多重致敏、未规律用药、男性是哮喘患儿长期肺功能降低的危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管哮喘(简称哮喘)是儿童时期最常见的慢性气道疾病,其发作形式和严重程度随时间变化有所不同,并伴可变的呼气气流受限[1,2]。哮喘发作时气流受限呈可逆性,但随着病情进展、时间推移及儿童成长,部分患儿会出现持续性气流受限,即肺功能出现不可逆损伤,小气道功能降低尤为明显[3,4,5,6]。对哮喘患儿进行长时间随访可纵向观察其肺功能变化情况,识别未来发生持续性气流受限患儿的临床特征和危险因素,早期进行干预,从而阻止肺功能不可逆损伤的发生,改善预后。但目前国内尚缺乏有关哮喘患儿长期肺功能变化轨迹的研究报道[7,8]。因此,本研究采用回顾性队列研究方法,对哮喘患儿长期肺功能的改变进行分析,建立不同轨迹组,描绘患儿肺功能长期变化规律,探讨肺功能发展轨迹的影响因素,为儿童哮喘管理和评估预后提供参考依据。
选择2019年1月至12月在首都儿科研究所附属儿童医院哮喘门诊随诊,并进行肺功能检查的哮喘患儿。纳入标准:(1)明确诊断哮喘或咳嗽变异性哮喘(cough variant asthma,CVA);(2)进行肺功能检测时年龄6~17岁;(3)入组年龄≥14岁,并在首都儿科研究所附属儿童医院随诊3年以上。排除标准:(1)伴其他慢性肺病;(2)伴其他系统严重疾病;(3)长期使用全身糖皮质激素;(4)排除不配合问卷调查,不能采集到完整资料。本研究通过首都儿科研究所医学伦理委员会批准(批准文号:SHERLL2018019),征得患儿监护人同意,并签署书面知情同意书。
包括患儿所有肺功能检查数据及报告,从初次进行肺功能(流量-容积曲线)测定至最后1次,以每1岁为1个年龄段,选择采用每个年龄段肺功能测定的最佳结果。如当次进行了支气管舒张试验,则收集支气管舒张试验后的结果。纳入的肺功能参数包括:第1秒用力呼气容积(FEV1)、用力肺活量(FVC)、1秒率(FEV1/FVC)、用力呼气峰流量(PEF)、用力呼出50%肺活量的呼气流量(FEF50)、用力呼出75%肺活量的呼气流量(FEF75)、最大用力呼气中段流量(MMEF)等,其中FEV1/FVC采用实测值,余参数均采用实测值占预计值百分比(%pred)。流量-容积曲线测定采用德国Jaeger肺功能仪进行,使用机器内置的Zapletal预计值公式作为正常预计值参照。
包括患儿哮喘病史及诊治情况(发病年龄、好发季节、诊断哮喘类型、发病至规范治疗的时间、重症发作次数、是否规律使用药物、近2年病情趋势等)、个人过敏史(过敏性鼻炎、湿疹/特应性皮炎、荨麻疹、食物过敏等)、烟草暴露情况、宠物接触史、家族过敏史(支气管哮喘、过敏性鼻炎、食物过敏、皮肤过敏等)、过敏原检测结果等。
采用潜变量增长模型(LCGM)拟合哮喘儿童的肺功能生长轨迹,依据每次轨迹模型及每组轨迹的P值、贝叶斯信息准则(BIC)、赤池信息准则(AIC)确定最优模型。选择模型的原则如下:(1)尽可能保持模型的简约性;(2)极大似然估计法构建的模型及每个轨迹组的P值均小于0.05;(3)BIC及AIC的绝对值越小,模型的拟合效果越好。采用GraphPad Prism 8进行肺功能各参数轨迹平滑曲线图的描绘。
采用SPSS 22.0统计学软件进行数据分析,符合正态分布的计量资料采用 ±s表示,计数资料采用频数和百分比(%)表示。计量资料2组间比较采用t检验,多组间比较采用方差分析;计数资料比较采用χ2检验,P<0.05为差异有统计学意义。肺功能轨迹影响因素分析采用χ2检验进行单因素分析,选择有统计学意义的危险因素作为自变量,若自变量为多分类变量则将其转换为虚拟变量。以不同的肺功能轨迹组作为因变量,进行多分类 Logistic回归分析。若平行性检验结果 P≥0.05,则使用有序多分类Logistic回归分析;否则,以持续高水平轨迹组作为对照组,进行无序多分类Logistic回归分析。
±s表示,计数资料采用频数和百分比(%)表示。计量资料2组间比较采用t检验,多组间比较采用方差分析;计数资料比较采用χ2检验,P<0.05为差异有统计学意义。肺功能轨迹影响因素分析采用χ2检验进行单因素分析,选择有统计学意义的危险因素作为自变量,若自变量为多分类变量则将其转换为虚拟变量。以不同的肺功能轨迹组作为因变量,进行多分类 Logistic回归分析。若平行性检验结果 P≥0.05,则使用有序多分类Logistic回归分析;否则,以持续高水平轨迹组作为对照组,进行无序多分类Logistic回归分析。
共纳入哮喘患儿173例,其中男128例(74.0%),女45例(26.0%),获得1 160例次流量-容积曲线测定结果。不同年龄组不同性别患儿可获得肺功能测定的例次差异较大(表1)。其中典型哮喘153例(88.4%),CVA 20例(11.6%)。<6岁发病73例(42.2%),从发病至规范治疗的时间≤1年155例(89.6%),按医嘱长期规律用药126例(72.8%),伴过敏性鼻炎165例(95.4%),变应原检测阳性126例(72.8%)。
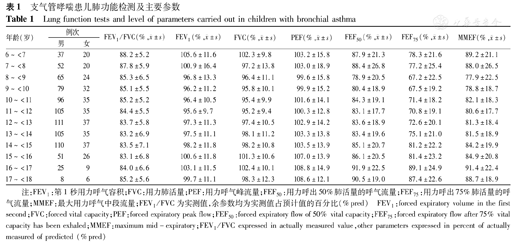
支气管哮喘患儿肺功能检测及主要参数
Lung function tests and level of parameters carried out in children with bronchial asthma
支气管哮喘患儿肺功能检测及主要参数
Lung function tests and level of parameters carried out in children with bronchial asthma
| 年龄(岁) | 例次 | FEV1/FVC(%, ±s) ±s) | FEV1(%, ±s) ±s) | FVC(%, ±s) ±s) | PEF(%, ±s) ±s) | FEF50(%, ±s) ±s) | FEF75(%, ±s) ±s) | MMEF(%, ±s) ±s) | |
|---|---|---|---|---|---|---|---|---|---|
| 男 | 女 | ||||||||
| 6~<7 | 37 | 20 | 88.2±5.2 | 105.6±11.6 | 102.3±9.8 | 103.2±15.8 | 87.9±21.3 | 78.3±21.6 | 89.2±21.1 |
| 7~<8 | 52 | 20 | 87.8±5.9 | 100.9±16.4 | 97.2±13.8 | 103.0±18.9 | 88.4±26.8 | 77.2±25.4 | 88.0±26.5 |
| 8~<9 | 65 | 24 | 85.3±6.5 | 96.8±13.3 | 96.4±11.1 | 99.6±15.8 | 78.9±20.5 | 67.2±22.5 | 77.9±22.5 |
| 9~<10 | 79 | 32 | 85.1±5.5 | 96.2±11.2 | 95.8±10.1 | 99.9±15.2 | 80.4±18.9 | 67.5±19.2 | 78.8±18.7 |
| 10~<11 | 96 | 35 | 85.2±5.2 | 96.4±10.5 | 95.4±9.9 | 101.6±14.1 | 84.3±19.1 | 71.4±18.2 | 82.1±18.3 |
| 11~<12 | 105 | 35 | 84.4±5.5 | 95.6±9.7 | 95.2±9.4 | 100.3±12.8 | 83.1±17.7 | 70.8±19.1 | 80.6±17.7 |
| 12~<13 | 111 | 37 | 83.7±5.8 | 97.3±11.3 | 97.4±10.5 | 102.9±14.2 | 83.6±18.9 | 72.6±20.1 | 81.3±18.4 |
| 13~<14 | 105 | 35 | 83.2±6.9 | 97.5±11.1 | 98.1±11.2 | 103.3±13.8 | 83.4±19.6 | 75.1±21.0 | 81.5±18.9 |
| 14~<15 | 110 | 37 | 83.5±7.1 | 98.2±11.8 | 98.2±10.8 | 103.5±13.9 | 85.1±20.7 | 81.2±22.2 | 84.2±19.9 |
| 15~<16 | 51 | 26 | 83.1±6.8 | 100.6±11.8 | 101.3±10.6 | 107.0±13.9 | 86.1±20.5 | 81.4±23.2 | 84.9±20.8 |
| 16~<17 | 25 | 9 | 84.0±6.6 | 103.1±11.5 | 102.4±10.1 | 108.8±14.9 | 91.9±22.5 | 89.1±24.9 | 91.4±22.4 |
| 17~<18 | 8 | 6 | 85.2±5.6 | 99.7±11.1 | 98.3±12.3 | 108.6±12.1 | 90.5±19.0 | 87.4±22.6 | 88.7±18.9 |
注:FEV1:第1秒用力呼气容积;FVC:用力肺活量;PEF:用力呼气峰流量;FEF50:用力呼出50%肺活量的呼气流量;FEF75:用力呼出75%肺活量的呼气流量;MMEF:最大用力呼气中段流量;FEV1/FVC为实测值,余参数均为实测值占预计值的百分比(%pred) FEV1:forced expiratory volume in the first second;FVC:forced vital capacity;PEF:forced expiratory peak flow;FEF50:forced expiratory flow of 50% vital capacity;FEF75:forced expiratory flow after 75% vital capacity has been exhaled;MMEF:maximum mid-expiratory;FEV1/FVC expressed in actually measured value,other parameters expressed in percent of actually measured of predicted (%pred)
患儿主要肺通气功能参数FEV1/FVC、FEV1%pred、FVC%pred、PEF%pred的均值分别波动于83.1%~88.2%、95.6%~105.6%、95.2%~102.4%、99.6%~108.8%;小气道功能参数FEF50%pred、FEF75%pred、MMEF%pred的均值分别波动于78.9%~91.9%、67.2%~89.1%、77.9%~91.4%(表1)。
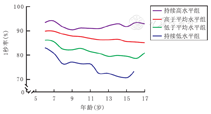
采用LCGM最终拟合了4条FEV1/FVC潜分类轨迹:持续高水平组、高于平均水平组、低于平均水平组、持续低水平组,其例数分别为27例(15.6%)、66例(38.1%)、66例(38.1%)、14例(8.1%)。
持续高水平组:91.1%~94.0%;高于平均水平组:85.3%~90.1%;低于平均水平组:78.5%~86.1%;持续低水平组:70.6%~83.2%(图1)。不同轨迹组患儿的FEV1/FVC在同一年龄组间的差异均有统计学意义(均 P<0.05)。持续高水平组各年龄段的FEV1/FVC均在90%以上。除持续高水平组外,其余各轨迹组的FEV1/FVC随年龄变化整体呈下降趋势。低于平均水平组的FEV1/FVC在青春期前处于正常水平,进入青春期后则下降至80%以下。持续低水平组的FEV1/FVC在学龄前期高于80%,但低于85%,亦低于其他轨迹的同年龄儿童,学龄期后则下降至80%以下,至青春期接近70%。

FEV1、PEF、FVC的各条轨迹在各年龄组均处于正常水平(≥80%pred),不同轨迹组间的差异在绝大多数年龄组(FEV1:8岁组、10~16岁组;PEF:7~8岁组、10~16岁组;FVC:10~15岁组)均有统计学意义(均 P<0.05)。FEV1:持续高水平组:98.1%~113.2%;高于平均水平组:95.0%~104.3%;低于平均水平组:95.4%~104.7%;持续低水平组:87.3%~103.7%。除持续低水平组外,其余3组FEV1%pred均在90%以上(图2)。
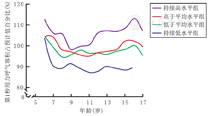

PEF不同轨迹组随年龄变化均值波动于84.5%~117.1%,总体情况与FEV1轨迹图类似。FVC不同轨迹组随年龄变化的均值波动于91.7%~105.9%,不同轨迹组间及不同年龄组间波动范围相对较小,整体上较平稳。
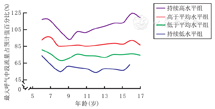
不同轨迹组的分布和随年龄变化趋势除持续低水平组(55.0%~74.3%)外,其余3个轨迹组各年龄段的MMEF均处于正常水平(≥65%预计值),依次为持续高水平组(96.3%~124.4%);高于平均水平组(84.9%~96.1%);低于平均水平组(68.4%~81.1%)。持续高水平组的MMEF在所有年龄段均最高,在9岁时最低,随后呈上升趋势,与其他轨迹组比较差异有统计学意义(P<0.05)。不同轨迹组MMEF随年龄变化的趋势与FEV1/FVC相似(图3)。

单因素分析不同肺功能轨迹组间存在显著差异的变量包括:性别、哮喘类型、发病至规范治疗时间、重症发作次数、是否规律用药、过敏原检测阳性数量。发病年龄、病情趋势、近1年哮喘发作、伴发过敏性鼻炎、伴发湿疹、食物过敏、家族过敏史、烟草暴露、饲养宠物、过敏原检测阳性等在不同组间的差异无统计学意义(P>0.05)(表2)。
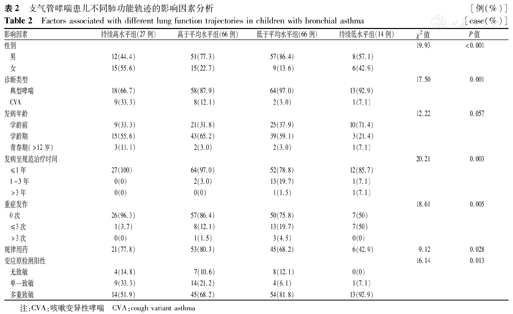
支气管哮喘患儿不同肺功能轨迹的影响因素分析 [例(%)]
Factors associated with different lung function trajectories in children with bronchial asthma [case(%)]
支气管哮喘患儿不同肺功能轨迹的影响因素分析 [例(%)]
Factors associated with different lung function trajectories in children with bronchial asthma [case(%)]
| 影响因素 | 持续高水平组(27例) | 高于平均水平组(66例) | 低于平均水平组(66例) | 持续低水平组(14例) | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|
| 性别 | 19.93 | <0.001 | |||||
| 男 | 12(44.4) | 51(77.3) | 57(86.4) | 8(57.1) | |||
| 女 | 15(55.6) | 15(22.7) | 9(13.6) | 6(42.9) | |||
| 诊断类型 | 17.50 | 0.001 | |||||
| 典型哮喘 | 18(66.7) | 58(87.9) | 64(97.0) | 13(92.9) | |||
| CVA | 9(33.3) | 8(12.1) | 2(3.0) | 1(7.1) | |||
| 发病年龄 | 12.22 | 0.057 | |||||
| 学龄前 | 9(33.3) | 21(31.8) | 25(37.9) | 10(71.4) | |||
| 学龄期 | 15(55.6) | 43(65.2) | 39(59.1) | 3(21.4) | |||
| 青春期(>12岁) | 3(11.1) | 2(3.0) | 2(3.0) | 1(7.1) | |||
| 发病至规范治疗时间 | 20.21 | 0.003 | |||||
| ≤1年 | 27(100) | 64(97.0) | 52(78.8) | 12(85.7) | |||
| 1~3年 | 0(0) | 2(3.0) | 13(19.7) | 1(7.1) | |||
| >3年 | 0(0) | 0(0) | 1(1.5) | 1(7.1) | |||
| 重症发作 | 18.61 | 0.005 | |||||
| 0次 | 26(96.3) | 57(86.4) | 50(75.8) | 7(50) | |||
| ≤3次 | 1(3.7) | 8(12.1) | 13(19.7) | 7(50) | |||
| >3次 | 0(0) | 1(1.5) | 3(4.5) | 0(0) | |||
| 规律用药 | 21(77.8) | 53(80.3) | 45(68.2) | 6(42.9) | 9.12 | 0.028 | |
| 变应原检测阳性 | 16.14 | 0.013 | |||||
| 无致敏 | 4(14.8) | 7(10.6) | 8(12.1) | 0(0) | |||
| 单一致敏 | 9(33.3) | 14(21.2) | 4(6.1) | 1(7.1) | |||
| 多重致敏 | 14(51.9) | 45(68.2) | 54(81.8) | 13(92.9) | |||
注:CVA:咳嗽变异性哮喘 CVA:cough variant asthma
对单因素分析中有统计学意义的6个变量行Logistic回归分析,结果显示,与持续高水平组相比,未规律用药患儿肺功能处于持续低水平组的风险是规律用药患儿的6.337倍,差异有统计学意义(P=0.035)。男童肺功能轨迹处于低于平均水平组的风险是女童的6.186倍,处于高于平均水平组的风险是女童的4.005倍,差异均有统计学意义(P=0.002、0.007)。典型哮喘患儿肺功能轨迹处于低于平均水平组的风险是CVA患儿的11.940倍,差异有统计学意义(P=0.008)。多重致敏患儿肺功能轨迹处于低于平均水平组的风险是单一致敏的7.462倍(P=0.015)(表3)。
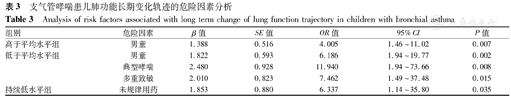
支气管哮喘患儿肺功能长期变化轨迹的危险因素分析
Analysis of risk factors associated with long term change of lung function trajectory in children with bronchial asthma
支气管哮喘患儿肺功能长期变化轨迹的危险因素分析
Analysis of risk factors associated with long term change of lung function trajectory in children with bronchial asthma
| 组别 | 危险因素 | β值 | SE值 | OR值 | 95%CI | P值 |
|---|---|---|---|---|---|---|
| 高于平均水平组 | 男童 | 1.388 | 0.516 | 4.005 | 1.46~11.02 | 0.007 |
| 低于平均水平组 | 男童 | 1.822 | 0.593 | 6.186 | 1.94~19.77 | 0.002 |
| 典型哮喘 | 2.480 | 0.928 | 11.940 | 1.94~73.66 | 0.008 | |
| 多重致敏 | 2.010 | 0.823 | 7.462 | 1.49~37.48 | 0.015 | |
| 持续低水平组 | 未规律用药 | 1.853 | 0.880 | 6.337 | 1.14~35.80 | 0.035 |
哮喘患儿肺功能改变的特征为阻塞性通气功能障碍,并呈可逆性[1,2,9,10]。临床实践中常可见少数患儿在学龄早期,甚至学龄前期,即出现持续性气流受限,或小气道功能降低,甚至表现出一定程度的非可逆性气流受限[5,6,11,12]。目前,对儿童哮喘急性发作期肺功能的变化已有明确认识,而对长期哮喘患儿肺功能变化的轨迹报道较少,尤其是国内。因此有必要了解长期哮喘患儿肺功能变化的趋势和转归,以提高对儿童哮喘的管理水平和预后评估能力。
LCGM是一种对不同发展趋势的潜分类进行描述和拟合的统计方法[13,14],能最大限度获取在纵向随访过程中指标的连续动态变化谱,在变量间的因果推论方面明显优于横断面或单次的数据,近年来越来越多地被用于临床研究。国外一项回顾性研究对3个出生队列的FEV1数据进行了分析,纳入对象分别为1 184例5~16岁儿童、14 451例8~24岁儿童和青少年、253例6~18岁儿童[15]。曼彻斯特哮喘和过敏研究(Manchester Asthma and Allergy Study,MAAS)和埃文亲子纵向研究(Avon Longitudinal Study of Parents and Children,ALSPAC)确定了4条肺功能轨迹:持续高水平、正常水平、低于平均水平、持续低水平,珀斯婴儿哮喘随访研究(The Perth Infant Asthma Follow-up,PIAF)则确定了3条轨迹:持续高水平、正常水平以及低于平均水平。MAAS和ALSPAC研究中肺功能处于持续低水平儿童的比例分别为3%和7%。塔斯马尼亚的一项前瞻性队列研究结果显示,持续低水平者的比例为6%[16]。图森研究中根据559例11~32岁受试者的FEV1将其分为2个组:肺功能正常轨迹组和低轨迹组,56例受试者被归为低轨迹组,占9.3%[17]。本研究根据6~17岁哮喘患儿FEV1/FVC的变化确定了4条肺功能轨迹,其中持续低水平组患儿14例(8.1%),与上述研究结果基本一致。FEV1/FVC、FEV1在持续低水平组与持续高水平组间相差达20%,与图森研究[17]结果一致。本研究中小气道功能参数MMEF在持续低水平组与持续高水平组间相差达50%,其轨迹和波动情况与FEV1/FVC相似,4个轨迹组在各年龄段均存在明显差异。不同轨迹组的FEV1均处于正常水平,与PIAF的数据一致,也与在儿科临床实践中观察到的情况一致。此外,FVC、PEF整体处于正常水平。在10岁以前,FEV1/FVC各轨迹组间相差较小,在10岁后其差距明显增加,提示即使哮喘症状缓解,但与持续高水平相比,部分哮喘患儿的肺功能仍有一定程度降低,并持续存在。
本研究结果显示,女童为肺功能的保护因素,但这一点在持续低水平组并未发现,可能与此组样本量较小有关。英国一项出生队列研究结果显示,男童FEV1和FVC均高于女童,但FEV1/FVC低于女童[18];此研究还显示FEF25-75改变的趋势与FEV1/FVC间存在强相关性,本研究结果与之相似。
与CVA患儿相比,典型哮喘患儿肺功能处于低于平均水平组的风险增高。有研究报道,与未出现过喘息的儿童比较,哮喘患儿肺功能降低,尤其是持续喘息和重度喘息患儿的长期肺功能降低更明显,并出现持续性气流受限[15,19,20,21,22]。塔斯马尼亚队列研究显示,肺功能轨迹呈持续低水平与喘息发生早和反复发作相关[16]。墨尔本哮喘队列研究结果发现,哮喘组和重度哮喘组患儿的FEV1和FEV1/FVC从入组至随访结束均显著低于对照组和喘息性支气管炎组患儿[21]。这表明,哮喘儿童长期肺功能变化的轨迹与病情严重度相关。
本研究结果显示,长期按医嘱规律用药是肺功能的保护因素,与O′Byrne等[23]的研究结果一致。亦有研究报道,吸入激素类药物不能使肺功能完全恢复,也不能改变哮喘的自然进程[24,25,26]。本研究结果未能显示变应原检查阳性以及存在过敏性鼻炎、湿疹、特应性皮炎、荨麻疹、食物过敏等是长期肺功能降低的危险因素,但在变应原检测呈阳性的患儿中,多重致敏儿童肺功能降低的风险是单一致敏的7.462倍。MAAS队列研究提示,在肺功能持续低轨迹的儿童中,早期过敏者的比例明显高于其他肺功能轨迹的比例[17]。另有前瞻性队列研究显示,哮喘合并特应性皮炎和/或过敏性鼻炎患儿从出生至16岁的肺功能轨迹明显低于对照组[27]。哮喘、特应性皮炎、过敏性鼻炎三者之间可能存在协同作用,共患此3种疾病儿童的肺功能处于持续低轨迹的风险增加了4.9倍[17]。
本研究虽未发现吸烟与肺功能之间存在相关性,但有研究证实吸烟是导致肺功能下降的危险因素之一[28]。新西兰的一项出生队列研究对儿童随访至26岁,结果显示儿童时期吸烟与持续哮喘和肺功能下降相关[29]。塔斯马尼亚队列研究结果显示,患儿FEV1降低与母亲吸烟相关,尤其是重度吸烟[16]。另有研究发现,父母吸烟且自己吸烟的儿童长期肺功能下降更明显[30]。这表明,无论是青少年主动吸烟还是因父母吸烟而暴露于烟草环境中,均会对肺功能造成损伤。
本研究为回顾性分析,反映了6~17岁哮喘患儿的肺功能变化趋势,并非所有患儿达到17岁,部分患儿缺少早期肺功能检测资料,结果可能存在一定偏倚,需前瞻性研究进一步证实。
所有作者均声明不存在利益冲突



























