
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的慢性肺部疾病。在儿童期,BPD患儿更容易出现反复下呼吸道感染、喘息、心血管疾病、体格发育迟缓和神经发育迟缓等问题,给患儿、家庭及社会带来沉重负担。为进一步规范BPD患儿在婴儿期、儿童期以及青春期的管理,中华医学会儿科学分会呼吸学组与中华医学会儿科学分会新生儿学组联合,参考欧洲呼吸学会,澳大利亚、新西兰以及美国胸科学会发布的BPD患儿在新生儿期后的管理建议和国内外相关文献,并结合临床实践经验,制定了《支气管肺发育不良的儿童期管理专家共识》。本共识主要内容包括BPD的定义、病理生理学、近远期预后、儿童期BPD的识别、鉴别诊断、常见感染、治疗、监测评估及多学科随访管理等方面。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
早产是全球重大的妇幼健康问题。据统计,2014年全球约有1 500万新生儿早产[1],我国每年的早产新生儿也有约86万~106万例[2]。支气管肺发育不良(bronchopulmonary dysplasia,BPD)是早产儿常见的慢性肺部疾病。国内一项研究显示[3], BPD在胎龄25周或以下早产儿中的发生率为74.2%,胎龄26~27周发生率为51.9%,胎龄28~29周发生率为33.4%,胎龄30~31周发生率为19.3%。在儿童期,BPD患儿更容易出现慢性呼吸系统疾病、心血管系统疾病、体格和神经系统发育等问题[4],反复住院率高[5]。与BPD相关的问题给社会带来沉重的负担,构成了巨大公共卫生挑战。近年来,欧洲呼吸学会,澳大利亚、新西兰以及美国胸科学会纷纷发布了BPD患儿在新生儿期后的管理建议,旨在帮助临床医师对患有BPD的婴儿、儿童以及青少年进行长期管理[6,7,8]。然而,到目前为止,中国还没有BPD儿童期管理相关专家共识或建议。因此,中华医学会儿科学分会呼吸学组、中华医学会儿科学分会新生儿学组组织专家撰写了本共识,旨在指导BPD患儿的儿童期管理,改善其预后。
共识制定专家组由来自新生儿、儿科呼吸、影像学专业20位多位学科专家组成。在本共识的制定过程中,首先由秘书组通过文献回顾初步提出临床问题,经由共识专家组成员对相关临床问题进行筛选、增补后,最终确定出10类临床问题。共识的使用人群为儿科临床医师和护理人员,目标人群为已从新生儿重症监护病房(NICU)出院或校正胎龄(postmenstrual age,PMA)>36周的BPD患儿。
目前国内通行的BPD诊断依据2001年美国国立儿童健康和人类发展研究所(National Institute of Child Health and Human Development,NICHD)发布的诊断标准[9,10],即早产后需氧支持[吸入氧浓度(FiO2)>21%]累计超过28 d。并根据胎儿在PMA 36周(出生胎龄<32周者)或出生后56 d(出生胎龄≥32周者)时对氧的依赖程度进行分度:不需要吸氧为轻度BPD;需吸氧,FiO2<30%为中度BPD;FiO2≥30%和/或需持续正压通气或机械通气则为重度BPD(severe BPD,sBPD)。2018年,NICHD提出新的BPD诊断标准,即胎龄<32周的早产儿经影像学证实存在持续肺实质病变,在PMA 36周时需要氧疗支持(连续3 d以上)以维持动脉血氧饱和度(saturation of arterial blood oxygen,SaO2)在90%~95%。该诊断标准进一步细化了用氧方式与BPD的分级,并将在日龄>14 d、PMA<36周之间因呼吸衰竭死亡的早产儿归类于sBPD。近年来,2018年的BPD分级标准开始受到越来越多的认同,相应分级见表1[11]。
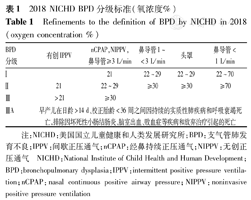
2018 NICHD BPD分级标准(氧浓度%)
Refinements to the definition of BPD by NICHD in 2018(oxygen concentration %)
2018 NICHD BPD分级标准(氧浓度%)
Refinements to the definition of BPD by NICHD in 2018(oxygen concentration %)
| BPD分级 | 有创IPPV | nCPAP,NIPPV,鼻导管≥3 L/min | 鼻导管1~<3 L/min | 头罩 | 鼻导管<1 L/min |
|---|---|---|---|---|---|
| Ⅰ | 21 | 22~29 | 22~29 | 22~70 | |
| Ⅱ | 21 | 22~29 | ≥30 | ≥30 | ≥70 |
| Ⅲ | >21 | ≥30 | |||
| ⅢA | 早产儿在日龄>14 d、校正胎龄<36周之间因持续的实质性肺疾病和呼吸衰竭死亡,排除因坏死性小肠结肠炎、脑室出血、败血症等疾病和放弃治疗引起的死亡 | ||||
注:NICHD:美国国立儿童健康和人类发展研究所;BPD:支气管肺发育不良;IPPV:间歇正压通气;nCPAP:经鼻持续正压通气;NIPPV:无创正压通气 NICHD:National Institute of Child Health and Human Development;BPD:bronchopulmonary dysplasia;IPPV:intermittent positive pressure ventilation;nCPAP:nasal continuous positive airway pressure;NIPPV:noninvasive positive pressure ventilation
BPD的实质是早产儿肺发育受限和损伤而导致的慢性肺疾病,其病理生理改变与孕周相关。孕周29周之前的早产儿,其肺部发育处于从假腺管期到小管期。围生期相关的各种刺激,如宫内生长受限、炎症暴露、给氧、机械通气等均可能导致肺血管和肺泡发育的停滞。病理表现为远端肺腺泡发育简单化,可形成大的囊状肺泡结构,通气、换气功能降低。肺泡及周围血管微环境发育终止,导致后者的发育重塑,最终形成BPD。这一病理生理过程带来的直接后果是呼吸功能不能满足机体生长发育的需要,临床表现为氧依赖和缺氧后的多系统并发症。肺结构的重塑也成为成年后慢性肺疾病发生的重要结构基础[12]。
BPD的预后与其分级相关,分级越高,并发症越多,病死率也越高,预后越差。呼吸系统、神经系统最易受累,心血管系统的受累往往与肺高压(pulmonary hypertension,PH)相关[13,14,15]。
最常见的近期并发症为呼吸功能不全、慢性氧依赖、PH等。远期预后包括罹患呼吸道感染、反复喘息风险增加、气道畸形和阻塞性睡眠呼吸障碍、成年期慢性阻塞性肺疾病(COPD)。
发达国家胎龄<29周的超早产儿PH发病率为38%[16]。诊断PH后2年内发生PH的BPD病死率为47%[14]。对于幸存下来的合并PH的BPD患儿,远期预后尚不明确。有文献报道sBPD患儿中气管软化的发病率接近50%[17]。
可出现认知障碍、语言障碍、听力异常、运动障碍及学习障碍、社交能力差等神经系统异常。
文献报道BPD患儿出现上述神经系统异常的发生率明显高于非BPD患儿。BPD是早产儿学习成绩不佳的独立危险因素,约占44%[15]。队列研究提示,BPD对学习的影响可能延续到青春期。有BPD既往史的儿童去特殊学校、复读、需要语言训练的比例均明显高于对照组。
主要是远期对血压和血管张力的影响。中重度BPD成年后外周血管阻力增加可能导致舒张压升高,左、右心室功能降低。
心功能长期随访提示近50%患有中重度BPD的婴儿右心室功能低于正常,左心室心肌功能异常也与BPD的严重程度相关[18]。
反复咳嗽和喘息发作、运动耐力下降等哮喘样症状是BPD在儿童期的主要表现,但BPD患儿对支气管舒张剂和吸入性糖皮质激素治疗反应欠佳。BPD在婴儿期及儿童期的其他表现包括反复发生缺氧发作、需要住院治疗的下呼吸道感染、气管支气管软化、气管和支气管狭窄及肉芽肿形成、复发性肺不张、大叶性肺气肿、PH等。对于反复喘息发作儿童(尤其是对支气管舒张剂和吸入性糖皮质激素治疗反应欠佳者)以及具有上述其他临床表现之一的儿童,建议常规详细询问其是否为早产儿、具体出生胎龄、出生后是否需要氧疗和/或辅助呼吸支持(包括有创机械通气、无创呼吸支持)及持续时间、目前的呼吸道症状是否起始于婴儿早期等。如果为早产儿(尤其是胎龄<28周),出生后需要氧疗和/或辅助呼吸支持至少至出生后28 d或校正胎龄36周,而且目前的呼吸道症状起病于婴儿早期,提示BPD诊断,加之肺部影像学显示肺条索实质带和多发小囊性改变,肺气肿或灌注不均匀等,可诊断BPD。另外,潮气呼吸肺功能发现中重度阻塞性通气功能障碍应警惕BPD。
BPD和哮喘患儿均存在不同程度的气道炎症、可逆性气流受限等,临床也均有喘息症状。但哮喘患儿的喘息发作性、气流受限的可逆性更为明显,并可有明显的嗜酸性粒细胞增高[19],IgE和呼出气一氧化氮(FeNO)增高。BPD患儿支气管舒张剂治疗后喘息症状多不能完全缓解,学龄期BPD患儿FeNO水平降低。
哮喘患儿早期气道无明显结构异常,气道重塑往往发生在长期哮喘控制不佳的患儿,与BPD以气道结构损伤为主存在很大差异,故两者气流受限的可逆性不同。同时,BPD患儿有明显早产、长时间氧疗的病史,影像学可出现明显的肺实质病变。
FeNO是气道Ⅱ型炎症的生物标志物[20]。哮喘患儿气道中富集嗜酸性粒细胞,故FeNO水平增高。而在BPD患儿中,新生儿期FeNO水平高于健康婴儿,与BPD的严重程度呈线性相关[21],随着年龄增长,学龄期BPD患儿FeNO水平反而低于未患BPD的早产儿童和健康儿童。可能是因为BPD早期病理改变以炎症病变为主,FeNO增高,随年龄增长炎症减轻,同时由于BPD患儿气道结构受损明显,气道上皮细胞内的一氧化氮合酶(nitric oxide synthase,NOS)减少或缺陷[22],引起NO产生减少。
儿童BPD与感染后BO均可表现为反复发作喘息、咳嗽、运动耐力下降、呼吸困难等哮喘样症状;体格检查均可发现呼吸增快、三凹征、肺部听诊可闻及湿啰音和呼气相哮鸣音等体征;肺通气功能检查均以阻塞性或混合性通气功能障碍为主要表现。但两者胸部CT检查有所不同,BPD多为肺条索实质带和多发小囊性改变;感染后BO主要表现为马赛克征、支气管壁增厚、空气潴留征等改变。BPD与BO主要鉴别点在于发病时机和关联事件不同,典型病例的影像学有一定的提示作用。BPD发生于早产儿,出生后需要氧疗和/或辅助呼吸支持至少至出生后28 d或校正胎龄36周,后续出现反复咳嗽、喘息、呼吸困难等症状,对支气管舒张剂治疗反应不如哮喘患儿明显。儿童BO通常起病于病情较严重的急性下呼吸道感染,尤其是腺病毒和肺炎支原体感染,咳嗽、喘息、呼吸急促、呼吸困难等症状持续3周以上无明显改善,后续相关症状持续存在或迁延反复,对支气管舒张剂治疗反应差。BO患儿起病前无提示BPD的相关临床表现,也无提示BPD的相关病史。
BPD患儿在生后2年内易发生反复呼吸道感染,常见的病原为呼吸道合胞病毒(respiratory syncytial virus,RSV)、流感病毒、副流感病毒、鼻病毒、肺炎链球菌[23,24]。
RSV是导致婴幼儿下呼吸道感染的主要原因之一,BPD是RSV重症感染的危险因素[25]。一项系统综述显示[26],BPD患儿RSV感染住院风险为16.8%,非BPD患儿为9.1%(P<0.001);BPD患儿RSV感染的平均住院率为186.4/1 000人年,非BPD患儿的平均住院率为13.3/1 000人年(P<0.001)。相较于非BPD患儿,BPD患儿因RSV感染而入住重症监护病房(ICU)的比例更高(17.2%比6.8%,P<0.001)。BPD与RSV感染相关急性下呼吸道感染住院存在显著关联,BPD增加了RSV患儿住院时间延长的风险,增加了对医疗支持的需求。
鉴于BPD患儿或极早产儿感染RSV后易发展为重症,建议在BPD患儿中进行RSV感染的预防。目前国内外无获得许可的疫苗用于预防RSV感染,因此非药物干预是常用的预防措施,可通过戴口罩、洗手、保持安全社交距离等方式切断传播途径[27]。国外推荐2岁以下伴或不伴BPD的极早产儿在RSV季节应用帕利珠单抗,以预防严重的RSV疾病,具体用法为在RSV流行季节每月注射1次,每次15 mg/kg,连用5次[28],然而此药目前尚未在国内上市。也有新型方便应用的预防药物正在研究中,如长效单克隆抗体尼塞韦单抗单次注射可在整个RSV流行季为早产儿提供保护,有效降低RSV感染相关下呼吸道感染和住院[29]。目前尼塞韦单抗已被美国食品与药品监督管理局(FDA)授予了快速通道资格及突破性药物资格。
肺炎链球菌感染常见于婴幼儿,肺炎链球菌常与其他病毒(如RSV、流感病毒、副流感病毒等)混合感染引起肺炎。BPD患儿再住院的病原研究显示[30],RSV是最主要的病原,继发肺炎链球菌常会使肺炎加重。因此BPD患儿要预防肺炎链球菌的感染。对于6周龄~15月龄婴幼儿,推荐接种肺炎链球菌结合疫苗(pneumococcal conjugate vaccine,PCV),包括PCV-10和PCV-13,目前推荐PCV-13[31]。2岁以上推荐接种23价肺炎链球菌多糖疫苗(pneumococcal polysaccharide vaccine-23, PPV-23)。
推荐对存在慢性低氧血症的BPD患儿进行氧疗,在实际允许的条件下,建议进行家庭氧疗。家庭氧疗方案[32,33]:推荐采用钢瓶或家用制氧机,经空氧混合仪混合后输送氧气,使用双侧鼻导管吸氧,通过空氧混合仪调节FiO2维持在22%~95%,最大流量为2 L/min。对于家庭氧疗仍不能改善慢性低氧血症的中重度BPD,可考虑进行家庭机械通气(home mechanical ventilation,HMV)[34]。
关于BPD患儿的氧饱和度界值,2019年美国胸科学会儿童家庭氧疗指南对儿童低氧血症的定义如下[33]:监测时长内有5%脉搏血氧饱和度(pulse oxygen saturation,SpO2)≤90%(1岁以下)或93%(1岁以上),或间断测量有3次SpO2≤90%(1岁以下)或93%(1岁以上)(在海平面水平)。2020年欧洲呼吸学会建议[6],将SaO2低于90%作为需要家庭氧疗的依据。我国早产儿BPD临床管理共识指出[10],对于出院接受家庭氧疗的BPD患儿,氧饱和度应维持在92%以上。
少数BPD婴儿对氧疗的需求可能需要几个月甚至几年,因此,在未咨询专科医师意见前,不得随意停止氧疗[35]。对于BPD患儿,氧疗可稳定呼吸模式、减少中枢性和周期性呼吸暂停;短期氧疗可降低平均肺动脉压力;夜间氧疗可改善睡眠并减少觉醒;改善营养状态、促进体格生长,增强身体活动水平。家庭氧疗可有助于降低住院时间延长的风险,降低医疗成本,促进患儿更快融入家庭生活[7,33]。
家庭无创或有创(气管切开)机械通气是sBPD患儿回家之路的重要选择[34],当下家用呼吸机型可提供多种通气模式,如持续呼吸道正压通气(continuous positive airway pressure,CPAP)、温湿化高流量鼻导管吸氧(heated humidified high-flow nasal cannula,HHHFNC)、双水平正压通气(bilevel positive airway pressure,BIPAP)等,但有文献报道这几种模式之间的选择对BPD的预后没有显著差别[36]。然而,临床医师需要明确的是,在sBPD人群中无创通气的主要目标是为生长和发育提供足够的支持,而不是避免有创性的机械通气。因为无创通气下仍存在生长不良、无法耐受体力活动或反复缺氧,可能导致疾病逐渐恶化[37]。
目前对于吸入支气管舒张剂(inhaled bronchodilator,IB)治疗儿童BPD尚无一致意见,建议根据临床需要酌情使用。
对于sBPD、有哮喘样症状和/或因呼吸系统疾病反复入院、运动不耐受或支气管舒张试验阳性的BPD患儿,可予以IB试验治疗。在试验治疗期间,应注意密切监测临床症状或肺功能的改善情况以及住院或急诊就诊次数的减少情况。
推荐药物及剂量:特布他林或沙丁胺醇每次2.5~5.0 mg雾化吸入,每6~8 h使用1次,一般用于有支气管痉挛表现的急性期患儿[38]。
早期研究表明[39,40],支气管舒张剂治疗可减少早产儿在生命前2年的反复咳嗽、喘息,有35%(6/17例)的BPD婴儿对沙丁胺醇有反应。对于5岁以上有早产史的儿童,沙丁胺醇可有效改善第1秒用力呼气容积(FEV1)[41]。然而,2016年Cochrane数据库发表系统综述显示,目前没有证据表明支气管舒张剂能预防BPD或缩短BPD机械通气时间、降低病死率或再入院率[42]。
目前对于糖皮质激素治疗儿童BPD尚无一致意见,建议根据临床需要酌情使用。
对于sBPD、慢性咳嗽/反复喘息、反复住院的BPD患儿,如果病情未能通过使用支气管舒张剂得到控制,可试用糖皮质激素治疗。但在试验治疗期间,应密切监测吸入/全身性糖皮质激素治疗的效果,如临床症状及严重程度、肺功能的改善情况、住院或急诊就诊的次数,再决定是否长期应用。
对于PMA超过36周需要有创机械通气的sBPD患儿、PMA超过40周需要呼吸支持的sBPD患儿,全身性糖皮质激素的推荐用法用量为[43,44,45,46,47,48,49]:(1)氢化可的松:1.25 mg/(kg·d),静脉注射或口服,根据患儿情况逐渐停药;或5 mg/(kg·d),分3次给药,用5 d,总用量与地塞米松0.89 mg/kg相当。(2)地塞米松:0.075 mg/(kg·次),每日2次,静脉注射或口服3 d,减量至0.05 mg/(kg·次),用3 d,再减量至0.025 mg/(kg·次),用2 d,继续减量至0.01 mg/(kg·次),用2 d,疗程10 d,总剂量为0.89 mg/kg,根据患儿情况逐渐停药。(3)泼尼松龙:14 d疗程推荐:2 mg/(kg·d),每日分2次,用5 d,减量至1 mg/(kg·次),每日1次,用3 d,再减量至1 mg/(kg·次),隔日1次,用3 d;28 d以上疗程推荐:2 mg/(kg·d),用7 d,减量至1 mg/(kg·d),每日1次,用7 d,减量至0.5 mg/(kg·d),每日1次,用7 d,最后减量至0.5 mg/(kg·次),1周3次,直至停药。或1~2 mg/(kg·d),每5~7 d减量0.5 mg/kg,最后减量至0.5 mg/(kg·d),用5~7 d停药。
目前吸入性糖皮质激素布地奈德防治BPD的剂量和疗程不明确,目前已有的文献无法得出一致性意见,有研究的用法用量为[50]:每次0.5mg,每日2次。
早期的前瞻性研究发现[51],吸入性糖皮质激素可改善早产儿在婴儿期的喘息和咳嗽症状。2022年,JAMA Pediatr发表的一项随机临床试验证实,吸入性糖皮质激素联合长效β2受体激动剂治疗对儿童的早产相关肺部疾病是有益的[52]。然而,在另一项随机对照试验(RCT)中[53],30例患有慢性肺疾病的婴儿随机接受丙酸氟替卡松(250 μg,每日2次,经定量吸入器+储雾罐/面罩吸入)或安慰剂治疗1年。2组在症状的发生率、氧疗时间、体重、支气管舒张剂使用时间以及入院次数和住院时间方面均未发现显著差异。虽不良反应报道很少,但对于吸入或全身性糖皮质激素在BPD患儿中的应用迫切需要进一步研究。
对于NICU出院后的BPD患儿的利尿剂应用,目前尚不能给出推荐意见,建议根据临床需要酌情使用。
对于sBPD,依赖高流量氧气、正压通气和有潜在危险的心脏问题的婴儿,或短时间内输注大量液体(如输血)或明确由于肺水肿导致呼吸功能恶化的BPD患儿,可考虑予以利尿剂治疗。在应用过程中,应注意监测电解质、高钙尿症、肾钙化及耳毒性等不良反应的发生。
常用利尿剂包括呋塞米、氢氯噻嗪和螺内酯。对于NICU出院后需使用利尿剂的BPD患儿,一般选择氢氯噻嗪和螺内酯合用,两者的剂量均为1~2 mg/(kg·d),分2次口服[10]。关于利尿剂治疗的持续时间,目前尚无循证依据。
BPD早产儿肺内存在液体平衡异常,耐受性差,易导致肺间质和肺泡水肿。一些小样本研究显示[54,55,56],利尿剂具有改善肺顺应性、降低氧需求、改善气道阻力等短期效应,对于总用氧时间、再入院次数和BPD病死率并无影响。利尿剂在BPD患儿中的作用及预后有待进一步研究。
使用大环内酯类药物防治BPD的研究多集中在BPD形成的早期,现有证据表明在有脲原体定植且需要机械通气的高危早产儿中使用阿奇霉素,可以改善BPD的预后。但对BPD患儿长期使用大环内酯类药物是否能够改善其预后,目前缺乏相关高质量文献支持。
脲原体定植是早产儿发生BPD的独立危险因素[57,58,59,60],大环内酯类抗生素具有清除脲原体和抗炎作用。早期有学者应用红霉素防治BPD,但发现红霉素不能有效清除脲原体,且无论是否存在脲原体定植,均不能降低BPD的发生率及严重程度[61,62,63]。
2011年,美国RCT研究发现,早期使用阿奇霉素并不能减少机械通气早产儿BPD的发生和死亡,但可降低脲原体定植患儿的BPD发生率[58]。2020年,巴西一篇RCT研究发现,早期使用阿奇霉素可以降低血清白细胞介素(IL)-2和IL-8水平,减少机械通气早产儿BPD或死亡的发生[59]。但同年美国一项RCT研究发现阿奇霉素可以有效清除脲原体,但不能减少BPD的发生[60]。近期一篇Meta分析显示,在有脲原体定植的早产儿中使用阿奇霉素可以减少BPD或死亡,且可以减少用氧时间[63]。
克拉霉素防治BPD的研究较少,2011年土耳其一项RCT研究发现克拉霉素治疗可以降低脲原体定植早产儿BPD发生率[64]。而2014年的一篇Meta分析就3种大环内酯类药物防治BPD疗效分析显示,仅阿奇霉素可以降低BPD发生率[65]。
大环内酯类用于治疗新生儿期后BPD的安全性和有效性有待进一步开展多中心的大样本研究。
推荐对BPD患儿定期评估体格和神经系统发育情况。体格发育评估包括头围、身长、体重。评估频率推荐:至校正年龄1岁,建议每月随访1次;校正年龄1~2岁,建议每2~3个月随访1次;校正年龄2~3岁,建议每3个月随访1次;校正年龄>3岁,建议每半年随访1次。神经系统发育评估包括运动、智力、语言、视觉、听力。评估频率推荐:至校正年龄1岁,建议3个月1次;1~2岁,半年1次;>2岁,每年1次。针对评估异常的患儿,应至专科就诊,指导对应功能的康复锻炼,改善预后。
针对BPD患儿体格发育的评估,可以参考的标准如下:(1)校正胎龄37~64周,可参考INTERGROWTH-21st标准[66](https://intergrowth21.tghn.org/);(2)校正胎龄40周以后,参照2016世界卫生组织(WHO)儿童生长标准(https://www.who.int/childgrowth/standards/en/);(3)2015年中国九市儿童体格发育调查标准[67]。针对出院后的营养支持[68],推荐BPD患儿足量强化母乳或早产儿配方奶粉(如无母乳)喂养至校正胎龄40周;后续根据生长曲线、生化指标监测指导母乳强化、配方奶粉或持续时间的调整;对喂养困难的BPD患儿,采用少量多次喂养的方式,同时给予SpO2监测、避免出现喂养疲劳和缺氧发作;对于无法建立经口喂养的患儿,需由接受培训的照护人员经管饲或胃造瘘进行喂养,并在喂养时给予SpO2监测,避免反流、误吸和缺氧发作。
针对BPD患儿的神经系统发育评估,可以参考的评估量表为:0~6岁婴幼儿的神经发育筛查,可采用丹佛发育筛查测验(Denver development screen test,DDST);筛查异常者,可进一步采用贝利婴儿发育量表(Bayley scales of infant development,BSID)或韦氏学龄前及幼儿智力量表修订本(Wechsler preschool and primary scale of intelligence-revised,WPPSI-R)进行诊断。前者适用于<3.5岁儿童,后者适用于4.0~6.5岁儿童。
推荐对BPD患儿进行定期的肺功能监测。监测的时间间隔,目前尚不能给出推荐意见,建议根据临床需要进行,但至少应每年评估1次。
有研究证实,BPD患儿的肺功能异常在整个儿童期和青春期持续存在,甚至会持续到成年期[69,70]。BPD患儿异常的肺功能发育轨迹,表现为肺功能在儿童期和青春期增长速度降低、肺功能平台峰值(即18~25岁峰值)降低以及成年期肺功能较正常成人下降更快,且随时间推移而逐渐恶化[69,70,71]。在儿童早期(4~8岁)和儿童中期(9~12岁)会出现明显的弹性阻力、电抗面积上升和气体交换功能[肺一氧化碳弥散量(DLCO)]下降[69]。在整个儿童期,肺功能下降幅度较大的BPD患儿出现了更多的呼吸道症状[69]。这种早期发育障碍、成年后持续加速下降的肺功能轨迹可能导致BPD患儿提早出现COPD或在成年期的COPD表现更重。
BPD患儿肺功能检查可出现明显的阻塞性通气功能障碍[6]、弥散功能异常以及残气量增加[72],部分伴限制性通气功能异常。支气管舒张试验可以帮助判断BPD患儿气流受限的可逆性,若支气管舒张试验FEV1改善幅度越大,说明气道可逆性越好,对支气管舒张剂疗效越好。而支气管舒张试验是否可以作为使用支气管舒张剂进行间断治疗或长期治疗的依据,有待进一步探讨。
在潮气呼吸肺功能检查中(3岁以下),患儿的阻塞性改变表现为达峰时间比(TPTEF/TE)、达峰容积比(VPEF/VE)的下降。限制性改变表现为每公斤潮气量(VT/kg)的减少。在脉冲振荡肺功能检查中(3~5岁),阻力增加表现为呼吸总阻抗(Z5)、气道总阻力(R5)、周边气道阻力(R5-R20)增高,少数患儿同时出现R20增高。部分病例出现呼吸系统顺应性下降[周边弹性阻力(X5)增加]。在肺通气功能检查(>4~5岁)中,阻塞性改变表现为FEV1/最大肺活量(VCmax)、FEV1/用力肺活量(FVC)、FEV1、用力呼出50%肺活量时的瞬间流量(FEF50)、用力呼出75%肺活量时的瞬间流量(FEF75)、最大呼气中期流量(MMEF)等下降;部分病例同时会出现限制性改变:VCmax、FVC、FEV1下降;FEV1/VCmax、FEV1/FVC可能增高(主要取决于限制程度)。儿童的自我修复能力很强,随着年龄增长及肺康复锻炼,部分患儿的肺功能可恢复至正常。
由于肺泡上皮细胞胞质增厚,故可影响气体的弥散,导致弥散功能下降,表现为一氧化碳转移因子(TLCO,又称DLCO)和经肺泡容量校正的弥散量(KCO)下降。患儿呼气末肺容积(EELV)、吸气末肺容积(EILV)明显增加,会导致肺气肿[73]、残气量增加,故体积描记肺功能显示残气容积(RV)、残总比(RV/TLC%)、气道阻力(Raw)增加,肺总量(TLC)可能增加。
由于BPD患儿除气道结构破坏以外,还伴随气道炎症,故支气管舒张剂使用后,会有不同程度的气道可逆性的改变。但由于BPD存在气道结构改变,所以支气管舒张试验阳性率(FEV1改善≥12%)[74]及FEV1改善幅度均低于单纯支气管哮喘的患儿。
推荐对BPD患儿进行肺部影像学监测。监测的时间间隔,目前尚不能给出推荐意见,建议根据临床需要进行,但需注意胸部CT辐射剂量问题,避免不必要的CT检查。
肺部结构损伤是早产儿BPD最重要的后遗症,可以持续至整个儿童期,甚至成年期,主要影像学改变为肺条索状实质带或多发囊性透亮影,也可见到空气潴留和肺气肿[75],如果合并PH,可合并肺血管增粗扭曲、肺部灌注不均匀等PH征象。在生命早期,BPD患儿显示肺部影像学异常的概率很高。一项研究显示[76],在中位月龄6.2个月(5.9~6.9个月)时,95.5%的患儿肺部CT显示肺部结构异常。在学龄期,BPD患儿的肺部影像学异常依然明显。一项在年龄8.7~16.7岁时的研究发现,81%的患儿至少存在上述1项肺部高分辨CT异常[73]。另有研究在儿童中期(9~11岁)评估肺部影像学发现,相比于未患BPD的儿童,BPD患儿的肺部结构异常更多[77]。肺部影像学异常与BPD严重程度、肺功能异常、呼吸道症状的增加及肺炎再入院几率的增加相关[75]。肺部影像学监测不仅可以了解BPD造成的早期肺部结构异常的后续发展情况,而且可以预测后期肺功能受损和出现呼吸系统症状的程度。
推荐对中重度BPD患儿或极早产儿定期行超声心动图监测肺动脉压和右心室功能,并在每次随访时监测血压。对于超声心动图监测的时间间隔,目前尚不能给出推荐意见,建议根据临床需要进行。
筛查指征推荐如下:BPD早产儿在出生后2个月仍需要吸氧,或需要正压通气者行超声心动图评估有无PH[78]。欧洲儿童肺血管疾病网络(European Pediatric Pulmonary Vascular Disease Network,EPPVDN)建议,在存在以下指标时需要经胸超声心动图筛查有无PH:(1)<28周早产儿出现严重呼吸衰竭;(2)PMA 36周和出院前患有BPD的婴儿;(3)任何氧需求延长、生长不良和临床改善不满意的婴儿[79]。美国心脏协会也建议对BPD患儿定期行心脏超声检查筛查PH[80]。
BPD早产儿易出现心血管系统并发症,如PH、右心室和/或左心室肥大、高血压和体-肺循环侧枝血管形成[81],BPD并发PH进一步发展可导致右心室肥厚,甚至右心衰竭而引起患儿死亡。研究发现,在出生后7 d,BPD患儿伴有PH比例高达42%[82]。在PMA 36周之后,17%~24%的BPD患儿发生BPD相关PH,BPD相关PH的病死率高达47%[83]。国内研究显示[81],19.4%的中重度BPD患儿在PMA 36周后并发PH。超声心动图作为无创监测手段,是PH筛查的首选;肺部血管CT检查可排除有无心血管畸形,如肺静脉狭窄、体-肺侧支循环等;心导管造影是诊断PH的金标准,但因其创伤性导致使用受到限制。
推荐对sBPD患儿和有睡眠呼吸障碍症状的儿童进行睡眠监测。监测的时间间隔,目前尚不能给出推荐意见,建议根据临床需要进行。
研究显示[84,85,86],BPD患儿在睡眠过程中更易出现严重的低氧血症、中枢性睡眠呼吸暂停和阻塞性睡眠呼吸暂停,通过氧疗可改善这种情况。国外相关指南建议[8],在有条件的情况下,对于sBPD患儿停止吸氧前、准备出院时仍然有呼吸暂停、间歇性低血氧饱和度或PMA 40周时仍然有心动过缓的患儿,可进行整夜多导睡眠(polysomnography,PSG)监测。如果BPD患儿出现持续性打鼾、呼吸粗重、呼吸困难、张口呼吸和生长发育落后等提示睡眠呼吸疾病的表现,或到2岁时仍然需要吸氧,也建议进行PSG监测。
推荐对BPD患儿进行血氧饱和度监测,监测的时间取决于病情严重程度及是否吸氧。
低氧血症是BPD最重要的病理生理改变,维持血氧饱和度接近正常范围的氧依赖程度是诊断、评估和监测BPD的主要依据[10]。单纯依靠临床表现,如呼吸频率、呼吸困难程度等可能会低估低氧血症[87]。血氧饱和度监测可以采用动脉血气分析定期监测SaO2,也可以采用脉搏血氧饱和度监测仪(简称脉搏血氧仪)监测脉搏血氧饱和度,两者相关性良好。脉搏血氧仪无创、操作简单、准确可靠、可实时持续监测,已成为常规监测低氧血症的方法。在BPD诊断阶段,所有患儿均应常规监测SpO2;在确定BPD诊断后,对于仍然需要吸氧(包括出院后家庭吸氧)的患儿需要持续性监测SpO2,以评估氧疗效果和调整吸氧量,从而维持患儿的SpO2在92%以上。对于已经不需要吸氧的BPD患儿,如发生呼吸道感染,应予以监测SpO2,以便尽早发现低氧血症,及时吸氧。
对于BPD患儿,若出现慢性咳嗽、反复喘息、呼吸机依赖或持续性低氧血症,治疗效果不佳且无法用其他原因解释时,建议进行支气管镜检查以明确诊断和评估病情。
BPD患儿由于气管支气管软化,且长期气管插管可并发声带麻痹、声门下狭窄等异常,这些异常可能会延长机械通气时间、影响进食,增加呼吸系统疾病发病率,甚至可能会危及生命[88]。支气管镜检查可有效识别气道异常,且安全性良好,有助于临床进行干预管理[17,89,90]。Hysinger等[88]发现,在接受可弯曲支气管镜检查的974例BPD婴儿中,有350例(36.2%)存在气道软化。另一项在对NICU的27例sBPD患儿进行可弯曲支气管镜检查显示[17],74%的患儿存在气道病变,包括气管软化(48.0%)、支气管软化(40.7%)和气道水肿(48.0%);对17例患儿进行了支气管肺泡灌洗,灌洗液的检查对找到感染病原很有帮助。
对于BPD患儿,若出现吸吮差、流涎、乳汁蓄积口中、频繁溢奶或呕吐、鼻咽返流,进食中出现发绀、气促等现象,或发生气道误吸危急事件,建议进行吞咽功能检查以明确诊断和评估病情[91]。
吞咽功能的评估方法:(1)主观性临床评估:临床观察及早产儿经口喂养评估量表评估,可评估患儿吞咽功能及经口喂养能力[92];(2)客观性吞咽评估:纤维内镜吞咽检查(fibreoptic endoscopic evaluation of swallowing,FEES) 及电视透视吞咽功能检查(video fluoroscopic swallowing study,VFSS)[93],可观察显像口咽喉部的生理结构及吞咽过程中的食团运送状况。
BPD患儿由于慢性呼吸功能不全、神经系统合并症及发育迟缓等因素,使其预期成熟的吸吮模式和吞咽节律建立延迟,表现为呼吸-吸吮-吞咽协调性差[94]。另一方面,长期机械通气使BPD患儿口腔敏感,且长期留置的气管内导管可使软腭发生重塑,导致腭咽功能不全及吸吮吞咽机制整合不良,而产生吞咽困难、喉咽反流导致气道误吸。同时,气管插管时间过长可并发声门瘢痕及狭窄,使患儿吞咽时声门无法完全闭合而导致误吸。BPD患儿因吞咽困难可导致长期依赖管饲喂养,气道误吸可加重继发肺损伤。研究表明,对BPD患儿吞咽功能评估,合理制定喂养及干预方案,可使患儿更早达到完全经口喂养,缩短住院时间[95]。
对于BPD患儿,若出现拒食、反复呕吐、进食时弓背体位、易激惹、睡眠障碍、咳嗽、喘息、呼吸暂停等症状,建议进行GER检查以明确诊断和评估病情[96]。
推荐GER检查方法有食管pH监测和食管多通道腔内阻抗(multichannel intraluminal impedance,MII)。食管pH监测是常用GER诊断性检查,但因其不能检测到pH值>4的反流,诊断价值有限。MII可检测酸性和非酸性食管反流,相比食管pH监测,MII的优势在于能够评估餐后反流。一项纳入了36例出生胎龄为23~37周早产儿的研究,在校正胎龄34~48周时进行MII检测,发现进食后较进食前反流发作更频繁,但反流物的酸性更低[97]。故目前多采用MII联合pH监测进行检查[98]。
BPD患儿因频繁咳嗽、气流阻塞和哭闹等原因导致腹内压升高;另外,呼吸兴奋剂(如咖啡因)的使用可增加胃酸分泌,降低贲门括约肌压力,使GER的发生率增加[99]。研究发现,23%(9/40例)的BPD患儿存在需外科手术干预的严重胃食管反流病(gastroesophageal reflux disease,GERD)。Farhath等[100]对59例早产儿连续收集28 d的气管吸引物进行分析显示,其胃蛋白酶浓度较非BPD婴儿明显增高,且sBPD患儿较中度BPD患儿更高。由此推断,因反流引发的吸入和微量吸入可能是加重BPD患儿肺损伤的重要因素。BPD患儿结合临床症状可进行相关GER检查,以明确诊断和指导治疗。然而,目前有关GER与BPD的关系仍存在争议[101],尚需进一步研究证实。
推荐对BPD患儿制定个体化的家庭护理指导方案。出院前的家庭护理指导包括指导家长提前购买家庭照护所需的设备及相关配件,指导家长掌握相关的家庭护理技能,评估家长已准备就绪[102,103,104]。
在BPD患儿出院前,由医护人员针对患儿的病情制定个体化的家庭护理指导,可有效缓解家长焦虑与紧张的心情,有助于降低BPD患儿出院后再入院率及不良预后。
家庭照护所需的设备及相关配件包括家用脉搏血氧仪、合适的面罩或口鼻罩与复苏球囊、家用制氧机(适用于计划实施家庭氧疗的患儿)、家用无创呼吸机(适用于计划实施呼吸机辅助通气的患儿)和家用吸痰仪(适用于存在吞咽功能障碍、需要定期清理气道的患儿)。
家长需掌握的家庭护理技能:(1)在护士指导下,家长学习吸痰(经鼻、口或经气管切开处)、喂养(经口或管饲)等患儿所需的主要护理技能;(2)在医师指导下,家长学会脉搏血氧仪数据判读、心肺复苏技能(basic life support,BLS)、制氧机或呼吸机参数调整(适用于需要家庭氧疗或呼吸机辅助通气的患儿);(3)在康复师指导下,学会口腔功能锻炼、肢体锻炼等康复手法(适用于吞咽功能或肢体运动功能障碍患儿);(4)在营养师指导下,学会营养素配比、辅食添加等喂养原则。
出院前,评估家长已准备就绪:(1)确保家长已完成至少1周的高质量家庭参与式照护;(2)确保家长已具备独立照护BPD患儿的自信心;(3)确保家长已通过上述家庭护理技能的考核;(4)确保家长已知晓随访计划、紧急情况下的就医流程与紧急医院联络人。
对于持续存在气流受限的BPD患儿,推荐按照慢性疾病的管理模式进行全程管理。
BPD患儿持续性气流受限在临床上可以表现为反复喘息(哮喘样症状)、运动耐受性下降、反复住院等,也可以无临床症状。针对这些患儿,需要按照慢性疾病的管理模式进行包括建档、评估、干预、随访再评估(监测)的全程管理。干预的措施有非药物和药物干预,见本共识相关部分。
推荐对BPD患儿进行运动指导。BPD患儿的运动指导包括运动项目与运动时间。运动项目包括运动耐力(有氧训练)、肌肉力量训练(阻力)和身体灵活性。因患儿病情不同、年龄不一,运动处方应考虑选择患儿感兴趣并有能力完成的运动形式,制定适宜的个体化运动方案。
对于BPD患儿,包括体育锻炼在内的肺康复治疗非常有效,运动训练也是治疗的重要组成部分之一。
对于0~5岁儿童运动形式应多样化,根据不同年龄生长发育情况,设置如爬行、步行、骑行、做游戏等运动;发育良好且运动能力较强的儿童,可酌情参加如游泳、篮球、体操等专项运动。
对于6~17岁儿童,应鼓励参加适合年龄特点的、有趣的、多样化运动,有益于增进心肺耐力、肌肉功能和骨骼健康。儿童、青少年对耐力训练、抗阻训练和骨骼负重均有生理适应性,但青春期前不适宜参加过多的高强度运动和器械负重抗阻训练,可进行适宜的自身体质量抗阻训练。
(1)运动耐力(有氧训练),包括慢跑、游泳、踢球等运动,初始运动时间由患儿当前本身可耐受的运动时间为下限,随着运动周期延长,在可耐受范围内逐步增加运动的强度和持续时间,达到每周2~3次有氧训练,每次30~60 min的运动目标,并且长期坚持,以达到通过长期有氧训练提高患儿的氧储备及锻炼肺功能的能力。
(2)肌肉力量训练,包括周边肌肉力量锻炼与肺部肌肉锻炼:①周边肌肉包括肱二头肌、肱三头肌、三角肌、腘绳肌、股四头肌等,可通过哑铃、拉力器等工具进行锻炼,重量从0.5 kg到2.0 kg,每次锻炼5~10 min;②训练肺部肌肉力量,主要是对膈肌、肋间肌和腹肌的训练,包括进行腹式呼吸、吹气球、扩胸运动、呼吸体操等,每次3 min。
(3)身体灵活性训练,包括周边肌肉拉伸(腘绳肌、股四头肌、小腿三头肌、三角肌、肱二头肌、胸和背部肌肉),每次5~10 min,也可通过跳舞、运动游戏等综合运动来增加身体灵活性。
通过以上长期的运动训练,可增加BPD患儿的运动耐力、运动能力,提高肺部的氧气储量,改善机体氧合状态,加强肺部肌肉力量、增强胸廓的呼吸运动,进而改善心肺功能。
Morales等[105]对4~6岁BPD患儿进行为期4周的包括6 min步行试验在内的多项运动训练,发现其运动耐力和运动能力、灵活性均发生了显著改变,肺功能尤其是气道阻塞程度也得到了改善。
推荐无需氧疗的幼儿期和学龄前期BPD患儿正常入托。但对于入托儿童,家长和学校应采取一定的防护措施:(1)培养良好卫生习惯:家长和老师注意宣传卫生知识,教会孩子做好手卫生、勤洗手,戴好口罩,降低交叉感染发生的风险。(2)培养良好睡眠习惯:保证孩子有充足的睡眠时间,睡眠时注意衣被合适,保证睡眠休息室的室内温度。(3)注意合理保暖:室内和户外活动时,需格外关注患儿的保暖问题,在孩子活动后及时提醒孩子喝温水、擦汗,甚至换掉汗湿内衣,避免在运动后受凉感染。(4)托幼机构设施布局合理:最好保证每个班的休息、玩耍、学习场所分开,孩子生活与学习场所干净与卫生,多开窗通风,避免班与班之间、班内之间交叉感染。避免休息床位过于拥挤,保证一定的床铺间距。(5)监测健康情况:做好老师及所有孩子的健康监测,对于出现发热、咳嗽、打喷嚏、咽痛等症状的孩子,建议医院治疗后回家休养、痊愈后再回托儿所,避免孩子在托儿所交叉感染。
推荐对BPD患儿实行多学科随访管理,多学科团队应包含呼吸科、心内科、神经科、耳鼻喉科、营养科、康复科、保健科、心理科等多学科医师、药师、护士、治疗师参与的治疗和护理。社区工作者及政府行政人员也应包括在内。一般于PMA 36周后启动。多学科随访计划应根据每个患儿的具体情况、并发疾病、预计后续可能出现的问题,进行个体化制定,并需关注患儿及其监护人的社会和情感诉求。
BPD患儿在儿童期可出现心血管、神经发育等疾病,中重度BPD可能需要较长时间的家庭氧疗及HMV支持[106,107],因此需要由多学科团队为其提供指导。出院后需要在随访团队的指导下逐渐减停氧气,并进行心肺功能随访监测。监测内容和监测时间见本共识相关部分。多学科随访管理是促进BPD患儿健康发展的有效手段[108],当BPD患儿出院后,须由该团队制定多学科定期随访计划,增加患儿及家长的依从性。
推荐对BPD患儿实行从儿童期到成年期的过渡管理,但具体如何实施有效、平稳的过渡目前尚无推荐。
过渡管理是指针对患慢性疾病的儿童,提供有目的、有计划的,从以父母管理为中心的照护模式向以患者自我管理为中心模式转换的医疗服务,这是一个复杂的动态过程,涉及患儿、家庭、监护人和医师的知识、技能及其协同和教育以及社会保障体系,而不是简单地把患儿从儿科移交给成人科室[109,110]。随着早产儿sBPD救治水平的提高,越来越多的sBPD患儿可以存活至成年期,其因肺部重塑导致的肺功能不全也会延续到成年期,出现了所谓的"成人BPD",主要表现为哮喘样症状、运动耐力降低、COPD和PH等[11,111,112]。青春期是从儿童向成年人过渡的关键时期,经历着生理、认知、情感和社会关系的巨大变化,由于这些特点,青少年对风险的感知能力较差和冒险行为、渴望独立自主但对疾病的本质和预后理解不足导致自我管理不良,进一步导致对治疗的依从性不佳和其他负面影响。因此对sBPD患儿实行规范的从儿童期到成年期过渡管理是非常重要和必要的,但具体如何实施有效、平稳的过渡目前尚无推荐。其他儿科疾病的管理模式可以借鉴[109,110],包括建立儿科-成人内科联合门诊,与青少年患者进行深入的沟通,重视青少年患者的需求,培训自我评估监测工具的使用,提高自我管理疾病的能力(技能),儿科医师与成人医师的详细交流和沟通等,逐渐形成无缝衔接,把患儿平稳移交到成人内科。值得注意的是,COPD是BPD在成年期常见的表现之一,而吸烟(包括被动吸烟)是COPD最重要的环境发病因素。青春期儿童是主动和被动吸烟的高发人群,因此对BPD的青少年及其家庭成员要特别进行健康教育,避免烟草烟雾暴露。
(徐保平 吴谨准 曹玲 陈爱欢 杜立中 胡黎园 姜红 刘瀚旻 刘秀云 卢根 潘家华 彭芸 唐兰芳 王立波 张皓 郑跃杰 周文浩 申昆玲 执笔)
参与本共识制定和审校的专家(按姓氏拼音排序):曹玲(首都儿科研究所附属儿童医院);陈爱欢(广州医科大学附属第一医院,广州呼吸健康研究院);杜立中(浙江大学医学院附属儿童医院);胡黎园(国家儿童医学中心,复旦大学附属儿科医院);姜红(青岛大学附属医院);刘瀚旻(四川大学华西第二医院);刘秀云(国家儿童医学中心,国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院);卢根(广州市妇女儿童医疗中心);潘家华[中国科学技术大学附属第一医院(安徽省立医院)];彭芸(国家儿童医学中心,国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院);申昆玲(国家儿童医学中心,国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院,深圳市儿童医院);唐兰芳(浙江大学医学院附属儿童医院);王立波(国家儿童医学中心,复旦大学附属儿科医院);吴谨准(厦门大学附属妇女儿童医院,厦门市妇幼保健院);徐保平(国家儿童医学中心,国家呼吸系统疾病临床医学研究中心,首都医科大学附属北京儿童医院);张皓(上海儿童医学中心);郑跃杰(深圳市儿童医院);周文浩(国家儿童医学中心,复旦大学附属儿科医院)
所有作者均声明不存在利益冲突


























