
全身型幼年特发性关节炎(systemic juvenile idiopathic arthritis,sJIA)是幼年特发性关节炎的一个亚型,是一种以高热和皮疹为主要特征,可伴全身多脏器功能损害的炎症性疾病。巨噬细胞活化综合征(macrophage activation syndrome,MAS)是最常继发于sJIA的严重风湿性疾病并发症,进展迅速,诊治不及时可危及生命。sJIA合并MAS的病因目前尚不明确,早期临床特征缺乏特异性,容易漏诊或误诊,延误治疗时机。虽然近年来对sJIA合并MAS的认识逐渐深入,但如何及时、合理诊治该病,仍是儿童风湿病医师面临的挑战。为进一步规范sJIA及其合并MAS的诊断、治疗、减停药方案,改善疾病总体预后,由中华医学会儿科学分会风湿病学组等4个儿童风湿病专业学术组织联合制定《全身型幼年特发性关节炎及合并巨噬细胞活化综合征诊疗专家共识(2022版)》,以更好指导该类疾病的临床诊治。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
为进一步规范全身型幼年特发性关节炎(systemic juvenile idiopathic arthritis,sJIA)及其合并巨噬细胞活化综合征(macrophage activation syndrome,MAS)的诊断、治疗、减停药方案,改善疾病总体预后,由中华医学会儿科学分会风湿病学组等4个儿童风湿病专业学术组织联合制定《全身型幼年特发性关节炎及合并巨噬细胞活化综合征诊疗专家共识(2022版)》,以更好指导该类疾病的临床诊治。
sJIA是以高热、皮疹,伴或不伴关节炎为主要特征的全身性、炎症性疾病,是幼年特发性关节炎(JIA)的一种亚型,约占JIA患儿的10%[1]。由于sJIA缺乏特异性诊断指标,需与感染性疾病和恶性病进行鉴别。该病多起病急骤,病情进展快,容易合并MAS而危及生命。
根据文献报道,sJIA发病率大约为10/10万[2],以学龄前期为主,平均发病年龄约为6岁,发病年龄高峰为1~3岁,无显著性别差异[3,4]。地域特点以亚洲sJIA发病率最高,欧洲、非洲的发病率其次,sJIA发病有明显的季节性改变[5]。
该病的病因及发病机制尚不完全清楚,可能与多种因素,如感染、免疫和遗传有关。目前认为感染可能是该病发生的重要触发因素[6]。吞噬细胞活化失控,自然杀伤(NK)细胞功能异常,导致固有免疫系统过度激活,引起固有免疫系统蛋白及信号途径被激活,进而激活炎症小体,产生大量的前炎性细胞因子,如白细胞介素(IL)-1、IL-6、IL-18和S100蛋白,另外,由于单核细胞中核转录因子(NF)-κB与肿瘤坏死因子(TNF)-α的协同作用,炎症级联反应被放大,因此引起多系统高炎症反应和状态[7,8]。
高热是该病的突出特点,体温每日波动于36~41 ℃之间,骤升骤降,一日内可出现1~2次高峰,高热时可伴寒战和全身中毒症状,如乏力、食欲减退、肌肉和关节疼痛等,热退后患儿精神反应如常,无明显痛苦。发热症状可持续数周至数月,自然缓解后常复发。
皮疹也是该病典型症状,其特征为发热时出现,随着体温升降而出现或消退。多表现为非固定部位的淡红色斑丘疹或荨麻疹样皮疹,可融合成片。可见于身体任何部位,但以胸部和四肢近端多见,一般消退后不留色素沉着。危重患儿体温下降不满意时,皮疹可持续存在。少数患儿于发热间歇期可出现皮肤划痕征。
关节痛或关节炎是主要症状之一。发生率在80%以上。可为多关节炎或少关节炎。常在发热时加剧,热退后减轻或缓解。以膝关节最常受累,手指关节、腕、肘、肩、踝关节亦常受累。少数患儿表现为发热时颈椎活动受限或强直、手足硬肿。反复发作数年后,部分患儿出现关节强直。关节症状既可首发,又可在急性发病数月或数年后才出现。半数以上患儿有不同程度肌肉酸痛,多在发热时明显。
多数患儿可有全身淋巴结肿大,以颈部淋巴结增大最常见,肠系膜淋巴结肿大时可出现轻度腹痛。约半数患儿有肝脾大,其中肝脏增大更常见,可伴有轻中度肝功能异常,少数患儿可出现黄疸。体温正常后肝脾可缩小。
约1/3的患儿出现胸膜炎或心包炎表现,可无明显症状。病情重时可出现胸痛、胸闷等不适。心肌亦可受累,但心内膜炎罕见。全身炎症反应重的患儿可有间质性肺炎,出现呼吸急促、咳嗽、低氧血症等非特异性症状。
白细胞计数和中性粒细胞计数显著升高,白细胞计数多>15×109/L,严重者可高达(20~40)×109/L,并有中性粒细胞增高,核左移;中等程度正细胞或小细胞低色素性贫血;血小板计数可明显升高。
sJIA患儿急性期ESR明显升高,多在50 mm/1 h以上,CRP往往超过50 mg/L,严重患儿ESR高达100 mm/1 h, CRP>100 mg/L。SF是监测sJIA敏感性及特异性较高的监测指标,检测水平与疾病活动度一致,通常高于400 μg/L。
SAA是一种敏感的急性时相反应蛋白,是淀粉样蛋白A(AA)的前体物质,广泛应用于感染、炎症、外伤、肿瘤等的诊断。sJIA患儿疾病活动期可显著升高,一般在100 ng/L以上。S100蛋白是一种酸性钙结合蛋白,血浆中一般检测不到。血浆中S100蛋白浓度增高与脑组织损伤及血脑屏障通透性增加有关,因此S100蛋白检测常用于脑损伤性疾病、心脏疾病、炎症性疾病、肿瘤等。sJIA患儿炎症反应高时,血浆浓度多>0.5 μg/L,有临床指导意义。
肝酶升高、血钠及白蛋白降低;凝血功能异常主要表现为D-二聚体(D-dimer)升高、纤维蛋白原(FIB)升高。
关节影像学检查有助于了解关节病变情况,对sJIA伴关节症状患儿具有指导意义。X线检查用于评估骨质疏松及关节周围软组织肿胀情况,sJIA患儿可表现为轻度骨质疏松和/或周围软组织肿胀,亦可无阳性发现。关节超声用于了解滑膜病变、积液量及软组织肿胀情况,因为操作简便,常用于患儿关节炎疾病动态监测。关节磁共振成像(MRI)可发现早期骨髓水肿、滑膜增厚等病变,在sJIA患儿的关节病变评估中有较高临床价值。
心电图和心脏彩超检查是通常用于评估心脏有无受累的检查方法,心电图可表现为窦性心动过速、T波轻度异常。心脏彩超可表现为室壁运动幅度减低和/或冠状动脉扩张,心功能轻度下降等非特异性改变。必要时完善24 h动态心电图检查协诊有无电生理异常。
部分患儿可以合并肺间实质病变,肺部高分辨率CT可用于评估sJIA患儿有无肺部受累,对发现间质性肺疾病、胸膜炎等有重要意义。
腹部超声可表现为肝脾及腹腔淋巴结轻度增大,少数患儿消化道超声提示轻度肠淤张或黏膜水肿;头颅CT或MRI检查用于评估有无中枢神经系统受累。有间质性肺疾病患儿需进一步行肺功能检查,后者通常可表现为小气道通气功能异常。
目前临床广泛应用的诊断标准是2001年国际风湿病联盟(International League of Associations for Rheumatology,ILAR)提出并修订的JIA分类标准[9]。2019年,儿童风湿病国际试验组织(Pediatric Rheumatology International Trials Organization, PRINTO)提出JIA新的分型标准[10],强调sJIA是一种全身性炎症性疾病,与疾病的本质特点更加接近;另外强调外周血白细胞计数在sJIA诊断中的重要作用,2个标准的具体内容见表1。

sJIA 2001年ILAR标准和2019年PRINTO标准比较
Comparison of ILAR criteria of sJIA in 2001 and PRINTO criteria in 2019
sJIA 2001年ILAR标准和2019年PRINTO标准比较
Comparison of ILAR criteria of sJIA in 2001 and PRINTO criteria in 2019
| 诊断项目 | ILAR标准(2001年) | PRINTO标准(2019年) |
|---|---|---|
| 诊断标准 | 1个至多个关节受累,伴有至少持续2周的发热,其中至少有3 d每天均出现弛张热(热峰≥39 ℃,每天1次,可降至≤37 ℃) | 不明原因发热(排除感染、肿瘤、自身免疫或单基因自身炎症性疾病) |
| 每天记录发热情况,热峰≥39 ℃,每日至少1次,在2次热峰之间降至≤37 ℃,至少连续3 d | ||
| 同时满足下列1项或多项:1.可消退的(不固定的)红斑样皮疹;2.淋巴结肿大;3.肝或脾肿大;4.浆膜炎 | 复发持续时间至少2周并伴有2项主要标准或1项主要标准和2项次要标准 | |
| 主要标准:1.可消退的(非固定性)红斑样皮疹;2.关节炎 | ||
| 次要标准:1.全身淋巴结肿大和/或肝肿大和/或脾肿大;2.浆膜炎;3.关节痛持续时间>2周(无关节炎);4.白细胞增多(≥15×109/L) | ||
| 排除标准 | 1.有银屑病或一级亲属有银屑病病史 | |
| 2.在6岁以后起病的男性且HLA-B27阳性的关节炎患儿 | ||
| 3.有强直性脊柱炎、ERA、炎性肠病中有骶髂关节炎表现、急性前葡萄膜炎病史,或一级亲属中有上述病史 | ||
| 4.间隔3个月查RF至少有2次阳性 |
注:ILAR:国际风湿病联盟;PRINTO:儿童风湿病国际试验组织;HLA:人类白细胞抗原;ERA:附着点炎症相关关节炎;RF:类风湿因子 ILAR:International League of Associations for Rheumatology;PRINTO:Pediatric Rheumatology International Trials Organization;HLA:human leukocyte antigen;ERA:enthesitis related arthritis;RF:rheumatoid factor
sJIA的临床特点缺乏特异性,鉴别诊断非常重要。需与感染性疾病、肿瘤性疾病及其他风湿性疾病,尤其是自身炎症性疾病进行鉴别。
感染性疾病依据病原种类不同,临床表现各异,非特异性临床表现以发热、皮疹、乏力、寒战等最常见;特殊病原感染后发热及皮疹特点具有各自特点,如疟疾、莱姆病、伤寒等。一般通过病原学检查,影像学检查寻找病灶,可作为鉴别要点,如血培养阳性、病毒-PCR定量分析、分枝杆菌培养、寄生虫找到虫卵、包涵体或鞭毛等病原学的依据等有助于与sJIA相鉴别。特殊寄生虫感染后的骨髓细胞涂片,可找到病原学依据,如杜氏利什曼虫的无鞭毛体、巴贝斯虫等。
感染是sJIA的重要触发因素,因此,在疾病的不同阶段,评估原发病活动性的同时,都需要警惕是否合并感染因素。
血液肿瘤系统疾病临床可表现为慢性发热伴或不伴关节症状及皮疹,如白血病、淋巴瘤、神经母细胞瘤等恶性病患儿,临床可表现为发热、骨痛、浅表淋巴结及肝脾大、多浆膜炎等症状,需注意与sJIA相鉴别。通过筛查肿瘤标志物、骨髓细胞学、正电子发射断层显像(PET)-CT、组织病理学或免疫学等指标可与sJIA鉴别。
系统性红斑狼疮是弥漫性结缔组织病的代表,自身抗体大量产生是其主要免疫学特点。该病临床表现多样,如冻疮样皮疹、紫癜样皮疹、关节炎、发热等,但热型多为不规则热,发热与皮疹无明显相关性。皮疹多与紫外线照射有关;关节炎症缺乏特异性,一般不伴有骨质破坏。
幼年皮肌炎也可表现为面部、颈背部、肘关节及膝关节伸面皮肤潮红、粗糙或紫丁香样皮疹(即"向阳征"、"V领征"、"高春征"),与sJIA皮疹特点存在明显差异。关节炎症状一般较轻,致残率低;发热不是主要临床表现,少数病例以低热及不规则热为主。
白塞病、川崎病、过敏性紫癜等血管炎性疾病,可伴不同程度的发热。白塞病以脓疱疹、黏膜溃疡为主要表现,与发热无密切相关性,热型缺乏特异性;关节症状并非主要临床表现。川崎病急性期表现为高热、充血性皮疹、黏膜炎症,关节炎多见于急性期表现,但该病易合并冠状动脉受累,免疫球蛋白冲击治疗有效是主要鉴别点。
NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体病、家族性地中海热等自身炎症性疾病临床可表现为关节肿痛、慢性发热、口腔黏膜溃疡、多形性红斑等症状,需注意与sJIA相鉴别。但该类疾病多具有家族聚集性,遗传学特点可表现为单基因突变,临床多以全身炎症反应、多系统受累等为主要表现,可通过基因测序与sJIA鉴别(详见儿童自身炎症性疾病诊断与治疗专家共识[11])。
sJIA的总体治疗目标是在治疗后6~12个月内达到疾病的临床缓解。早期治疗目标为:治疗后7 d内,体温稳定于正常水平,同时CRP至少改善50%。治疗后4周内,总体疾病活动度得到改善,即医师整体疾病活动评分(physician′s global assessment, PGA)至少改善50%,活动性关节数目和/或sJIA疾病活动性评分(systemic juvenile arthris disease activity score,sJADAS)至少改善50%。
注意休息、均衡饮食保证足够热卡摄入。物理降温,避免接触疾病触发因素,如感染、致敏源等;监测生命体征、及时对症处理。
尽早应用糖皮质激素是快速减轻sJIA全身炎症反应最有效的治疗方法。联合应用非甾体抗炎药(non steroidal anti-inflammatory drugs,NSAIDs)可改善sJIA发热症状、缓解关节疼痛,尽早联合应用免疫抑制剂及生物制剂,有助于控制sJIA全身炎症反应及糖皮质激素减量。
NSAIDs可用于缓解sJIA患儿的发热及关节炎症状。根据sJIA炎症反应程度不同,可与糖皮质激素和/或免疫抑制剂联合应用。常用NSAIDs包括布洛芬、吲哚美辛、萘普生、双氯芬酸、塞来昔布,见表2。
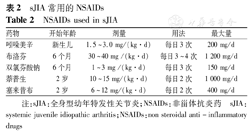
sJIA常用的NSAIDs
NSAIDs used in sJIA
sJIA常用的NSAIDs
NSAIDs used in sJIA
| 药物 | 开始年龄 | 剂量 | 用法 | 最大量 |
|---|---|---|---|---|
| 吲哚美辛 | 新生儿 | 1.5~3.0 mg/(kg·d) | 每日3次 | 200 mg/d |
| 布洛芬 | 6个月 | 30~40 mg /(kg·d) | 每日3~4次 | 1 200 mg/d |
| 双氯芬酸钠 | 6个月 | 1~3 mg /(kg·d) | 每日3次 | 150 mg/d |
| 萘普生 | 2岁 | 10~15 mg/(kg·d) | 每日2次 | 1 000 mg/d |
| 塞来昔布 | 2岁 | 6~12 mg/(kg·d) | 每日2次 | 400 mg/d |
注:sJIA:全身型幼年特发性关节炎;NSAIDs:非甾体抗炎药 sJIA:systemic juvenile idiopathic arthritis;NSAIDs:non steroidal anti-inflammatory drugs
布洛芬用于sJIA疾病活动期退热、抗炎治疗;吲哚美辛可用于新生儿,全天最大剂量不超过200 mg;双氯芬酸可用于6个月以上儿童;萘普生和塞来昔布用于2岁以上儿童。萘普生、双氯芬酸和塞来昔布主要用于缓解期患儿控制关节炎症。不建议同时服用2种及以上NSAIDs药物,以减少药物不良反应。需引起注意的是,NSAIDs不能阻止关节病变进展,主要用于缓解临床症状。需要关注其肝肾毒性作用及消化道不良反应,如腹痛、反酸、消化道溃疡等。
因糖皮质激素具有快速、强效的抗炎作用,建议sJIA患儿应早期加用,以达到迅速缓解疾病进展、降低炎症反应的目标。
应用激素的剂量取决于全身炎症反应的程度。全身炎症反应呈轻中度的sJIA患儿,可口服醋酸泼尼松1~2 mg/(kg·d),每天分2~3次服用,总量不超过60 mg/d。炎症反应重,疾病活动度高的sJIA患儿,需大剂量甲泼尼龙静脉冲击治疗,剂量为20~30 mg/(kg·d),每日最大量不超过1 g,连续3~5 d为1个疗程,随后给予1~2 mg/(kg·d)口服剂量泼尼松序贯治疗。根据疾病缓解情况,必要时可间隔3~5 d行第2疗程大剂量激素冲击加强治疗。
糖皮质激素虽有良好的抗炎作用,但长期、大量应用会出现库欣综合征、高血压、高血糖及生长发育受抑制等不良反应;容易合并细菌、真菌、病毒和/或结核感染;少数患儿可出现糖皮质激素诱导骨质疏松症(glucoconicoid induced osteoporosis,GIOP),甚至股骨头坏死。因此要严格把握糖皮质激素适应证、药物剂量及疗程,监测不良反应。可依据达标治疗原则,病情控制后可逐渐减量直至停药。
全身炎症反应重的sJIA患儿,应用糖皮质激素抗炎可能不能及时达到临床缓解,建议环孢素A(Cyclosporine A,CsA)与糖皮质激素联合抗炎。CsA口服剂量为2~3 mg/(kg·d),每天分2次口服,一般最大剂量不超过100 mg/d。应用CsA治疗的患儿,可出现高眼压、高血压、皮肤多毛、牙龈增生伴色素沉着等症状。需监测肝肾功能和CsA血药浓度,避免药物中毒。
csDMARDs起效缓慢、抗炎效果较弱,主要用于缓解关节炎进展并延缓骨质破坏,可于早期糖皮质激素抗炎起效后联合应用。甲氨蝶呤(Methotrexate,MTX):用于减缓骨质破坏,减轻症状和体征。推荐剂量为10~15 mg/m2,每周1次顿服。MTX不良反应可表现为不同程度胃肠道反应、一过性转氨酶升高、胃炎和口腔溃疡、贫血和粒细胞减少等。口服MTX24 h后,推荐口服叶酸以减轻药物不良反应;剂量一般为MTX剂量的1/3~1/2,最大剂量5 mg/周。
来氟米特(Leflunomide,LEF):推荐用于MTX不耐受或不能完全应答的、较大龄的sJIA患儿。可减轻滑膜炎症,缓解骨质破坏。体重>30 kg的患儿,剂量为10~15 mg/d,常见的不良反应为腹泻、肝转氨酶升高、脱发、皮疹、白细胞下降和瘙痒等。
根据sJIA达标治疗的总原则,针对应用糖皮质激素、NSAIDs治疗不耐受或不完全应答的sJIA患儿,应尽早联合应用生物靶向药治疗。推荐sJIA无合并MAS的患儿尽早规律应用抗IL-6拮抗剂抗炎治疗。针对长期治疗后仍遗留有关节炎症状的sJIA患儿,推荐联合应用TNF拮抗剂及csDMARDs治疗,而非通过增加糖皮质激素剂量或延长其用药时间达到治疗目标,见表3。

sJIA常用的bDMARDs
bDMARDs used in sJIA
sJIA常用的bDMARDs
bDMARDs used in sJIA
| 分类 | 名称 | JIA适应证获批情况 | 用法用量 |
|---|---|---|---|
| IL-6拮抗剂 | 托珠单抗 | 国内获批,国内已上市 | 推荐用于sJIA早期,无合并MAS时,可有效缓解全身炎症反应 |
| 体重≤30 kg,每次12 mg/kg;体重>30 kg,每次8 mg/kg;每2周1次,静脉输注;根据患儿疾病活动度恢复情况,酌情调整治疗方案(延长用药周期或减少单次药物剂量) | |||
| IL-1拮抗剂 | 阿那白滞素 | 国外获批,国内未上市 | 推荐用于sJIA早期,对于疾病活动度高的患儿,可快速缓解全身炎症反应;2 mg/kg,每日1次,皮下注射;最大剂量100 mg |
| 卡那单抗 | 国外获批,国内未上市 | 推荐用于sJIA早期,对于疾病活动度高的患儿,可缓解全身炎症反应;体重15~40 kg ,每8周1次,每次皮下注射2 mg/kg;体重>40 kg,每8周1次,每次皮下注射150 mg | |
| TNF-α拮抗剂 | 依那西普/重组人Ⅱ型TNF受体-抗体融合蛋白 | 国内获批,国内已上市 | 推荐用于sJIA持续有关节炎症状者;0.4 mg/( kg·次),每周2次,皮下注射 |
| 英夫利西单抗 | 国内未获批sJIA适应证,已批准用于pJIA;国外获批sJIA;国内已上市 | 推荐用于sJIA持续有关节炎症状者;剂量为3~5 mg/( kg·次),缓慢静脉滴注,前2剂间隔2周执行,此后为每4周1次 | |
| 阿达木单抗 | 国内获批,国内已上市 | 推荐用于sJIA持续有关节炎症状者;体重10~<30 kg的剂量为20 mg,≥30 kg的剂量为40 mg;每2周1次,皮下注射 | |
| 戈利木单抗 | 国内获批,国内已上市 | 推荐用于sJIA持续有关节炎症状者;30 mg/m2,每4周皮下注射1次,最大剂量50 mg/次 | |
| 其他 | 阿巴西普 | 国内获批,国内已上市 | 推荐用于关节炎持续不缓解并对IL-1和/或IL-6抑制剂不完全反应时 |
| 静脉滴注:体重<75 kg,每次10 mg/( kg·次);体重75~100 kg者,每次750 mg;体重>100 kg,每次1 g,儿童最大单次剂量1 g。第1、2、4周各给药1次,此后每4周给药1次,每次输注时间0.5 h以上 | |||
| 皮下注射:2岁及2岁以上儿童,体重10~25 kg(不包括25 kg),每次50 mg;体重25~50 kg(不包括50 kg),每次87.5 mg;体重≥50 kg,每次125 mg,每周1次 |
注:sJIA:全身型幼年特发性关节炎;bDMARDs:生物制剂改善病情抗风湿药;JIA:幼年特发性关节炎;IL:白细胞介素;MAS:巨噬细胞活化综合征;TNF:肿瘤坏死因子;pJIA:多关节型幼年特发性关节炎 sJIA:systemic juvenile idiopathic arthritis;bDMARDs:biologic disease modifying antirheumatic drugs;JIA:juvenile idiopathic arthritis;IL:interleukin;MAS:macrophage activation syndrome;TNF:tumor necrosis factor;pJIA:polyarticular juvenile idiopathic arthritis
应用bDMARDs治疗前,建议筛查患儿是否有活动性感染性疾病,尤其注意有无活动性肝炎病毒感染和结核分枝杆菌感染;如存在感染性疾病,需规律抗感染治疗至感染完全控制;针对结核菌素试验(PPD)阳性但无活动性结核感染患儿,至少4周异烟肼口服预防抗结核治疗后,可酌情加用bDMARDs。治疗sJIA期间,需要动态监测上述病原学是否有再感染,必要时调整治疗方案。
有研究[12]认为JAK抑制剂可减轻sJIA患儿的全身炎症反应,对改善关节症状有效。应用JAK抑制剂治疗前,建议筛查患儿是否有活动性感染性疾病,尤其是疱疹病毒、水痘病毒及结核分枝杆菌感染。如存在感染性疾病,需规律抗感染治疗至疾病完全控制方可用药。
据报道,托法替布(Tofacitinib)有助于抗炎协助激素减量[12]、芦可替尼(Ruxolitinib)对于sJIA合并肺部病变的患儿有较好疗效[13]。这两种药物在JIA中有较好的应用前景。吡西替尼是日本和韩国批准用于治疗类风湿关节炎(RA)的JAK抑制剂,在美国和中国正在研究作为治疗RA的药物[14]。
沙利度胺(Thalidomide):用于改善sJIA关节症状和控制体温,早期应用,有助于控制炎症反应及激素减量。口服剂量为2~4 mg/(kg·d),最大剂量100 mg/d[15],治疗期间需要注意有无妊娠,该药有致胎儿畸形、嗜睡及末梢神经炎等神经系统不良反应。
sJIA治疗后病情评估是"达标治疗(treat to target,T2T)"策略下,阶段性判断sJIA患儿治疗效果的重要工具。根据评估结果,及时调整治疗方案,尽早实现达标。推荐应用sJADAS进行疾病活动性评估[16]。
sJADAS由以下5个项目组成:(1)医师对整体疾病活动性的全面评估(PGA),采用10 cm视觉模拟量表(visual analog scale,VAS)(0=疾病无活动;10=疾病最大活动);(2)家长或患儿对整体疾病活动性的全面评估,采用10 cm VAS(0=感觉很好;10=感觉非常差);(3)计算活动性关节数目(可根据sJADAS10、sJADAS27和sJADAS71分别计算10、27及71个关节中的活动性关节数目);(4)ESR或CRP水平,均已标准化为0~10级;(5)全身表现评分(systemic manifestation score,SMS)。
关于sJADAS项目计算的说明:(1)sJADAS评分是上述5个项目得分的简单线性总和。(2)对于sJADAS10、sJADAS27和sJADAS71,其整体得分分别为0~50、0~67和0~111。(3)ESR(单位:mm/1 h)分级:根据公式"(ESR测量值-20)/10"将ESR进行标准化,其中ESR测量值<20 mm/1 h,记为0;ESR测量值>120 mm/1 h,记为10。(4)CRP(单位:mg/L)分级:根据公式"(CRP测量值-10)/10",其中CRP值<10 mg/L记为0,CRP测量值>110 mg/L,记为10。(5)关于SMS,该项目的评分细则见表4。SMS评分范围0~10分,0=缺乏全身表现;10=最大活动度的全身表现。
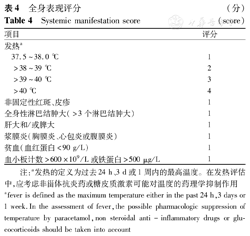
全身表现评分 (分)
Systemic manifestation score (score)
全身表现评分 (分)
Systemic manifestation score (score)
| 项目 | 评分 | |
|---|---|---|
| 发热a | ||
| 37.5~38.0 ℃ | 1 | |
| >38~39 ℃ | 2 | |
| >39~40 ℃ | 3 | |
| >40 ℃ | 4 | |
| 非固定性红斑、皮疹 | 1 | |
| 全身性淋巴结肿大(>3个淋巴结肿大) | 1 | |
| 肝大和/或脾大 | 1 | |
| 浆膜炎(胸膜炎、心包炎或腹膜炎) | 1 | |
| 贫血(血红蛋白<90 g/L) | 1 | |
| 血小板计数>600×109/L或铁蛋白>500 μg/L | 1 | |
注:a发热的定义为过去24 h、3 d或1周内的最高温度。在发热评估中,应考虑非甾体抗炎药或糖皮质激素可能对温度的药理学抑制作用 afever is defined as the maximum temperature either in the past 24 h,3 days or 1 week.In the assessment of fever,the possible pharmacologic suppression of temperature by paracetamol,non steroidal anti-inflammatory drugs or glucocorticoids should be taken into account
sJIA患儿的预后主要分为3种类型[17]。大约50%的sJIA患儿具有持续性疾病活动过程,其特征是持续活跃的全身炎症反应和关节症状。在该类病例中,全身症状最终得到缓解,但关节炎仍然持续存在,可能会导致功能性残疾。大约30%~40%的sJIA患儿具有单相疾病过程。这些患儿有单一的全身症状和关节炎发作,通常持续不到24个月,随后药物完全缓解,没有复发。这些患儿预后很好,致残可能性很低。另外10%~20%的sJIA患儿具有多次反复的病程,疾病复发与药物缓解期(数月或数年)交替。
引起sJIA患儿死亡的主要原因为合并MAS和感染,其中间质性肺病、肺泡蛋白沉积症、肺动脉高压、心肌炎、心律失常和心包压塞[18]等并发症也严重影响sJIA患儿的预后。因此,sJIA要早诊早治,减少并发症的发生,有助于改善预后,降低病死率。
MAS是以高炎性反应为主的全身性疾病,可继发于自身免疫及自身炎症性疾病患儿,但以继发于sJIA者最常见[19]。MAS是sJIA的一种严重的、潜在的危及生命的并发症,MAS是一类免疫异常导致的过度炎症反应综合征。MAS的免疫调节异常主要由淋巴细胞、单核细胞和巨噬细胞系统异常激活、增殖,分泌大量炎性细胞因子而引起的一系列炎症反应。临床以持续发热、肝脾大、全血细胞减少以及骨髓、肝、脾、淋巴结组织发现噬血现象为主要特征。虽然目前认为MAS是继发性噬血细胞性淋巴组织细胞增生症(HLH)的一个亚型,但与HLH有诸多不同之处[20]。
为进一步统一对MAS的认识,规范该病的诊治,本共识将就sJIA合并MAS的发病机制、临床特点、诊断及鉴别诊断要点、疾病活动性评价、治疗方案及预后进行推荐。
sJIA中MAS发病率尚不清楚,sJIA患儿中10%~15%可出现MAS表现,而合并亚临床MAS(subclinical MAS)的sJIA患儿比例则可高达40%[21,22]。MAS多发生于疾病早期,发作时的sJIA持续中位时间为3.5个月,sJIA并发MAS的病死率为8%~20%[23], 而既往报道未经治疗的患儿病死率可高达60%。儿童发病年龄多在5岁左右[24]。
MAS发病机制主要与3个方面的因素相关:遗传易感性(基因突变,如MUNC13-4,Toll样受体9、Rab27A、STXBP2等与MAS的发病机制有关[25]),活动性炎症,感染等诱发因素。sJIA患儿的高炎症状态没有得到及时控制下,在各种触发因素作用下,导致T淋巴细胞和巨噬细胞的过度活化和增殖,诱发"细胞因子风暴"发生[26]。参与MAS的细胞因子包括IL-6和IL-18、干扰素(interferon,IFN)-γ和TNF-α过量产生[27,28],IL-10(一种反调节IFN-γ的调节性细胞因子,IL-10可通过JAK-STAT3通路产生抗IFN-γ信号抗炎因子)产生不足[29],其中IL-18和IFN-γ的升高是MAS出现的重要标志,巨噬细胞活化可导致"细胞因子风暴"和暴发性MAS[30],触发全身炎症反应,毛细血管扩张,组织水肿等,最终导致组织、器官损伤,甚至死亡。
MAS可由于sJIA活动不可控制,导致的严重并发症,或可能由感染、药物治疗的改变或药物(包括生物制剂)的毒性作用触发。临床上,MAS患儿出现不可缓解的高热、全血细胞减少、肝脾大、肝功能障碍、脑病、凝血异常和SF水平急剧增加。出现下述临床表现需要高度警惕MAS的发生[31]。
持续高热常常是MAS的首发症状。热型由sJIA的弛张高热转换为稽留热,部分患儿表现为sJIA疾病活动度高时的弛张热,每日热峰更加频繁,退热更加困难。
可出现持续不退的充血性"荨麻疹"样皮疹,多与发热并行,是MAS全身高炎症反应、血管炎表现的重要特点之一。皮疹可融合成片,形成固定部位的充血性斑疹,不易消退,不同于sJIA。重症可表现为"红皮病"样皮疹或斯-琼综合征。皮肤黏膜可表现为明显的出血倾向,如紫癜、黏膜出血、黏膜下血疱形成、结膜充血、指/趾端溃疡等。进展期MAS患儿皮肤黏膜易出血,可表现为消化道出血,亦可能出现弥散性血管内凝血(DIC)。
全身淋巴结弥漫性肿大,尤其是腋窝淋巴结肿大,是该病特点之一,出现这些情况需警惕MAS。肝脏、脾脏随病程进展进行性增大或质地变硬,提示MAS病情活动度高。肝功能急剧恶化,可表现为恶心、呕吐、黄疸及肝酶在短期内迅速升高,并可出现肝脏其他代谢功能紊乱。
患儿可表现为嗜睡、烦躁、定向力障碍、头痛、抽搐、昏迷,重症患儿可以出现脑水肿及脑疝危及生命,可迅速进展,引起脑死亡。
可表现为呼吸浅快,咳嗽、憋气、呼吸困难和低氧血症等表现,重症可出现急性呼吸窘迫综合征、肺水肿、肺出血表现[32]危及生命。
MAS病程后期可因心肌病变出现心力衰竭和多种心律失常,伴顽固性低血压,失代偿休克[33],这些情况的出现多为预后不良的标志。
可表现为恶心、呕吐、腹痛、腹胀、腹泻、黄疸及肝酶在短期内迅速增高进而出现肝衰竭等表现,重症患儿可出现急性坏死性胰腺炎、消化道出血等症状。
可表现为三系减少,全身性出血倾向,重症患儿可合并DIC及脏器出血表现。
可表现为肾功能异常、肾功能不全,蛋白尿、少尿、氮质血症等症状,临床发病率较低。
值得注意的是,MAS表现可以非常严重,由于心脏功能、呼吸功能、循环功能和肾衰竭而进入重症监护病房治疗;也可以仅表现为持续发热,不伴有明显的器官增大,血常规相对降低,轻微的凝血功能障碍。因此MAS早期识别尤其重要。
MAS的实验室检查特点也出现一些特征性表现,见表5。其中前5项指标推荐应用于MAS常规评估中,临床工作中可根据患儿病情严重程度及脏器受累情况,针对性选择其他检查方案对患儿疾病进行评估。

MAS的辅助检查特点
Characteristic of auxiliary examination in MAS
MAS的辅助检查特点
Characteristic of auxiliary examination in MAS
| 项目 | 检查特点 | |
|---|---|---|
| 血常规 | 白细胞、血红蛋白、血小板减低,累及单一血细胞系统或多系;或血细胞较前相比出现明显下降趋势,提示吞噬血细胞现象出现 | |
| 炎性指标 | SF急剧升高,是该病特征性改变之一,可高达数千甚至上万μg/L,SF增高可作为评价MAS病情活动性的指标[36];ESR可迅速降低,与CRP增高不平行,与全身高炎症状态不匹配 | |
| 肝酶异常 | 肝酶可以短期快速增高,可出现于数小时内;ALT、AST、γ-谷氨酰转移酶等均可增高;部分患儿可出现总胆红素升高,以直接胆红素升高为主 | |
| 凝血功能异常 | 可出现凝血酶原时间、APTT延长,FIB明显降低,FIB降解产物增加,D-二聚体显著增高 | |
| 血液生化 | 甘油三酯、LDH增高,尤其LDH升高迅速且程度较高;其他肌酶也可不同程度增高;钠离子、白蛋白可减低 | |
| 其他 | 可溶性CD25(sCD25)和sCD163水平增高 | |
| 基因检测 | 可进行NK细胞活性和脱颗粒功能检测(NK细胞和CTL细胞膜△CD107a)以及穿孔素、颗粒酶B、Munc-13、SAP、XIAP等与HLH缺陷基因相对应的蛋白表达量的检测 | |
| 组织病理学a | 骨髓细胞学检查早期可表现为反应性组织细胞增生,后期出现可吞噬红细胞、血小板、有核细胞的噬血细胞[37];骨髓组织CD163染色增加 | |
| 影像学检查(根据脏器受累情况选择合适的影像学检查) | 呼吸系统受累 | 胸片:两肺弥漫性斑片影、胸膜增厚、胸腔积液、肺水肿、肺出血等 |
| 肺高分辨率CT:两肺间实质浸润,小叶间隔增厚、胸腔积液、"白肺"等急性呼吸窘迫综合征的肺部影像学改变[38] | ||
| 中枢神经系统受累 | 头颅磁共振成像或CT平扫:脑水肿甚至脑疝等影像学改变 | |
| 循环系统受累 | 心脏彩超示血流动力学改变、射血分数下降等 | |
| 消化系统受累 | 腹部超声或磁共振成像:肝脾大及腹腔淋巴结增多、多浆膜炎,重症患儿可出现急性坏死性胰腺炎、消化道出血等严重并发症[39] | |
注:MAS:巨噬细胞活化综合征;SF:血清铁蛋白;ESR:红细胞沉降率;CRP:C反应蛋白;ALT:谷丙转氨酶;AST:谷草转氨酶;APTT:活化部分凝血活酶时间;FIB:纤维蛋白原;LDH:乳酸脱氢酶;NK:自然杀伤;CTL:细胞毒性T淋巴细胞;HLH:噬血细胞性淋巴组织细胞增生症。a并非所有MAS患儿的骨髓涂片/活检标本都可发现噬血现象。因此噬血现象不是诊断MAS的必要条件,不能因未发现噬血现象否认MAS,也不应仅凭噬血现象确诊MAS MAS:macrophage activation syndrome;SF:serum ferritin;ESR:erythrocyte sedimentation rate;CRP:C-reactive protein;ALT:alanine aminotransferase;AST:aspartate aminotransferase;APTT:activated partial thromboplastin time;FIB:fibrinogen;LDH:lactate dehydrogenase;NK:natural killer;CTL:cytotoxic T lymphocyte;HLH:hemophagocytic lymphohistiocytosis.anot all MAS patients′ bone marrow biopsy can be found with hemophagocytosis.Therefore,hemophagocytosis is not a necessary condition for the diagnosis of MAS.MAS should not be denied for no hemophagocytosis is found,nor should it be diagnosed by hemophagocytosis alone
MAS是一种危及生命的并发症,早期诊断、早期治疗非常重要,建议应用MAS/sJIA(MS)评分[34]工具作为早期诊断工具,并参考2016年欧洲抗风湿病联盟(EULAR)/ 美国风湿病学会(ACR)/ PRINTO标准对sJIA合并MAS进行早期诊断[35], MS评分范围从-8.4到41.8,包括7项变量(表6):中枢神经系统功能障碍、出血表现、活动性关节炎、血小板计数、FIB、乳酸脱氢酶(LDH)和SF,MS评分计算公式=中枢神经系统受累×2.44+出血表现×1.54+关节炎×(-1.30)+血小板计数×(-0.003)+LDH×0.001+ FIB×(-0.004)+SF×0.000 1。对于临床特征(中枢神经系统受累、出血表现和活动性关节炎),公式中的分数为0或1,这取决于上述特征是否存在。若公式计算后MS值≥-2.1,则sJIA合并MAS的可能性大,由于将发热作为病情活动的强制指标,因此未被列入公式所含项目中。

MS疾病活动度评分表
MS scoring items
MS疾病活动度评分表
MS scoring items
| MS评分项目 | |
| (1)中枢神经系统受累×2.44 | |
| (2)+出血现象×1.54 | |
| (3)+关节炎×(-1.30) | |
| (4)+血小板计数×(-0.003) | |
| (5)+乳酸脱氢酶×0.001 | |
| (6)+纤维蛋白原×(-0.004) | |
| (7)+铁蛋白×0.000 1 | |
注:MS:巨噬细胞活化综合征/全身型幼年特发性关节炎 MS:macrophage activation syndrome/systemic juvenile idiopathic arthritis
值得注意的是,MAS的不同阶段,临床表现缺乏特异性,尤其是早期表现与sJIA不易区分,易错失最佳治疗时机,应用评分标准进行早期诊断尤其困难。
sJIA合并的MAS需与原发性HLH及其他风湿性疾病所致的MAS进行鉴别,从临床表现及实验室检查方面,MAS、sJIA和HLH也有所区别[40],可参照表7进行初步鉴别。

sJIA、MAS和HLH的临床和实验室特点比较
Clinical and laboratory features of sJIA,MAS and HLH
sJIA、MAS和HLH的临床和实验室特点比较
Clinical and laboratory features of sJIA,MAS and HLH
| 项目 | sJIA | MAS | HLH | |
|---|---|---|---|---|
| 基础疾病临床特点 | sJIA | sJIA等风湿病 | 血液病或遗传病 | |
| 热型 | 弛张高热 | 稽留热 | 稽留热 | |
| 皮疹 | 非固定性斑丘疹 | 丘疹,紫癜或瘀点 | 丘疹,紫癜或瘀点 | |
| 肝脾大 | + | +++ | +++ | |
| 淋巴结大 | + | +++ | ++ | |
| 关节炎 | + | + | - | |
| 浆膜炎 | + | + | - | |
| 脑病 | - | ++ | +++ | |
| 实验室检查特点 | 白细胞及中性粒细胞 | ↑↑ | ↓或减低趋势 | ↓↓ |
| 血红蛋白 | 正常或降低 | ↓或减低趋势 | ↓↓ | |
| 血小板 | ↑↑ | ↓或减低趋势 | ↓↓ | |
| 红细胞沉降率 | ↑↑ | 正常或突然↓ | 通常较低 | |
| 胆红素 | 正常 | 正常或↑ | 正常或↑ | |
| ALT/AST | 正常或↑ | ↑↑ | ↑↑ | |
| PT | 正常 | ↑ | ↑↑ | |
| APTT | 正常 | ↑ | ↑↑ | |
| D-二聚体 | ↑ | ↑↑ | ↑↑ | |
| 纤维蛋白原 | ↑ | ↓ | ↓↓ | |
| 铁蛋白 | 正常或↑ | ↑↑ | ↑↑↑ | |
| sCD25 | 正常或↑ | ↑↑ | ↑↑↑ | |
| CD163 | 正常或↑ | ↑↑ | ↑↑↑ | |
| 骨髓噬血现象 | +/- | ++ | +++ |
注:sJIA:全身型幼年特发性关节炎;MAS:巨噬细胞活化综合征;HLH:噬血细胞性淋巴组织细胞增生症;ALT:谷丙转氨酶;AST:谷草转氨酶;PT:凝血酶原时间;APTT:活化部分凝血活酶时间 sJIA:systemic juvenile idiopathic arthritis;MAS:macrophage activation syndrome;HLH:hemophagocytic lymphohistiocytosis;ALT:alanine aminotransferase;AST:aspartate aminotransferase;PT:prothrombin time;APTT:activated partial thromboplastin time
MAS早期有效治疗是抢救生命的关键。早期治疗可以有效控制或缓解炎性反应进程,显著改善sJIA合并MAS预后[41,42]。快速控制炎症风暴是MAS治疗的关键。治疗方案包括一般治疗、免疫抑制剂及生物制剂治疗。
包括维持电解质酸碱平衡,纠正凝血功能紊乱,纠正多器官功能衰竭状态,积极预防或控制感染等。感染是MAS发生的常见触发因素,合并MAS的患儿应在开始治疗的同时或之前进行感染评估和治疗。
sJIA合并MAS时,细胞因子成瀑布式释放,导致剧烈的炎性反应,故推荐大剂量甲泼尼龙冲击治疗,快速抗炎。单次剂量为20~30 mg/(kg·d),最大剂量为1 g/d,冲击疗程为3~5 d,必要时需进行第二轮冲击治疗,以达到抢救生命的目的。病情控制后可改为泼尼松足量口服,病情一旦得到控制,则尽快减量激素[43],减量方案参见sJIA部分。
除应用糖皮质激素外,MAS治疗需联合应用CsA[44]。CsA可通过抑制巨噬细胞和T淋巴细胞而达到治疗目的,可减少糖皮质激素的用量、快速控制MAS的炎症反应[45]。用法为静脉滴注或口服,常用剂量为3~5 mg/(kg·d),每天1次,静脉滴注,最大剂量不超过150 mg/d,病情控制,患儿疾病稳定后,可改为口服治疗2~3 mg/(kg·d),每天分2次口服。应用CsA治疗后,患儿可出现高眼压、高血压、皮肤多毛、牙龈增生伴色素沉着;需定期查血常规和肝功能、血压、眼压和血药浓度(谷浓度)。建议首剂后48 h监测,此后依据血药浓度水平和全身炎症水平调整药物浓度监测周期。
根据2021年ACR关于sJIA合并MAS的治疗建议,推荐在sJIA活动期尽早、合理使用生物制剂,有助于预防MAS,减少糖皮质激素用药剂量[46,47]。但对于已经发生MAS的患儿,生物制剂的治疗时机仍需慎重把握,以免加重MAS的症状。在MAS活动期,以尽快控制炎症反应,减少细胞因子大量释放为主要目的,故需应用大剂量激素冲击尽快抗炎,抢救生命。在全身炎症得到控制,合并MAS的风险度降低时,可考虑尽早应用生物制剂治疗。
IL-1拮抗剂阿那白滞素[48],可在疾病MAS早期作为一线治疗,有效控制MAS的进展,目前国内尚未上市,用法参见sJIA部分。
目前国内已上市的IL-6拮抗剂为托珠单抗,可联合常规治疗(泼尼松、甲泼尼龙或联合MTX、CsA等免疫抑制剂)用于sJIA合并MAS患儿的缓解期治疗,有助于控制全身炎症反应,利于激素减量。值得注意的是,托珠单抗作为一种大分子生物靶向药,不能用于MAS疾病初期及高全身炎症反应期。必须在大剂量糖皮质激素抗炎有效前提下,联合应用托珠单抗才有助于改善全身炎症反应、降低炎性指标[49,50],有助于激素减量。
其他有潜在治疗前景的生物靶向药物包括IL-18结合蛋白(Tadekinig Alfa),目前正在进行治疗MAS的Ⅲ期临床试验;依玛鲁单抗(Emapalumab),一种结合和中和IFN-γ的单克隆抗体,可用于成人和儿童(新生儿和老年人)患有HLH的患者[51],另报道JAK-STAT通路抑制剂托法替布和芦可替尼对一些MAS病例有效。
难治性MAS可考虑应用依托泊苷(Etoposide,VP-16)治疗,详见中国噬血细胞综合征诊断与治疗指南(2022年版)[52]。
MAS是严重威胁生命的并发症,其预后取决于早期诊断和早期治疗。出现中枢神经系统受累、肺出血、低血容量休克等情况病死率高,及时控制炎症风暴,把握正确的治疗时机及药物选择,长期规律随访及慢病管理是改善预后的关键。
(檀晓华 邓江红 张俊梅 李彩凤 执笔)
参与本共识讨论、制定的专家(按姓氏拼音排序):曹兰芳(上海交通大学医学院附属仁济医院);陈同辛(上海交通大学医学院附属上海儿童医学中心);陈雨青(安徽省儿童医院);邓江红(国家儿童医学中心,首都医科大学附属北京儿童医院);封其华(苏州大学附属儿童医院);韩梅(大连市儿童医院);金燕樑(上海交通大学医学院附属上海儿童医学中心);李彩凤(国家儿童医学中心,首都医科大学附属北京儿童医院);李亚蕊(山西省儿童医院);李玉峰(上海交通大学医学院附属新华医院);李志辉(湖南省儿童医院);廖亚彬(昆明市儿童医院);刘小惠(江西省儿童医院);刘翠华(郑州大学附属儿童医院,河南省儿童医院,郑州儿童医院);卢美萍(浙江大学医学院附属儿童医院);孙利(复旦大学附属儿科医院);檀晓华(国家儿童医学中心,首都医科大学附属北京儿童医院);尹薇(武汉妇女儿童医院);张洪霞(山东大学齐鲁儿童医院);张俊梅(国家儿童医学中心,首都医科大学附属北京儿童医院);郑雯洁(温州医科大学附属第二医院);周志轩(首都儿科研究所附属儿童医院)
所有作者均声明不存在利益冲突



























