
生长板(软骨组织)是骨骼发育、线性生长的关键,但随着青春期进展,生长板的增殖能力将不断耗竭,最终骨生长板闭合。在骨生长过程中,有多种调节因子通过不同的机制调节软骨细胞增殖、分化。其中,内分泌调节(生长激素、胰岛素样生长因子、甲状腺素、性激素、糖皮质激素等)、转录因子通过系统调节对生长板调控起重要作用。局部调节因子,如印第安刺猬蛋白及甲状旁腺素相关肽、骨形成发生蛋白、成纤维细胞生长因子等也对生长板调控起一定作用。现就影响软骨细胞增殖分化调控的机制进行概述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
生长板是位于骨骺和骨干间的软骨组织,是骨纵向生长的主要分化区域,主要由软骨细胞和细胞外基质组成[1]。由于骨生长板软骨的不断成熟,为骨质沉积提供支架,因此骨生长板功能受损或提前闭合会导致儿童身材矮小、肢体长度不协调及骨骼发育异常。目前已发现多种激素受体,如雌激素、生长激素(GH)和糖皮质激素受体在生长板的软骨细胞内或细胞表面表达,表明这些激素可能直接影响生长板生长。此外许多生长因子,如胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、成纤维细胞生长因子(fibroblast growth factors,FGF)、骨形态发生蛋白(bone morphogenetic proteins,BMP)、血管内皮生长因子(vascular endothelial growth factor,VEGF)均在软骨增殖和分化中起重要作用。基于这些因素,对软骨发育不全患儿提供一些有针对性的管理可增加获得身高的可能性。现就影响软骨细胞增殖分化调控的机制做一概述。
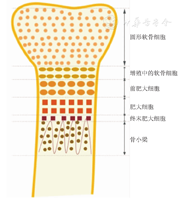
根据软骨细胞的形态可将骨生长板分为静息区、增殖区、前肥大区、肥大区和终末区(图1)。幼年时期,软骨的增生、退化与新骨生成的速率保持平衡,从而保证了在骨干长度增加的同时,生长板能够保持一定的厚度。随着年龄增长,青春期儿童生长板内软骨细胞的增殖潜能逐渐耗竭,当软骨增殖与成骨活性中止,生长板完全骨化,即生长板静息时,骨的纵向生长也随之停止,生长板总高度缩小,最终发生融合。软骨生长与分化过程受到全身因素与局部因素的调控。

在生长板上发挥驱动作用的内分泌信号包括胰岛素、GH-IGF-1轴、四碘甲状腺原氨酸(T4)和三碘甲状腺原氨酸(T3)轴、雄激素、雌激素、维生素D、糖皮质激素等,可能还有瘦素,构成一个极其复杂的系统。
GH-IGF-1轴是促进长骨生长的决定因子。下丘脑分泌的生长激素释放激素(growth hormone releasing hormone,GHRH)和生长抑素(somatostatin,SS),调控垂体前叶释放GH,GH进入血液循环与GHRH结合并运送至相应的靶器官,并通过与生长激素受体(growth hormone receptor,GHR)结合,进而刺激肝脏和生长板合成及分泌IGF-1。脑垂体分泌的GH结合外周组织中的GHR,使受体二聚化并激活Janus激酶2 (JAK2)。JAK2可以磷酸化信号转导和转录激活蛋白(STAT)家族蛋白,使之入核并激活下游基因的表达。另外,GH也可通过不依赖于IGF-1的方式调节长骨生长[2]。
雌激素是调控骨骼生长和稳态的重要内分泌因子。青春期时,雌激素的分泌可进一步激活GH-IGF-1轴。其中,低水平的17β-雌二醇(estradiol,E2)对于青春期长骨生长是必不可少的,但高水平的E2会在青春期晚期导致生长板闭合、长骨停止生长,最终导致成年身高低于预期。雌激素受体(estrogen receptor,ER)有2个亚型:ERα与ERβ[3],均表达于生长板的静息区、增殖区与肥大区,因此,雌激素也可能直接调控生长板的生长与闭合。小鼠模型研究发现,雌激素主要通过ERα发挥调节骨生长的作用。ERβ在雌鼠骨生长中起抑制作用,在雄鼠中的功能尚不明确[4]。
雄激素也间接参与骨生长调节。循环中的雄激素可在芳香化酶的催化下不可逆地转化为雌激素,进而间接发挥作用[5];此外,雄激素本身也可能刺激纵向骨生长[6]。双氢睾酮可使男童出现线性生长加速,且与GH或IGF-1的增多无关[7]。这些非GH依赖的调控表明雄激素对生长板软骨细胞可能存在直接作用,且大鼠和人的生长板中均有雄激素受体表达。此外,有研究显示,双氢睾酮在体外实验中可促进软骨细胞增殖和蛋白多糖合成,睾酮也可通过增加局部的IGF-1来刺激软骨细胞增殖[7]。
甲状腺素可刺激生长板静止区细胞向增殖区细胞转化,并促进生长板中软骨细胞分化。甲状腺素可直接上调WNT4和WNT/β-catenin信号通路,也可通过刺激IGF-1产生间接诱导WNT4的表达,还可通过甲状腺素受体α1发挥作用。另外,甲状腺素涉及多种信号转导途径的非基因组作用。因此,甲状腺素对于协调软骨内骨化至关重要,可控制软骨细胞成熟和软骨基质合成,矿化和降解[8],甲状腺功能减退可导致生长停滞、骨骺发育不良及骨龄延迟[9] 。
SOX9属于带有特征性高迁移率族蛋白(HMG)-DNA结合域的转录因子家族(SOX基因家族)。SOX9是主调控因子,且在软骨细胞发生及分化的每个阶段发挥作用[14]。SOX9基因突变可致严重骨骼发育不良及短指发育不良[15]。SOX家族成员SOX5和SOX6与SOX9共同促进软骨组织特异性基因Ⅱ型胶原α1(COL2A1)和蛋白聚糖(Aggrecan,ACAN)的表达[16]。因此,SOX9是软骨细胞的决定因子。
RUNX1通过转录诱导COL2A1增强软骨分化,并抑制肥大分化。另外,RUNX1通过与SOX蛋白结合促进基质产生,且部分通过Bapx1诱导抑制肥大分化,从而有助于保护关节软骨[17]。RUNX2是软骨细胞肥大的促进因子。研究发现,Runx2在小鼠软骨细胞肥大中发挥重要作用[18]。同时,骨膜细胞中的RUNX2也通过调节FGF18表达进而调节软骨细胞分化[19]。
HDAC4能抑制肌细胞增强因子2(MEF2)家族转录因子MEF2C的活性。MEF2C表达于前肥大细胞与肥大细胞。MEF2C失活会抑制软骨细胞肥大,过渡激活则会引起提前肥大。在斑马鱼研究中,Hdac4突变使得Mef2c上调,促进Runx2的表达来促进软骨骨化[20]。
SHOX与生长缺陷和骨骼畸形有关,是软骨发育相关的重要基因,为人类矮小症表现型基因。在特发性矮小症患者中,2%~15 %有SHOX基因突变[21]。SHOX基因纯合突变与Langer肢中部骨发育不良相关,而SHOX基因杂合突变或缺失可导致轻度骨骼发育不良[22]。
NF-κB p65在生长板上表达,依靠诱导软骨细胞增殖和分化以及减少凋亡来促进长骨生长,此外,还可介导GH和IGF-1对长骨生长的促进作用[23]。核因子κB抑制蛋白(IκBα)基因发生杂合性功能缺失突变可导致GH不敏感、生长衰竭及外胚层发育不良和免疫缺陷[24]。
CDC42突变可导致软骨内成骨缺陷。研究显示,肢体前成骨细胞中CDC42消融或体外敲除CDC42对成骨细胞分化无明显影响。但间充质祖细胞中CDC42丢失导致丝裂原活化蛋白激酶p38和信号传导蛋白Smad1/5显著失活。此外,CDC42位于p38和蛋白激酶B上游,分别激活Smad1/5和SOX9,进而诱导软骨形成中软骨细胞的差异表达[25]。
FOXO是参与多种细胞类型分化的转录因子。Ⅱ型胶原Col2-Cre-Foxo1敲除小鼠和Col2-Cre-Foxo1,3,4敲除小鼠出现生长板畸形,说明FOXO调控软骨分化。FOXO1的表达随着软骨分化而增加,FOXO1抑制将会影响软骨细胞的分化。在一些细胞研究中发现,FOXO1的表达和活性是由在软骨分化中起关键作用的转化生长因子1(TGF1)促进[26]。
脂肪来源的间充质干细胞(MSC)具有较高的软骨分化能力,ITGB1通过激活ERK信号通路促进脂肪源MSC软骨分化[27]。ITGB1基因过表达显著增加了COL2A1、ACAN和SOX9的表达,但抑制了Ⅰ型胶原α1链的表达。
FSTL1通常在MSC和软骨细胞中表达。FSTL1敲除后,小鼠MSC增殖能力降低,且造成软骨形成相关基因失调。此外FSTL1缺陷使软骨细胞外基质(extracellular matrix,ECM)中ACAN生成和Ⅱ型胶原表达减少。因此,FSTL1可能是软骨细胞增殖和ECM分子表达的调节剂[28]。
骨生长板中软骨细胞的成熟还受多种旁分泌和自分泌信号的调控。旁分泌因子由生长板中的软骨细胞分泌,有时也由周围软骨膜中的细胞分泌,局部作用于软骨细胞,调节其增殖和分化。目前已发现维持生长板正常功能所必需的多种旁分泌因子,包括甲状旁腺激素相关肽(parathyroid hormone related protein,PTHrP)、印第安刺猬蛋白(Indian hedgehog,IHH)、FGF、BMP、WNT蛋白和C型利钠肽(C-type natriuretic peptide,CNP)及利钠肽受体(natriuretic peptide receptor,NPR)通路。
PTHrP高表达于软骨膜细胞且低表达于关节周围的肥大细胞,其受体(PTHR1)低表达于增殖中的软骨细胞,但高表达于正在成熟的软骨细胞。研究表明,甲状旁腺激素(parathyroid hormone,PTH)信号可抑制骨生长板中软骨细胞肥大。PTHR1功能缺失引起的Blomstrand骨软骨发育异常会导致骨骼提前成熟、长骨缩短和骨密度增高[35],而PTHR1功能获得性突变会引起Jansen软骨发育异常病[36]。
PTHrP在关节周围的表达又受到Hedgehog信号的调控。IHH表达于尚未肥大及早期肥大的软骨细胞,并激活增殖区的软骨细胞和软骨膜细胞中的Hedgehog信号,进而诱导关节面软骨细胞分泌PTHrP,同时刺激其分泌BMP。而PTHrP进一步抑制生长板静止区的幼稚软骨细胞向肥大区软骨细胞分化,从而纵向增加软骨增殖柱的长度。PTHrP和IHH这2个旁分泌因子在生长板内形成一个负反馈回路,调节软骨细胞的增殖和成熟[37]。
FGF信号也调控骨生长板的发育。FGF信号的配体FGF9与FGF18均表达于软骨细胞周围的软骨膜中,这2种配体均可在体外激活FGF受体3(FGFR3)[38]。FGFR3是生长板软骨形成的负调控因子,表达于骨生长板增殖区及肥大区的软骨细胞,其突变会导致软骨发育不全。FGF可通过FGFR3激活丝裂原活化蛋白激酶(MAPK)和Janus激酶信号转导和转录激活因子(JAK/STAT)通路,负调控生长板增殖区域软骨细胞的增殖,加速肥大软骨细胞分化,进而导致生长发育异常。还可与其他旁分泌因子相互作用,包括下调IHH表达,与CNP、BMP信号通路相互作用。
BMP信号通过调节软骨细胞的增殖和分化,对软骨内成骨至关重要。SOX9的表达受BMP信号通路调控。结合有BMP的骨移植物可增加骨缺损中软骨细胞的增殖,BMP2可延迟肥大区软骨细胞的终末期分化,相反,BMP的抑制剂Noggin可阻断骨缺损中软骨细胞的增殖并加速肥大区软骨细胞的终末期分化[39]。BMP2还可促进软骨内成骨,可自发诱导软骨分化、成骨分化和软骨内骨形成[40]。
WNT信号通路调控软骨细胞分化和软骨发育。Wnt5a、Wnt5b均表达于增殖区与肥大区交界处的软骨细胞。Wnt5a缺陷型小鼠呈软骨细胞肥大延迟,而Wnt5a或Wnt5b过度表达也会引起软骨细胞肥大延迟,Wnt5a和Wnt5b通过调节细胞周期蛋白D1和p130的表达以及软骨细胞特异性Col2a1的表达来协调软骨细胞的增殖和分化[41]。
ECM是由软骨细胞合成并分泌到细胞外、分布在细胞表面或细胞之间的大分子,富含胶原蛋白和蛋白聚糖。生长板中的ECM不仅起支持作用,还与旁分泌信号分子相互作用,调节软骨细胞的增殖和分化。
聚集蛋白多糖由ACAN基因编码,是生长板ECM中主要的蛋白聚糖成分,具有关键的结构和功能作用。多数具有ACAN突变的患儿身材矮小,骨龄超前、早期生长停滞、成年身高低和身体比例失调、ACAN杂合突变为儿童功能性躯体症状病因,表现出骨骼成熟加速、早发性骨关节炎。在20多个常染色体线性矮身材家族中发现ACAN基因突变者逾100例[44]。在小于胎龄儿、特发性矮小患儿中可见ACAN基因缺陷。
易洛魁族同源盒3(Iroquois homeobox3,IRX3)是一种IRX基因家族的转录因子,其表达随软骨细胞终末分化逐渐增加,与SOX9的表达相互作用,并在BMP2作用下促进MSC的软骨分化。IRX3作为MSC软骨形成因子,与BMP2介导的信号通路协同,并独立于SOX9介导的转录机制调控软骨形成[45]。
生长板软骨细胞的功能活动及骨的正常发育与成熟也会受到各种生物力学刺激的影响。相关研究发现,受负重应力的关节其骺板软骨细胞的增殖分化较明显,且应力影响细胞增殖分化,与细胞PTHrP表达水平的升高密切相关[46]。另有研究发现短期循环应力作用会诱导生长板前肥大和肥大区软骨细胞表达PTHrP,进而影响生长板的发育[47]。
综上,软骨细胞增殖和分化在内分泌、表观遗传学及旁分泌等层面受调节(图2)。生长板功能障碍在病因学上可能是由环境或基因缺陷造成的,在软骨发育不全患儿的鉴别诊断中应考虑基因缺陷的影响(表1)。
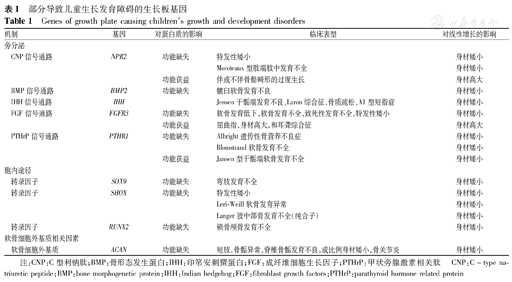
部分导致儿童生长发育障碍的生长板基因
Genes of growth plate causing children′s growth and development disorders
部分导致儿童生长发育障碍的生长板基因
Genes of growth plate causing children′s growth and development disorders
| 机制 | 基因 | 对蛋白质的影响 | 临床表型 | 对线性增长的影响 | |
|---|---|---|---|---|---|
| 旁分泌 | |||||
| CNP信号通路 | NPR2 | 功能缺失 | 特发性矮小 | 身材矮小 | |
| Moroteaux型肢端肢中发育不全 | 身材矮小 | ||||
| 功能获益 | 伴或不伴骨骼畸形的过度生长 | 身材高大 | |||
| BMP信号通路 | BMP2 | 功能缺失 | 髋臼软骨发育不良 | 身材矮小 | |
| IHH信号通路 | IHH | Jensen干骺端发育不良,Laron综合征,骨质疏松,A1型短指症 | 身材矮小 | ||
| FGF信号通路 | FGFR3 | 功能缺失 | 软骨发育低下,软骨发育不全,致死性发育不全,特发性矮小 | 身材矮小 | |
| 功能获益 | 屈曲指,身材高大,和耳聋综合征 | 身材高大 | |||
| PTHrP信号通路 | PTHR1 | 功能缺失 | Albright遗传性骨营养不良症 | 身材矮小 | |
| Blomstrand软骨发育不全 | 身材矮小 | ||||
| 功能获益 | Jansen型干骺端软骨发育不全 | 身材矮小 | |||
| 胞内途径 | |||||
| 转录因子 | SOX9 | 功能缺失 | 弯肢发育不全 | 身材矮小 | |
| 转录因子 | SHOX | 功能缺失 | 特发性矮小 | 身材矮小 | |
| Leri-Weill软骨发育异常 | 身材矮小 | ||||
| Langer肢中部骨发育不全(纯合子) | 身材矮小 | ||||
| 转录因子 | RUNX2 | 功能缺失 | 锁骨颅骨发育不全 | 身材矮小 | |
| 软骨细胞外基质相关因素 | |||||
| 软骨细胞外基质 | ACAN | 功能缺失 | 短肢,骨骺异常,脊椎骨骺发育不良,成比例身材矮小,骨关节炎 | 身材矮小 | |
注:CNP:C型利钠肽;BMP:骨形态发生蛋白;IHH:印第安刺猬蛋白;FGF:成纤维细胞生长因子;PTHrP:甲状旁腺激素相关肽 CNP:C-type na-triuretic peptide;BMP:bone morphogenetic protein;IHH:Indian hedgehog;FGF:fibroblast growth factors;PTHrP:parathyroid hormone related protein
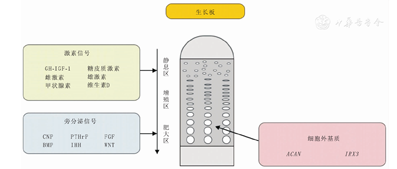

注:GH:生长激素;IGF-1:胰岛素样生长因子-1;CNP:C型利钠肽;PTHrP:甲状旁腺激素相关肽;FGF:成纤维细胞生长因子;BMP:骨形态发生蛋白;IHH:印第安刺猬蛋白;ACAN:蛋白聚糖;IRX3:易洛魁族同源盒3 GH:growth hormone;IGF-1:insulin-like growth factor-I;CNP:C-type natriuretic peptide;PTHrP:parathyroid hormone related protein;FGF:fibroblast growth factors;BMP:bone morphogenetic protein;IHH:Indian hedgehog;ACAN:aggrecan;IRX3:iroquois homeobox 3
生长板的发育时间是决定身高的限制因素。除常见的GH-IGF-1轴病变外,有多方面因素可能引起身材矮小。随着临床医师对生长板增殖与分化调控机制的深入认识以及精准医疗的不断发展,未来可从基因组学、蛋白质组学等多角度来探究生长板相关调控机制,以期对生长异常相关疾病进行早期诊断、个体化治疗与监测,进而帮助患者获得理想成年身高。
所有作者均声明不存在利益冲突



























