
分析北京地区猩红热样红斑患儿咽拭子分离的A族链球菌(GAS)的基因特征。
回顾性研究。收集2019年6月至2020年2月在首都医科大学附属北京儿童医院皮肤科就诊的猩红热样红斑患儿咽部GAS分离株,采用PCR和测序检测菌株emm基因分型和超抗原基因(speA、speB、speC、speF、speG、speH、speI、speJ、speK、speL、speM、ssa和smeZ)。组间比较采用χ2检验或Fisher′s确切概率法。
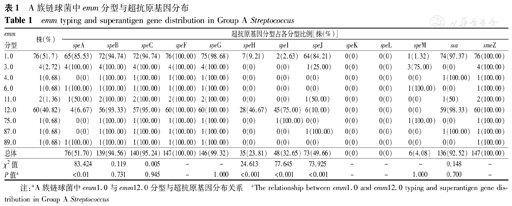
共收集147株GAS菌株,emm型别主要为emm1.0型76株(51.70%)和emm12.0型60株(40.82%),其他7种emm型的菌株均少于5株。speF、smeZ、speG、speC、speB和ssa的检出率高,分别为100.00%(147/147株)、100.00%(147/147株)、99.32%(146/147株)、95.24%(140/147株)、94.56%(139/147株)、92.52%(136/147株),speA、speJ、speI、speH和speM检出率低,分别为51.70%(76/147株)、49.66%(73/147株)、32.65%(48/147株)、23.81%(35/147株)和4.08%(6/147株),未检测到speK及speL。emm1.0型菌株speA和speJ的携带率[85.53%(65/76株)、84.21%(64/76)株]明显高于emm12.0型[6.67%(4/60株)、10.00%(6/60株)],而speH和speI的携带率[9.21%(7/76株)、2.63%(2/76株)]明显低于emm12.0型[46.67%(28/60株)、75.00%(45/60株)],差异均有统计学意义(均P<0.001)。
北京地区猩红热样红斑患儿咽部分离的GAS菌株以emm1.0和emm12.0型为主,emm1.0更多见;菌株emm与携带超抗原基因谱存在相关性,emm1.0型菌株1型超抗原基因谱携带率显著高于emm12.0型,而后者2、3、4型超抗原基因谱携带率显著高于前者。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
猩红热样红斑为一种急性全身性或局限性皮疹,多伴发热、咽喉痛等前驱症状。典型临床表现为面、颈、躯干对称分布、均匀一致的沙皮样丘疹,基底呈猩红色,压之色褪,尤以双上睑内侧及甲周皮疹最具特点,疹退后面部及躯干可出现糠秕状脱屑及手指、足趾端大片脱皮,严重出现袜套样脱皮。但因缺乏典型帕氏线、口周苍白圈、化脓性扁桃体炎及全身中毒等表现,不满足猩红热的诊断。大部分患儿一般情况较好,全身症状较猩红热轻,少部分患儿在2~3周可出现肾小球肾炎和急性风湿热等合并症。此类患儿多在皮肤科就诊。既往研究表明,A族链球菌(Group A Streptococcus,GAS)是部分临床诊断的猩红热和猩红热样红斑的共同病原体,这些患者可能是猩红热的传染源,导致猩红热疫情的传播和扩散[1]。猩红热是我国乙类传染病,严重威胁儿童及青少年健康,对猩红热分离的GAS的超抗原(superantigens,SAgs)及emm基因型已有较多研究[2,3],对猩红热样红斑GAS的研究报道较少。本研究收集猩红热样红斑患儿咽部分离的GAS菌株,回顾性研究其emm基因分型及SAgs携带情况及其之间相关性,并结合前期研究和文献报告评估猩红热样红斑与猩红热的GAS基因特征异同。
选择2019年6月至2020年2月在首都医科大学附属北京儿童医院皮肤科门诊就诊的具有猩红热样红斑表现的患儿,伴或不伴发热、咽痛等症状,进行咽拭子培养。采集咽拭子在常温2 h内送至皮肤疾病研究室进行细菌分离培养和鉴定,获得GAS菌株。本研究通过医院医学伦理委员会批准[批准文号:(2022)-E-197-R],并豁免知情同意。
将咽拭子标本接种于脱纤维羊血琼脂平板上。在含50 mL/L二氧化碳的37 ℃恒温箱中孵育18~24 h。观察菌落形态及溶血现象。挑选β溶血的透明、表面光滑、圆形突起小菌落进行分纯培养。采用乳胶凝集链球菌分群试剂盒(赛默飞,英国)鉴定出A群。将分纯与鉴定的GAS菌株收集到冻存管中,置-80 ℃冰箱备用。
采用天根生化科技(北京)有限公司细菌基因组DNA提取试剂盒说明书操作,提取GAS的DNA,置-20 ℃冰箱备用。
按照美国疾病预防控制中心(CDC)(https://www2a.cdc.gov/ncidod/biotech/strepblast.asp)的方法进行,提取DNA,PCR产物纯化、测序后,将序列与https://www2.cdc.gov/vaccines/biotech/strepblast.asp网站中的数据比对,确定emm基因分型。
采用PCR扩增11种SAgs(speA、speC、speG、speH、speI、speJ、speK、speL、speM、ssa和smeZ)以及蛋白质-链球菌半胱氨酸蛋白酶(speB)和有丝分裂因子(speF)。PCR反应体系(25 μL)含20 mmol DNA模板1 μL,10 mmol上、下游引物各1 μL(由北京天一辉远生物科技有限公司合成),12.5 μL的Taq PCR Mix和9.5 μL双蒸水。PCR反应条件为94 ℃预变性1 min,94 ℃变性1 min,退火30 s(温度为每个引物相应的退火温度),72 ℃延伸30 s,共30个循环,最后72 ℃延伸5 min。毒力因子基因的引物序列参照文献报道[4,5]。取PCR扩增后产物4 μL,在含GoldView核酸染色剂的20 g/L琼脂糖凝胶上,0.5×TBE缓冲液中,120 V电泳分离30 min,进行可视化和图像采集。
采用SPSS 20.0软件对数据进行统计学分析,数据采用率和构成比描述,组间比较采用χ2检验或Fisher′s确切概率法,P<0.05为差异有统计学意义。
共分离到147株GAS菌株。在147例患儿中,男98例(66.67%),女49例(33.33%);年龄(6.2±1.9)岁(2岁4个月~12岁5个月),其中≤3岁5例(3.40%),>3~6岁65例(44.21%),>6~12岁75例(51.02%),>12岁2例(1.36%)。
147株GAS中包括9种emm分型,其中最多的为emm1.0型76株(51.70%),其次为emm12.0型60株(40.82%),余7种emm分型的菌株均少于5株。SAgs基因speF、smeZ、speG、speC、speB和ssa的检出率分别为100.00%(147/147株)、100.00%(147/147株)、99.32%(146/147株)、95.24%(140/147株)、94.56%(139/147株)、92.52%(136/147株),speA、speJ、speI、speH和speM检出率分别为51.70%(76/147株)、49.66%(73/147株)、32.65%(48/147株)、23.81%(35/147株)和4.08%(6/147株),未检测到speK及speL。结果见表1。
A族链球菌中emm分型与超抗原基因分布
emm typing and superantigen gene distribution in Group A Streptococcus
A族链球菌中emm分型与超抗原基因分布
emm typing and superantigen gene distribution in Group A Streptococcus
| emm分型 | 株(%) | 超抗原基因分型占各分型比例[株(%)] | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| speA | speB | speC | speF | speG | speH | speI | speJ | speK | speL | speM | ssa | smeZ | ||
| 1.0 | 76(51.7) | 65(85.53) | 72(94.74) | 72(94.74) | 76(100.00) | 75(98.68) | 7(9.21) | 2(2.63) | 64(84.21) | 0(0) | 0(0) | 1(1.32) | 74(97.37) | 76(100.00) |
| 3.0 | 4(2.72) | 4(100.00) | 4(100.00) | 4(100.00) | 4(100.00) | 4(100.00) | 0(0) | 0(0) | 1(25.00) | 0(0) | 0(0) | 3(75.00) | 0(0) | 4(100.00) |
| 4.0 | 1(0.68) | 0(0) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 1(100.00) | 1(100.00) |
| 6.0 | 1(0.68) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 1(100.00) | 0(0) | 1(100.00) |
| 11.0 | 2(1.36) | 1(50.00) | 2(100.00) | 2(100.00) | 2(100.00) | 2(100.00) | 0(0) | 0(0) | 1(50.00) | 0(0) | 0(0) | 0(0) | 1(50) | 2(100.00) |
| 12.0 | 60(40.82) | 4(6.67) | 56(93.33) | 57(95.00) | 60(100.00) | 60(100.00) | 28(46.67) | 45(75.00) | 6(10.00) | 0(0) | 0(0) | 0(0) | 59(98.33) | 60(100.00) |
| 75.0 | 1(0.68) | 0(0) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 0(0) | 1(100.00) | 0(0) | 0(0) | 0(0) | 1(100.00) | 0(0) | 1(100.00) |
| 87.0 | 1(0.68) | 0(0) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 0(0) | 0(0) | 1(100.00) | 0(0) | 0(0) | 0(0) | 1(100.00) | 1(100.00) |
| 89.0 | 1(0.68) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 1(100.00) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 1(100.00) |
| 总体 | 76(51.70) | 139(94.56) | 140(95.24) | 147(100.00) | 146(99.32) | 35(23.81) | 48(32.65) | 73(49.66) | 0(0) | 0(0) | 6(4.08) | 136(92.52) | 147(100.00) | |
| χ2值 | 83.424 | 0.119 | 0.005 | - | - | 24.613 | 77.645 | 73.925 | - | - | - | 0.148 | - | |
| P值a | <0.01 | 0.731 | 0.945 | - | 1.000 | <0.001 | <0.001 | <0.001 | - | - | 1.000 | 0.700 | - | |
注:aA族链球菌中emm1.0与emm12.0分型与超抗原基因分布关系 aThe relationship between emm1.0 and emm12.0 typing and superantigen gene distribution in Group A Streptococcus
emm1.0型与emm12.0型菌株SAgs携带状况,speA和speJ在emm1.0型中携带率为85.53%(65/76株)和84.21%(64/76株),在emm12.0型中携带率为6.67%(4/60株)和10.00%(6/60株);speH和speI在emm12.0型中携带率为46.67%(28/60株)和75.00%(45/60株),在emm1.0型中携带率为9.21%(7/76株)和2.63%(2/76株),差异均有统计学意义(均P<0.001)。结果见表1。
所有菌株中SAgs基因携带最多为10个1株(0.68%),携带最少为5个3株(2.04%),携带8个SAgs基因的菌株最多,为77株(52.38%),其次为7个,共44株(29.93%),6个18株(12.24%)及9个4株(2.72%)。共检测到34种SAgs基因谱,其中最常见的为同时携带speA、speB、speC、speF、speG、speJ、ssa和smeZ,共50株,占34.01%;其次为speB、speC、speF、speG、speH、speI、ssa和smeZ,共22株,占14.97%。emm1.0型常见的SAgs基因谱中第1型最常见,共49株(98.00%),emm12.0型最常见的SAgs基因谱中第2、3和4型较常见,分别为22株(100.00%)、13株(100.00%)和10株(90.91%),emm1.0型和emm12.0型菌株1、2、3、4型SAgs基因谱的携带率比较差异均有统计学意义(均P<0.001)。结果见表2。

A族链球菌emm1.0、emm12.0与超抗原基因谱的关系
Relationship between emm1.0,emm12.0 and superantigen gene spectrum of Group A Streptococcus
A族链球菌emm1.0、emm12.0与超抗原基因谱的关系
Relationship between emm1.0,emm12.0 and superantigen gene spectrum of Group A Streptococcus
| 超抗原基因谱类型 | 株数 | speA | speB | speC | speF | speG | speH | speI | speJ | speK | speL | speM | ssa | smeZ | emm1.0(株) | emm12.0(株) | P值 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 50 | + | + | + | + | + | - | - | + | - | - | - | + | + | 49 | 0 | <0.001 |
| 2 | 22 | - | + | + | + | + | + | + | - | - | - | - | + | + | 0 | 22 | <0.001 |
| 3 | 13 | - | + | + | + | + | - | + | - | - | - | - | + | + | 0 | 13 | <0.001 |
| 4 | 11 | - | + | + | + | + | - | - | - | - | - | - | + | + | 0 | 10 | <0.001 |
| 5 | 7 | - | + | + | + | + | - | - | + | - | - | - | + | + | 5 | 1 | 0.141 |
| 6 | 6 | + | + | + | + | + | - | - | - | - | - | - | + | + | 5 | 1 | 0.141 |
| 7 | 4 | - | + | + | + | + | + | - | - | - | - | - | + | + | 3 | 1 | 0.421 |
| 8 | 3 | + | + | + | + | + | - | - | + | - | - | - | - | + | 2 | 0 | 1.000 |
| 9~34 | 31 | 12 | 12 | 0.523 |
GAS是儿童和青少年人群常见的致病菌,致病谱广,感染后临床表现形式多样,是造成全球儿童死亡的十大感染性疾病病原之一[5]。猩红热样红斑由于其临床症状不典型而未引起足够重视,成为潜在传染源,加重GAS的传播。
本研究中猩红热样红斑患儿的发病年龄多数为3~12岁,与既往研究报道一致[6];男童发病人数显著高于女童。Liu等[7]研究发现,男童感染GAS的风险高于女童,推测可能与男童比女童有更多的密切交流和较差的卫生习惯有关。
emm分型是GAS流行病学监测的重要内容,其分布因监测地区及时节、菌株来源等不同而有所差异。本研究结果发现,北京地区猩红热样红斑患儿GAS的emm分型以emm1.0为主,其次为emm12.0。吴双胜等[8]对北京地区猩红热的GAS研究发现以emm12.0为主,其次为emm1.0,本研究结果与之不同。2011年至2018年国家疾病预防控制中心数据显示,emm12.0型是我国猩红热流行的主要型别,emm1.0次之。本研究中emm1.0型的比例为51.70%,emm12.0的比例为40.82%,emm1.0超过了emm12.0成为主导基因型。彭晓旻等[9]研究发现,2011年至2014年北京儿童猩红热主导基因型由emm12.0逐渐向emm1.0转换,我国台湾地区Chiou等[10]学者及天津阴杰莹等[11]学者也有emm基因型转换的报道。You等[12]报道2011年至2018年北京地区GAS中emm分型的变化情况,emm12.0分型下降,emm1.0逐渐上升,需要更多关注由emm1.0型GAS引起的猩红热。在中国(上海、香港)及英国也有emm1.0型GAS引起的猩红热增长的报道[13,14,15]。对于emm1.0分型逐渐增高并超过emm12.0的原因,可能为既往emm12.0作为主导菌株流行时,人群对此型别的免疫力逐渐增加,形成对emm12.0群体免疫,而对于emm1.0型易感人群增加,emm1.0型逐渐成为主导基因型。Jaggi等[16]研究发现,儿童中emm分型与年龄分布有关,在3~6岁emm12.0型的检出率高,emm1.0型的检出率与年龄无相关性。对于emm主导基因型转换的周期及原因还需要进一步研究。此外,本研究发现emm1.0和emm12.0的SAgs基因谱存在较大差异,2种菌株的毒力差异是否与流行病学变化有关也值得深入研究。
本研究对13种毒力基因的检出率及共现性进行评估,发现在emm1.0和emm12.0基因分型中,speB、speC、speF、speG、ssa和smeZ的检出率均较高,在2种基因型中检出率无显著差异;speA和speJ在emm1.0型中检出率高,speH和speI在emm12.0型中检出率高,4种毒力基因在2组基因型之间的分布存在显著差异。SAgs分布与emm基因密切相关。既往研究中,speA和speJ在emm1.0型中检查率高,speH在emm12.0型检查率高,speK多在emm2.0和emm3.0型中检出[17,18],本研究结果与之一致。
本研究根据检测到的毒力基因,确定了34个基因型的分布,其中以speA、speB、speC、speF、speG、speJ、ssa和smeZ的阳性组合最常见,其次为speB、speC、speF、speG、speH、speI、ssa和smeZ的阳性组合。在emm1.0和emm12.0中,SAgs基因谱分布存在显著差异。本研究与马春娜等[19]关于北京地区GAS超抗原在emm1.0型和emm12.0型中最优势的基因谱研究结果类似,与彭晓旻等[9]对北京地区儿童病例GAS的SAgs基因谱研究结果一致。该研究结果表明,儿童咽部GAS在不同emm型中主要流行谱自2011年来未发生明显改变。本研究是新型冠状病毒肺炎疫情暴发流行之前对北京地区儿童GAS的数据分析,对疫情后时代GAS的emm分型及毒力因子的变迁有重要参考意义。
综上,猩红热样红斑患儿中分离到的GAS以emm1.0型为主导基因型,主要emm分型与SAgs基因谱存在相关性,猩红热样红斑与猩红热中GAS流行的超抗原基因谱一致。
所有作者均声明不存在利益冲突



























