
对1例接受双肺移植手术的囊性纤维化儿童的临床及基因资料进行回顾性分析,并探讨囊性纤维化肺移植的相关问题。患儿,女,6岁余第1次就诊于首都儿科研究所附属儿童医院呼吸内科,后诊断为囊性纤维化。多年来患儿反复因肺部感染加重住院治疗,临床症状无明显改善,营养不良进行性加重,于2019年10月(17岁1个月)行双肺移植手术,目前术后2年,临床症状明显改善,生活质量明显提高,未发生移植相关并发症。提示肺移植为囊性纤维化晚期肺疾病患儿有效的治疗手段。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
囊性纤维化(cystic fibrosis,CF)是一种常染色体隐性遗传的单基因病。CF患者会出现多系统受累,呼吸衰竭是其死亡主要原因。目前,肺移植仍是终末期CF患者的唯一最终治疗选择[1]。由于受多方面因素制约,儿童肺移植发展落后于成人,国内罕有CF患儿肺移植的报道。王胜飞等[2]于2020年首次报道1例行双肺移植治疗的10岁女性CF患儿。首都儿科研究所附属儿童医院呼吸科2009年7月收治1例CF女童,于2019年10月进行了双肺移植,目前术后2年余,本研究就该病例的治疗过程进行回顾性分析,并探讨儿童CF肺移植的相关问题。本研究通过首都儿科研究所附属儿童医院医学伦理委员会批准(批准文号:SHERLL2021013),患儿监护人知情同意。
患者,女,19岁3个月,出生2个月开始出现咳嗽,病初仅为单声咳,无痰,剧烈活动及晨起显著,期间曾间断予抗炎及雾化治疗,均无明显缓解;3岁余患儿咳嗽加重,呈阵发性连声咳,并出现白色泡沫样痰,间断予抗生素治疗效果欠佳,咳嗽渐加重;5岁余出现咳绿色痰块,当地医院肺泡灌洗液培养提示铜绿假单胞菌,予多种抗生素及雾化吸入治疗,无好转;6岁余患儿痰量较前明显增多,每日约20 mL,咳白色及黄绿色黏痰,为进一步诊治于2009年7月收入首都儿科研究所附属儿童医院住院治疗。患儿入院时6岁9个月,营养中等,呼吸稍促,双肺呼吸音粗,未闻及干湿性啰音,肝脾未触及,杵状指阳性。肺功能示通气功能未见明显异常,第1秒用力呼气容积(forced expiratory volume in one second,FEV1)104.9%,残气量/肺总量43.1%,均增高;胸部CT示双肺支气管壁增厚,散在多发支气管扩张,见"印戒征",部分支气管壁呈"串珠样"改变,双肺小叶结节及腺泡结节增多,散在磨玻璃影。支气管镜下可见大量白色黏稠分泌物附着管壁,经支气管镜黏膜活检病理提示支气管黏膜慢性炎症,鼻窦CT示副鼻窦炎,痰及肺泡灌洗液细菌培养提示铜绿假单胞菌、鲍曼不动杆菌感染。予抗炎治疗后病情有所好转出院。之后患儿因感染加重多次于本院及外院住院治疗,10岁时出现肝大,11岁完善食道pH值监测提示存在胃食管反流,加用奥美拉唑口服抑酸治疗。多次电子支气管镜可见气道大量黏稠分泌物附着,细菌培养提示铜绿假单胞菌、荧光假单胞菌、洛菲不动杆菌、克柔念珠菌、金黄色葡萄球等病原,先后予多种抗细菌及真菌药物治疗,效果欠佳,仍每日咳嗽、咳大量黄绿痰(>50 mL/d)。体型逐渐消瘦、营养不良,13岁出现血、尿淀粉酶升高,持续4个月余,但腹部增强CT及超声未见胰腺异常,基因检测提示CFTR基因c.3469-12T>G位点突变,汗液离子浓度114 mmol/L(正常值<60 mmol/L),便苏丹三染色阴性。予妥布霉素泵吸300 mg/次(2次/d),70 g/L盐水吸入治疗;16岁余因气胸住院,腹部增强CT示胰腺饱满,再次完善基因检测发现CFTR基因2个位点突变:p.Phe508del、c.3469-12T>G,汗液氯离子浓度39 mmol/L。考虑诊断为CF。
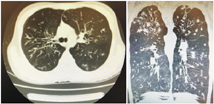
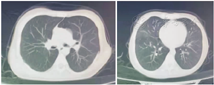
移植前1年患儿活动后胸闷、气促,需吸氧治疗,超声心动图提示三尖瓣反流、肺动脉压轻度增高,胸部CT(图1)示双肺支气管弥漫性扩张、管壁增厚,尤以上肺为著。移植前肺功能:FEV1 39.2%,用力肺活量(FVC)79.9%,呼气峰流速(PEF)59.1%。经评估,患儿反复出现呼吸道感染,FEV1<40%预测值,日间静息状态需氧疗,肺动脉压增高,符合肺移植手术适应证,无禁忌证,于2019年10月(17岁1个月)行双肺移植,术后病理示肺组织内广泛急慢性炎症细胞浸润,多发脓肿灶形成,炎症以支气管周显著,部分支气管腔内脓栓形成。肺组织局部纤维化明显。移植后9个月胸部CT示气管支气管通畅,右肺中叶少许炎性病灶,胸膜未见明显增厚(图2)。术后1年复查肺功能:FEV1 80%,最大肺活量(maximum vital capacity,VCMAX)86.6%,PEF 86.9%,一口气呼吸法肺一氧化碳弥散量(carbon monoxide diffusing capacity single breath method,DLCOSB)81.3%;术后1年9个月肺功能:FEV1 79%,VCMAX 88.4%,PEF 81.6%,DLCOSB 86.4%。至2022年3月,术后2年余,患儿身高166 cm,体重45 kg,无咳嗽、咳痰,活动正常,可爬海拔500余米的山,监测血氧饱和度正常,复查超声心动图正常,移植术后胸部CT示气管支气管通畅,右肺中叶少许炎症病灶,胸膜未见明显增厚。


抽取患儿(先证者)、父母外周血各2 mL,行全外显子基因检测。结果提示患儿CFTR基因复合杂合突变(图3)。第1个突变为7号染色体11号外显子整码突变c.1521_1523delCTT(p.Phe508del),来源于父亲,为白种人最常见的突变类型;第2个突变来自母亲,为内含子突变c.3469-12T>G,该位点暂未见相关文献报道,为新发突变,该位点dbscSNV_Ada Score值为0.999 75,dbscSNV_RF Score值为0.956,均>0.6,预测影响剪切,考虑为致病基因可能性大。


CF由CFTR基因突变所致。CFTR基因突变破坏氯离子分泌、钠重吸收和水运输,导致分泌物黏稠和纤毛清除减少,从而引起慢性呼吸道感染、细菌长期定植、支气管扩张,最终导致呼吸衰竭[3,4]。随着CF的诊断和治疗手段不断更新,患儿存活期较前大大延长。根据2012年美国囊性纤维化基金会统计数据,CF患者的预期寿命已从1938年首次描述该疾病时的不足2年到目前的41.1岁[5]。但晚期CF肺病(advanced CF lung disease,ACFLD)仍很常见,是最常见的死亡原因。囊性纤维化基金会患者登记处数据显示,18%的30岁患者FEV1低于40%,45岁患者接近25%。ACFLD与生活质量降低、临床症状恶化、病情加重等密切相关[6]。当临床考虑存在ACFLD时,预示疾病进一步恶化,需调整治疗策略,包括考虑进行肺移植。
如临床表现提示病情加速恶化,早期升级治疗也可能有益。这些临床表现包括:频繁出现肺病加重、FEV1迅速下降、运动或睡眠时需氧疗、营养不良恶化、难治性病原体感染、CF相关糖尿病、气胸以及大咯血需入住重症监护室(ICU)或行支气管动脉栓塞术。本例患儿出生2个月出现咳嗽,反复呼吸道感染、支气管扩张,存在慢性肺疾病、鼻窦炎,后期出现胰腺增大,病程中曾有较长时间出现血尿淀粉酶增高,汗液离子浓度明显升高,基因检测提示存在2个CFTR突变位点,依据囊性纤维化基因会的诊断标准[7],患儿汗液氯离子浓度虽未达60 mmol/L以上,但汗液氯离子测试本身受多种因素影响,且新发突变位点考虑影响剪切,因此,综合考虑诊断患儿为CF。患儿频繁出现感染加重住院治疗,营养不良进行性加重,移植前1年出现轻度肺动脉高压,FEV1<40%,符合ACFLD。
我国接受肺移植儿童的病种与国外有很大不同,国外5岁以上儿童以CF为主,1~5岁儿童以肺动脉高压最为常见,婴儿多见于肺动脉高压和肺表面活性物质缺乏。我国18例儿童肺移植受者中,8例为特发性肺动脉高压,其他原发病包括骨髓移植后闭塞性细支气管炎、间质性肺疾病及双侧支气管扩张等[8]。这与CF在我国为罕见病有关,但近些年随着儿科医师对CF的认识以及基因检测、汗液检测技术的开展,越来越多的CF病例被报道,CF患儿接受肺移植的病例也开始出现,相信今后会有更多的CF患儿接受肺移植手术获得新生。
研究表明,ACFLD患者移植后的生活质量和生存期得到改善[6]。成年CF患者肺移植研究显示中位生存期为9.2年,显著优于因其他疾病指征接受移植的患者[9]。儿科CF患者肺移植的中位生存期为5.2年,与其他指征进行肺移植的儿科患者相近[10]。如想从肺移植获益,术前患者筛选及风险评估至关重要[11]。除ACFLD患儿应考虑肺移植外,每个肺移植中心还有各自不同的相对和绝对禁忌证。在相对禁忌证中,进展性或严重营养不良和高耐药微生物定植与CF最相关[12]。研究显示,洋葱伯克霍尔德菌复合群定植感染与移植后死亡率相关,铜绿假单胞菌定植与移植后死亡率无关[13]。因此,很多中心将新洋葱伯克霍尔德菌慢性感染列为禁忌证[12,13]。对于儿童患者,年龄与移植后死亡率无关。肺动脉高压、体重指数、胰腺功能不全、CF相关糖尿病未发现与移植后死亡相关,但营养不良是肺移植的相对禁忌证。本例患儿虽然在移植前出现轻度肺动脉高压,营养不良进行性加重,但无洋葱伯克霍尔德菌复合群的定植感染,移植后活动正常,营养状况得到改善,肺动脉压恢复正常,从移植中获益明显。当然,远期情况仍需随访观察。
综上,肺移植仍然是目前CF患儿晚期肺疾病的唯一有效治疗手段。对于CF患儿,应密切监测病情变化,对于ACFLD患者应及时转诊肺移植中心进行评估。
所有作者均声明不存在利益冲突



























