
分析重症腺病毒肺炎后遗留支气管扩张症患儿的临床特征,为临床提供儿童重症腺病毒肺炎后遗留支气管扩张症的早期诊断线索。
回顾性分析2016年5月至2021年5月广州医科大学附属广州市妇女儿童医疗中心诊治的重症腺病毒肺炎后遗留支气管扩张症患儿26例的临床资料。
26例患儿中,男18例,女8例。重症腺病毒肺炎发病中位数年龄为23.0(15.0,48.0)个月,其中23例为混合感染,以混合细菌感染最常见(16例)。高分辨率CT示多肺叶肺实变伴/不伴胸腔积液。绝大部分病例急性期予以静脉注射用免疫球蛋白(21例)、机械通气(20例)、全身性糖皮质激素治疗(19例)。确诊支气管扩张症时,中位数年龄为29.5(21.0,56.8)个月,距腺病毒肺炎急性期的中位数时间为6.0(3.3,13.0)个月。6例单纯遗留支气管扩张;20例合并感染后闭塞性细支气管炎(PIBO),其中3例与PIBO同时出现支气管扩张,17例在PIBO后出现。以弥漫性支气管扩张为主(24例),最常累及左下叶(21例)和右下叶(21例),支气管扩张类型以柱状最常见(23例)。随访中均反复咳嗽、喘息,仅3例咳脓痰,无咯血。均出现急性加重,引起急性加重最常见病原为细菌(21例),19例合并PIBO及1例单纯支气管扩张症患儿需再次住院。无行外科手术切除或死亡病例。
儿童重症腺病毒肺炎后遗留支气管扩张症多在PIBO基础上发生,也可单独发生。多肺叶累及与混合感染可能是PIBO基础上并发支气管扩张的高危因素。临床表现多为反复咳嗽、喘息,而咳痰及咯血较少见。临床医师应及时行胸部高分辨率CT早期诊断。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
人腺病毒(human adenovirus,HAdV)是引起儿童急性下呼吸道病毒感染的主要病原[1,2],且与儿童重症肺炎的相关性最高,占重症肺炎的32.2%,也是引起5岁以下中国儿童肺炎死亡的主要病原[3,4]。重症腺病毒肺炎发病急,病情重,并发症多,病死率可高达10%,14%~60%的存活者可遗留不同程度的后遗症[3,5],如感染后闭塞性细支气管炎(post-infectious bronchiolitis obliterans,PIBO)、支气管扩张(bronchiectasis)、单侧透明肺、肺间质纤维化等[1,5,6]。
近年来,重症腺病毒肺炎后遗留PIBO的报道逐渐增多,然而,支气管扩张症作为重症腺病毒后遗症的研究报道有限,临床上对儿童重症腺病毒肺炎遗留支气管扩张症尚缺乏充分认识。现对26例重症腺病毒肺炎后遗留支气管扩张症患儿的临床特征、影像学改变、支气管镜检查、治疗及随访结果分析如下,以提高临床医师对本病的认识。
回顾性分析2016年5月至2021年5月广州医科大学附属广州市妇女儿童医疗中心诊治的26例确诊重症腺病毒肺炎后遗留支气管扩张症患儿的临床资料。
本研究获得医院医学伦理委员会批准[批准文号:穗妇儿科伦批字(2021)第212A01号],患儿监护人均签署知情同意书。
(1)28 d<年龄≤18岁;(2)符合《儿童腺病毒肺炎诊疗规范(2019年版)》中儿童腺病毒肺炎的诊断标准[7],本研究采用PCR方法在患儿鼻咽拭子或肺泡灌洗液中检测到腺病毒DNA证实为腺病毒感染;(3)符合《儿童社区获得性肺炎诊疗规范(2019年版)》重症诊断标准[8];(4)符合《儿童支气管扩张症诊断与治疗专家共识》支气管扩张症诊断标准[9]。
(1)已知或疑似活动性肺结核,严重伴发疾病(慢性肺部疾病,如支气管哮喘、严重心血管疾病、肿瘤、肾脏或肝脏疾病等),免疫功能低下状态(原发性免疫缺陷、获得性免疫缺陷、入院前给予免疫抑制药物等);(2)已知原发性纤毛运动障碍、囊性纤维化等其他引起支气管扩张的慢性疾病;(3)数据不全或失访。
通过电子病历系统查阅病例资料,回顾性分析重症腺病毒肺炎后遗留支气管扩张症患儿的临床资料,包括基本信息、临床症状及体征、病原学检查、影像、支气管镜检查、治疗及转归等。
患儿出院后定期随访,随访内容主要包括临床症状、体征以及肺部影像(其中肺部影像学复查时间根据肺部损害程度及恢复情况来定,主要是在出院后1周、1个月、3个月,之后每3~6个月随访)。部分患儿根据病情需再次住院或者在支气管镜日间病房行经支气管镜肺泡灌洗治疗。
采用描述性统计,计数资料采用例数(率)表示,年龄、住院天数等计量资料采用M(Q1,Q3)表示。
2016年5月至2021年5月共收治481例重症腺病毒肺炎患儿,符合入组条件26例(26/481,5.41%),其中男18例,女8例。所有患儿既往体健,且腺病毒肺炎急性期均确诊为重症,急性期均存在发热、咳嗽、呼吸急促、三凹征(+)。
26例患儿重症腺病毒肺炎发病中位数年龄为23.0(15.0,48.0)个月。确诊支气管扩张症时中位数年龄为29.5(21.0,56.8)个月,距腺病毒肺炎急性期的中位数时间为6.0(3.3,13.0)个月。20例合并PIBO,其中3例诊断PIBO时已存在支气管扩张,17例是在遗留PIBO的基础上出现支气管扩张,确诊PIBO时距腺病毒肺炎急性期中位数时间为2.0(1.5,2.8)个月,而确诊支气管扩张时距PIBO的中位数时间为5.0(4.3,10.5)个月。6例单纯遗留支气管扩张症,确诊时距腺病毒肺炎急性期中位数时间为2.0(1.0,7.0)个月。
腺病毒肺炎急性期住院期间,26例患儿均行胸部高分辨率CT(high resolution CT,HRCT)检查,表现为多肺叶肺实变伴/不伴胸腔积液。
26例患儿均在随访过程中复查HRCT发现支气管扩张(图1),20例患儿HRCT同时存在"马赛克征",即PIBO,其中8例患儿存在不同程度的肺实变,5例患儿存在纤维条索影,3例患儿存在胸膜增厚,2例患儿存在肺囊泡。其中20例合并PIBO的支气管扩张患儿急性期肺实变累及范围均≥2个肺叶(20/20,100%)。24例(92.30%)为弥漫性支气管扩张(即>2个肺叶),HRCT显示支气管扩张最常累及左下叶、右下叶(各21例,80.77%),其次为右上叶(17例,65.38%),最后为右中叶、左上叶(各15例,57.69%)。20例合并PIBO的支气管扩张症患儿均为弥漫性支气管扩张。支气管扩张的类型以柱状最常见(23例,88.46%),其次为柱状-囊状并存(2例,7.69%),单纯囊状仅1例(3.85%)。
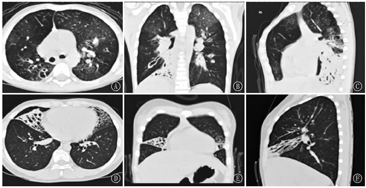

注:HRCT:高分辨率CT;PIBO:感染后闭塞性细支气管炎 HRCT:high resolution computed tomography;PIBO:post-infectious bronchiolitis obliterans
急性期住院期间,23例(88.46%)经病原学检查确定为混合感染,其中16例(16/23,69.56%)合并细菌感染,12例(12/23,52.17%)合并肺炎支原体感染,7例(7/23,30.43%)合并其他病毒感染,其中9例(9/23,39.13%)合并2种及2种以上病原感染。20例合并PIBO的支气管扩张症患儿急性期均为混合感染。
急性期住院期间,26例均因肺实变、广泛渗出而接受支气管镜检查,镜下多表现为黏膜充血、糜烂,2例并发塑型性支气管炎(图2)。15例合并PIBO的支气管扩张症患儿随访过程中因急性加重行支气管镜检查。镜下表现均为黏膜充血,管腔大量淡黄色黏稠分泌物,仅1例见"鱼骨征"(图3)。
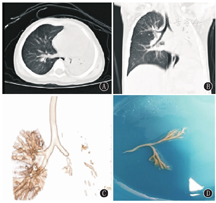

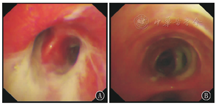

首次住院期间,26例患儿均给予氧疗,25例(96.15%)使用抗生素治疗,21例(80.77%)给予静脉注射用免疫球蛋白(intravenous immunoglobulin,IVIG)治疗,20例(76.92%)给予机械通气,19例(73.08%)给予短期全身性糖皮质激素治疗,4例(15.38%)给予体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)治疗,住院天数中位数为29 d(16,36 d)。
26例患儿均接受随访,最短9个月,最长70个月。随访期间,均反复咳嗽、喘息,仅3例咳脓痰,无咯血患儿。均出现感染所致急性加重,20例因急性加重伴呼吸困难需再次住院,其中19例为合并PIBO、1例单纯支气管扩张症患儿。引起急性加重最常见病原为细菌(21/26,80.77%),其次为病毒(4/26,15.38%),真菌1例。合并PIBO的支气管扩张症患儿随访期间均接受长期家庭雾化吸入糖皮质激素,8例出现活动受限。所有患儿随访期间无外科手术切除或死亡病例。
HAdV是儿童急性呼吸道感染的重要病原之一,占5%~10%[1,2]。研究表明,腺病毒与重症肺炎的相关性最高,也是5岁以下中国儿童肺炎死亡的主要病原[3,4]。同时,重症腺病毒肺炎患儿肺部长期后遗症一直是临床关注的重点,如PIBO、支气管扩张症等[3,5,6] 。支气管扩张症导致疾病负担重,严重危害儿童健康[10]。虽然确切的致病机制不明[11],但目前认为,经早期恰当的治疗,部分儿童支气管扩张可逆转[12]。
目前儿童重症腺病毒肺炎后遗留支气管扩张症的流行病学资料有限,总体发病率不清楚。20世纪80年代一项研究结果显示[13],高达27.27%(6/22)的儿童血清型7型腺病毒肺炎发生支气管扩张症。但随后的研究结果显示[14,15],仅0.35%~4.15%腺病毒肺炎患儿会遗留支气管扩张症。可以看出,儿童腺病毒肺炎后遗留支气管扩张症的发生率有下降趋势。这可能与对儿童重症腺病毒肺炎的认识和急性期治疗水平的提高相关。本研究结果显示,5年来仍有5.41%的儿童重症腺病毒肺炎后遗留支气管扩张症,提示临床上仍需警惕儿童重症腺病毒肺炎的后遗症支气管扩张症的发生。
目前腺病毒肺炎造成支气管扩张的机制未明。研究证实儿童持续性腺病毒感染可引起气道内慢性中性粒细胞炎症、持久性细菌性支气管炎从而导致支气管扩张[16]。研究表明,重症腺病毒肺炎可诱发人体过度的炎性介质,如白细胞介素(IL)-6、IL-8及肿瘤坏死因子α(TNF-α)释放[17,18]。而且支气管扩张症患儿肺泡灌洗液中这些炎性介质显著增高,可进一步诱发中性粒细胞炎症,进而产生蛋白酶损伤气道,导致病理性扩张[19,20]。说明急性期高分泌的炎症介质可能参与了儿童重症腺病毒肺炎后遗留支气管扩张的发病机制。本研究报道26例支气管扩张症患儿均来自重症腺病毒肺炎,且在急性期需氧疗,大部分需全身性糖皮质激素、IVIG、机械通气治疗,部分需ECMO治疗,提示支气管扩张症的发生可能与腺病毒肺炎病情严重程度相关。
本研究发现,儿童重症腺病毒肺炎后遗留支气管扩张症多在PIBO基础上出现。其原因可能是PIBO患儿细支气管阻塞、分泌物清除障碍以及局部免疫功能异常,易继发感染,而病原体及坏死上皮细胞清除障碍造成持续的组织损伤和感染,最终导致支气管扩张的形成。但为什么一部分PIBO患儿未发展为支气管扩张?本研究发现PIBO并发支气管扩张患儿急性期肺实变累及范围均>2个肺叶,在急性期多为混合感染(以细菌和肺炎支原体为主)。而且,这些患儿在随访中行支气管镜镜下均表现为大量黄脓痰,肺泡灌洗液病原检测也证实细菌感染最为常见,腺病毒肺炎继发的细菌感染可能同时参与了支气管扩张的形成。因此,重症腺病毒肺炎累及肺部范围大及混合感染可能是支气管扩张形成的高危因素,特别是混合细菌感染,今后需大样本量研究以进一步验证。据此,儿科医师在关注PIBO作为腺病毒肺炎的主要后遗症的同时应警惕后续支气管扩张症的发生。
辨别重症腺病毒肺炎后遗留支气管扩张症的发病年龄、临床特征等有助于早期诊断,但目前相关文献报道有限。本研究发现,重症腺病毒肺炎后确诊支气管扩张症时中位数年龄为29.5个月,与之前的报道(30个月)相似[21],但明显早于发生支气管扩张症整体儿童(68.4个月[22]、96.0个月[23]),可能与重症腺病毒肺炎的患儿多为婴幼儿和本研究对后遗症的密切随访有关。本研究显示重症腺病毒肺炎后1个月可遗留单纯支气管扩张以及在遗留PIBO时同时出现支气管扩张。因此,对于儿童重症腺病毒肺炎后遗症应早期及时监测。同时,本研究结果显示,儿童重症腺病毒肺炎后遗留支气管扩张症的症状也有别于典型的支气管扩张症。本组所有患儿均有反复咳嗽,大部分有反复喘息,缺乏典型的支气管扩张症表现,如咳脓痰、咯血等,可能与本研究中的患儿大部分为婴幼儿,不会主动咳痰有关。而喘息作为常见症状与大部分患儿合并PIBO有关,这也为临床医师提供了新的线索。因此,对于重症腺病毒肺炎后出现反复咳嗽、喘息的患儿,需警惕在PIBO的基础上并发支气管扩张症的可能,临床医师应及时行HRCT早期诊断。
本研究尚有不足之处:首先,未对腺病毒亚型进行鉴定,故没有分析腺病毒亚型与儿童重症腺病毒肺炎后遗留支气管扩张症的关系;其次,本研究中部分患儿在随访中未常规行肺功能检查,导致肺功能相关数据不全,故本研究中未体现,支气管扩张对患儿肺功能的影响,需今后进一步随访。最后,本研究为单中心回顾性研究,需更大样本病例进一步验证。
综上所述,儿童重症腺病毒肺炎后遗留支气管扩张症多在PIBO基础上发生,也可单独发生。多肺叶累及以及混合感染可能是导致PIBO基础上并发支气管扩张的高危因素。临床表现多为反复咳嗽、喘息,而咳痰及咯血较为少见。临床医师应及时行胸部HRCT早期诊断,并进行长期随访,制定个性化治疗方案,以减少急性加重。
所有作者均声明不存在利益冲突



























