
探究重庆地区幽门螺杆菌(Hp)感染儿童CYP2C19基因代谢型分布及其与性别、年龄及疗效等方面的相关性,为重庆地区儿童Hp感染的根除提供合理的方案。
前瞻性临床队列研究。选择重庆医科大学附属儿童医院2020年3月至7月疑诊为Hp感染并行胃镜检查的156例儿童,均进行13C-尿素呼气试验(13C-UBT)、快速尿素酶试验(RUT)及组织学检测,同时对Hp培养阳性的患儿(102例)应用聚集合酶链反应(PCR)-序列特异性引物分析方法进行CYP2C19基因检测及对2种抗生素(克拉霉素、阿莫西林)进行耐药性试验,根据基因检测结果将CYP2C19基因代谢型分为纯合子快代谢型(HomEM)、中间代谢型(HetEM)及慢代谢型(PM),观察奥美拉唑联合阿莫西林与克拉霉素(PAC)方案在不同代谢型中的根除结局。不符合正态分布的计量资料以中位数(M)表示,计数资料以率或构成比表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
1.共102例患儿Hp培养阳性,13C-UBT阳性率为97.1%(99/102),RUT阳性率为99.0%(101/102),组织学阳性率为90.2%(92/102)。2.102例Hp感染儿童中,HomEM占45.1%(46/102),HetEM占41.2%(42/102),PM占13.7%(14/102)。3.102例Hp感染儿童中,男50例,女52例,年龄3岁~17岁9个月(中位数9岁7个月),CYP2C19基因代谢型在不同性别及不同年龄患儿间的分布差异均无统计学意义(均P>0.05)。4.使用PAC方案者87例,Hp根除治疗初治失败者36例,其中HomEM 18例,HetEM 15例,PM 3例,根除治疗成功者51例,其中HomEM 21例,HetEM 21例,PM 9例,不同CYP2C19基因代谢型在PAC方案中的Hp根除疗效比较差异无统计学意义(P>0.05)。5.87例患儿中,45例患儿对克拉霉素敏感,其中37例患儿根除治疗成功,42例患儿对克拉霉素耐药,其中14例患儿根除治疗成功,克拉霉素耐药性与PAC方案中儿童Hp根除疗效比较差异有统计学意义(P<0.05)。不同CYP2C19基因代谢型在PAC方案中根除疗效比较差异无统计学意义(P>0.05)。
未发现重庆地区Hp感染儿童CYP2C19基因代谢型与性别、年龄及目前的PAC方案根除疗效有相关性。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
幽门螺杆菌(Helicobacter pylori,Hp)是世界卫生组织国际癌症研究机构认定的Ⅰ类致癌因子[1]。世界上超过一半的人口感染过Hp[2]。儿童期是Hp感染的关键期,近年来Hp根除率逐渐下降,主要原因就包括CYP2C19基因多态性[3]。CYP2C19基因处于10号染色体长臂,目前已发现CYP2C19酶的35个等位基因。如果对质子泵抑制剂(PPI)代谢速率相对较高,血药浓度达到较低的水平,就会使疗效受到负面影响,所以对于CYP2C19纯合子快代谢型(HomEM)患者而言,该酶所表现出的活性相对较强,实际治疗则较差;而对于CYP2C19中间代谢型(HetEM)和CYP2C19慢代谢型(PM)患者来讲,这种酶的活性较低,对PPI代谢速率较低,那么血药浓度则较高,最终发挥的疗效就更为显著[4],但随着PPI制剂工艺的改进或服用方法的变化,CYP2C19基因多态性对Hp根除的影响可能存在一定的变化。本研究通过检测重庆地区Hp感染儿童CYP2C19基因代谢型分布及其与性别、年龄和其对Hp根除疗效的相关性,为重庆地区Hp感染患儿个体化治疗提供方案。
前瞻性临床队列研究。选择重庆医科大学附属儿童医院2020年3月至7月疑诊为Hp感染并行胃镜检查的156例儿童为研究对象,入选标准:(1)年龄2~18岁的重庆地区儿童;(2)符合儿童Hp感染诊断标准[5]4项之一:①细菌培养阳性;②胃黏膜快速尿素酶试验(RUT)+组织切片染色均阳性;③组织RUT与病理学不一致,则进一步13C-尿素呼气试验(13C-UBT)阳性;④消化性溃疡出血时,黏膜组织RUT、组织染色任一阳性;(3)符合Hp根除指标的患儿,均采用标准三联(奥美拉唑、克拉霉素、阿莫西林,PAC)方案抗Hp治疗。本研究通过医院医学伦理委员会批准(批准文号:2017-36-1),且受试者监护人均知情同意,并签署知情同意书行胃镜检查,并取胃窦、胃体黏膜活检组织标本进行Hp培养、CYP2C19基因检测及组织学检查。
在重庆医科大学附属儿童医院消化内镜中心对纳入研究患儿进行电子胃镜检查,内镜下观察黏膜病变,取胃窦及胃体黏膜各1块,约0.2 cm×0.2 cm,外送杭州致远医学检验所。
以胃黏膜基因组DNA为模板分别PCR扩增CYP2C19*2、CYP2C19*3基因片段,反应总体系30 μL,反应条件为:98 ℃预变性3 min;98 ℃ 30 s,退火(退火温度:58 ℃)10 s,72 ℃ 10 s,循环30次;最后72 ℃延伸5 min。对PCR产物进行Sanger测序。681AG-636AG或681AA-636GG或681GG-636AA判定为PM;681AG-636GG或681GG-636AG判定为HetEM;681GG-636GG判定为HomEM。
将胃黏膜组织充分研磨后,涂布于Hp专用培养基上,置于37 ℃微需氧环境[50 mL/L氧气(O2),100 mL/L二氧化碳(CO2),850 mL/L氮气(N2)]培养3~5 d,挑选透明可疑菌落进行初步镜检,经尿素酶、氧化酶及过氧化氢酶反应均为阳性的菌株判定为Hp阳性。对培养阳性的Hp菌株采用琼脂稀释法进行抗生素耐药性检测。将2种抗生素(克拉霉素、阿莫西林)分别加入Hp培养专用培养基中稀释成临界浓度,制备不同抗生素平板。将菌液涂布于2个抗生素平板上,置于37 ℃微需氧环境(50 mL/L O2,100 mL/L CO2,850 mL/L N2)培养3 d。所选抗生素及其耐药临界点标准为:克拉霉素1 μg/mL、阿莫西林2 μg/mL。质控菌株为:Hp ACTC11637。在耐药界值平板上生长Hp菌株判为耐药。
对入选的患儿采用PAC方案,疗程14 d,阿莫西林50 mg/(kg·d),最大剂量2 g/d,分2次;克拉霉素15~20 mg/(kg·d),最大剂量1 g/d,分2次;奥美拉唑0.6~1.0 mg/(kg·d),分2次(餐前口服)。患儿行根除治疗结束后停药4周后复诊,复查应用13C-UBT;需内镜复查者直接胃镜检查行RUT及病理学检查,评估临床根除率。
采用SPSS 23.0软件进行处理。不符合正态分布的计量资料以中位数(M)表示,计数资料以率或构成比表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
本研究共纳入156例儿童,临床症状包括腹痛125例(80.1%),纳差17例(10.9%)、呕吐12例(7.7%)、口臭10例(6.4%)、消化道出血11例(7.1%),嗳气2例(1.3%),呃逆2例(1.3%)以及部分无明显临床症状6例(有Hp家族史,3.8%)。均符合胃镜检测指征。
156例儿童中共102例Hp培养阳性,102例Hp感染儿童均进行13C-UBT 、RUT及组织学检测,其中88例(86.3%)患儿13C-UBT、RUT及组织学结果均为阳性,10例(9.8%)患儿13C-UBT及RUT结果阳性,组织学检测阴性或不详,1例(1.0%)患儿13C-UBT及组织学检测阳性,RUT检测阴性,3例(2.9%)患儿RUT及组织学检测阳性,13C-UBT阴性。13C-UBT阳性率为97.1%(99/102),RUT阳性率为99.0%(101/102),组织学阳性率为90.2%(92/102)。
CYP2C19*2野生纯合子GG型52例(51.0%),突变杂合子GA型38例(37.3%),突变纯合子AA型12例(11.8%);CYP2C19*3野生纯合子GG型94例(92.2%),突变杂合子GA型8例(7.8%),突变纯合子AA型0例,经统计检验符合Hardy-Weinberg平衡(χ2=1.456、0.170,P>0.05)。依据CYP2C19的代谢型划分,HomEM 46例(45.1%),HetEM 42例(41.2%),PM 14例(13.7%)(表1)。与中国汉族健康人群及重庆地区健康汉族人群CYP2C19基因代谢型分布情况比较[6,7],差异无统计学意义(P>0.05)(表2)。
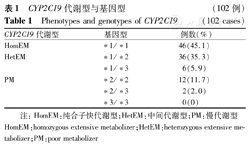
CYP2C19代谢型与基因型 (102例)
Phenotypes and genotypes of CYP2C19 (102 cases)
CYP2C19代谢型与基因型 (102例)
Phenotypes and genotypes of CYP2C19 (102 cases)
| CYP2C19代谢型 | 基因型 | 例数(%) |
|---|---|---|
| HomEM | *1/*1 | 46(45.1) |
| HetEM | *1/*2 | 36(35.3) |
| *1/*3 | 6(5.9) | |
| PM | *2/*2 | 12(11.7) |
| *2/*3 | 2(2.0) | |
| *3/*3 | 0(0) |
注:HomEM:纯合子快代谢型;HetEM:中间代谢型;PM:慢代谢型 HomEM:homozygous extensive metabolizer;HetEM:heterozygous extensive metabolizer;PM:poor metabolizer
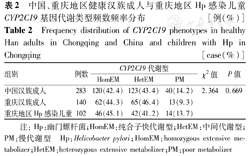
中国、重庆地区健康汉族成人与重庆地区Hp感染儿童CYP2C19基因代谢类型频数频率分布 [例(%)]
Frequency distribution of CYP2C19 phenotypes in healthy Han adults in Chongqing and China and children with Hp in Chongqing [case(%)]
中国、重庆地区健康汉族成人与重庆地区Hp感染儿童CYP2C19基因代谢类型频数频率分布 [例(%)]
Frequency distribution of CYP2C19 phenotypes in healthy Han adults in Chongqing and China and children with Hp in Chongqing [case(%)]
| 组别 | 例数 | CYP2C19代谢型 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| HomEM | HetEM | PM | ||||
| 中国汉族成人 | 283 | 120(42.4) | 123(43.4) | 40(14.2) | 2.364 | 0.669 |
| 重庆汉族成人 | 140 | 62(44.3) | 65(46.4) | 13(9.3) | ||
| 重庆地区Hp感染儿童 | 102 | 46(45.1) | 42(41.2) | 14(13.7) | ||
注:Hp:幽门螺杆菌;HomEM:纯合子快代谢型;HetEM:中间代谢型;PM:慢代谢型 Hp:Helicobacter pylori;HomEM:homozygous extensive metabolizer;HetEM:heterozygous extensive metabolizer;PM:poor metabolizer
102例Hp感染儿童中,男50例,女52例,年龄3岁~17岁9个月(中位数9岁7个月),CYP2C19基因代谢型在不同性别、年龄儿童的分布情况见表3。不同性别、年龄段患儿CYP2C19基因代谢型比较差异均无统计学意义。
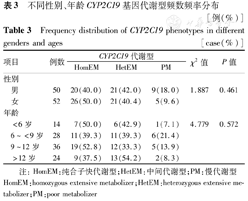
不同性别、年龄CYP2C19基因代谢型频数频率分布 [例(%)]
Frequency distribution of CYP2C19 phenotypes in different genders and ages [case(%)]
不同性别、年龄CYP2C19基因代谢型频数频率分布 [例(%)]
Frequency distribution of CYP2C19 phenotypes in different genders and ages [case(%)]
| 项目 | 例数 | CYP2C19代谢型 | χ2值 | P值 | |||
|---|---|---|---|---|---|---|---|
| HomEM | HetEM | PM | |||||
| 性别 | |||||||
| 男 | 50 | 20(40.0) | 21(42.0) | 9(18.0) | 1.887 | 0.461 | |
| 女 | 52 | 26(50.0) | 21(40.4) | 5(9.6) | |||
| 年龄 | |||||||
| <6岁 | 14 | 7(50.0) | 6(42.9) | 1(7.1) | 4.779 | 0.572 | |
| 6~<9岁 | 28 | 11(39.3) | 11(39.3) | 6(21.4) | |||
| 9~12岁 | 36 | 19(52.8) | 12(33.3) | 5(13.9) | |||
| >12岁 | 24 | 9(37.5) | 13(54.2) | 2(8.3) | |||
注:HomEM:纯合子快代谢型;HetEM:中间代谢型;PM:慢代谢型 HomEM:homozygous extensive metabolizer;HetEM:heterozygous extensive metabolizer;PM:poor metabolizer
102例患儿中,4例采用非PAC方案进行治疗,98例采用PAC方案进行治疗,其中有11例在治疗过程中失访,最终有87例患儿纳入本研究。其中根除治疗成功者51例,HomEM 21例,HetEM 21例,PM 9例,根除失败者36例,HomEM 18例,HetEM 15例,PM 3例,总体根除成功率为58.6%(表4)。重庆地区不同CYP2C19基因代谢型患儿在PAC方案中Hp根除疗效比较差异无统计学意义(P>0.05)。
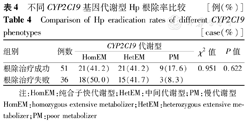
不同CYP2C19基因代谢型Hp根除率比较 [例(%)]
Comparison of Hp eradication rates of different CYP2C19 phenotypes [case(%)]
不同CYP2C19基因代谢型Hp根除率比较 [例(%)]
Comparison of Hp eradication rates of different CYP2C19 phenotypes [case(%)]
| 组别 | 例数 | CYP2C19代谢型 | χ2值 | P值 | ||
|---|---|---|---|---|---|---|
| HomEM | HetEM | PM | ||||
| 根除治疗成功 | 51 | 21(41.2) | 21(41.2) | 9(17.6) | 0.951 | 0.622 |
| 根除治疗失败 | 36 | 18(50.0) | 15(41.7) | 3(8.3) | ||
注:HomEM:纯合子快代谢型;HetEM:中间代谢型;PM:慢代谢型 HomEM:homozygous extensive metabolizer;HetEM:heterozygous extensive metabolizer;PM:poor metabolizer
最终接受PAC方案的87例患儿,有45例对克拉霉素敏感,42例对克拉霉素耐药,耐药率达48.3%,87例患儿均对阿莫西林敏感。克拉霉素敏感组Hp根除率明显高于对克拉霉素耐药组(χ2=21.406,P<0.001)。克拉霉素敏感组及耐药组,PM组Hp根除率高于HetEM组及HomEM组,而分别对两组进行χ2检验,不同CYP2C19基因代谢型在PAC方案中根除疗效比较差异无统计学意义(P>0.05)(表5)。
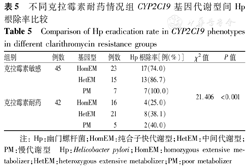
不同克拉霉素耐药情况组CYP2C19基因代谢型间Hp根除率比较
Comparison of Hp eradication rate in CYP2C19 phenotypes in different clarithromycin resistance groups
不同克拉霉素耐药情况组CYP2C19基因代谢型间Hp根除率比较
Comparison of Hp eradication rate in CYP2C19 phenotypes in different clarithromycin resistance groups
| 组别 | 例数 | 基因型 | 例数 | Hp根除率[例(%)] | χ2值 | P值 |
|---|---|---|---|---|---|---|
| 克拉霉素敏感 | 45 | HomEM | 23 | 17(74.0) | 21.406 | <0.001 |
| HetEM | 15 | 13(86.7) | ||||
| PM | 7 | 7(100.0) | ||||
| 克拉霉素耐药 | 42 | HomEM | 16 | 4(25.0) | ||
| HetEM | 21 | 8(38.1) | ||||
| PM | 5 | 2(40.0) |
注:Hp:幽门螺杆菌;HomEM:纯合子快代谢型;HetEM:中间代谢型;PM:慢代谢型 Hp:Helicobacter pylori;HomEM:homozygous extensive metabolizer;HetEM:heterozygous extensive metabolizer;PM:poor metabolizer
CYP2C19酶是细胞色素P450第二亚家族中的一员,其具有基因多态性,基因的改变引起相应编码的酶的活性改变,目前已发现CYP2C19酶的35个等位基因,其中CYP2C19*2和CYP2C19*3基因使酶活性降低从而使药物代谢减慢[8]。可以通过检测CYP2C19*2、*3的表达,将其代谢型分为HomEM、HetEM、PM。CYP2C19酶通过影响PPI的代谢改变胃内pH值从而影响Hp根除率,当胃pH在6~7以上,Hp对抗生素较敏感,且克拉霉素和阿莫西林也能发挥最大功效和持续活性[9]。不同报道均认为CYP2C19基因有地区和种族的差异[10,11,12],HomEM在美洲人中占47.4%,而在大洋洲仅占8.6%,HetEM在东亚人口中占47%,而在非洲黑种人中仅占24.1%,PM在东亚人口中发生率为14.5%,明显高于美洲人的2%。在中国健康汉族人口中,HomEM约占39.9%,HetEM约占45.6%,PM约占13.4%[13]。而在中国,不同民族间CYP2C19基因型发生率也不同,汉族HomEM发生率明显低于哈萨克族和维吾尔族[12]。因此,了解和掌握本地区CYP2C19基因型的分布,有利于更好地提高Hp根除率。本研究对重庆地区102例Hp感染儿童进行CYP2C19基因检测,结果显示HomEM占45.1%,HetEM占41.2%,PM占13.7%,HomEM高于中国及重庆健康汉族成人,但差异无统计学意义,因此在重庆地区对Hp感染儿童应用PPI时应考虑到CYP2C19基因代谢型分布特点,HomEM占比较大,应根据患儿的基因代谢型及时增加剂量/频率或更换其影响较小的PPI,以提高Hp根除率。同时,本研究经统计学分析,发现不同性别及年龄患儿CYP2C19基因代谢型比较差异均无统计学意义,与于飞鸿等[14]的研究一致。
儿童Hp根除率低的原因包括药物或治疗方案选择不合理,抗生素耐药,依从率低,CYP2C19基因多态性等多个方面。既往研究表明,在对主要通过CYP2C19酶代谢的PPI(奥美拉唑、兰索拉唑、泮托拉唑)进行应用的过程中,各CYP2C19基因型所对应的Hp根除率有明显区别,HetEM型和PM型患者Hp根除率高于HomEM型,Hp根除率个体差异大,疗效受CYP2C19基因多态性的影响[15,16,17]。在保证抗生素敏感(克拉霉素耐药率≤15%)及患者依从率高的前提下,服用经CYP2C19酶代谢的PPI的HomEM型患者,若治疗时间较短(≤7 d),则Hp根除失败率明显高于HetEM型及PM型患者[18]。另外有研究指出,当未规范使用PPI剂量或仅每日顿服PPI时,HomEM型患者Hp根除失败率明显高于HetEM型、PM型[19]。而在确保克拉霉素敏感性或耐药率≤15%情况下,CYP2C19代谢表型与Hp根除失败无明显关系[18]。在一项研究中,通过对使用PAC方案标准PPI剂量下根除Hp失败的HomEM型患者加大PPI剂量给药,证实了增加PPI剂量能提高Hp根除率[20]。根据CYP2C19基因型给药的研究已成为一大热点,根据CYP2C19代谢型调整奥美拉唑剂量或可消除HomEM、超快代谢型与HetEM、PM之间Hp根除疗效的差异[16]。为消除HomEM型、HetEM型、PM型患儿间Hp根除疗效的差异,临床药物基因组学实施联盟[21]提出根据CYP2C19基因型给药,对于PM型Hp感染患者,PPI剂量减少60%,对于HetEM型Hp感染患者,PPI剂量可减少50%,而对于HomEM型Hp感染患者,PPI剂量可增加50%~100%,可提高PPI根除率。因此,选择经CYP2C19酶代谢较少的PPI(如雷贝拉唑、埃索美拉唑)、适当延长治疗时间(>7 d)、确保抗生素敏感性(克拉霉素耐药率≤15%)、提高患者依从性、高频率(≥2次)使用经CYP2C19酶代谢的标准剂量PPI、精确依据CYP2C19基因型给药等或可降低不同CYP2C19基因代谢型间Hp根除疗效的差异。
既往在重庆地区很少有关于儿童Hp根除方案疗效的报道,尚不明确PAC方案在重庆地区的根除率,在本研究中,87例患儿使用PAC方案,仅51例根除成功,根除成功率为58.6%,远低于80.0%,因此,在重庆地区对未进行药敏试验的Hp感染儿童首选使用PAC方案并不合适。在本研究中,不同CYP2C19基因代谢型患儿Hp根除疗效差异无统计学意义,与以往研究[15,16,17]结果不同,原因可能在于本研究中Hp根除方案中均使用克拉霉素,而克拉霉素耐药率高达48.3%,甚至高于以往关于克拉霉素耐药率的报道[22]。一项关于重庆地区幽门螺杆菌耐药情况的研究显示,克拉霉素耐药率为26.6%[23],本研究中克拉霉素耐药率高于此研究,可能与本研究样本量小相关,扩大样本量可更好地研究克拉霉素耐药率。克拉霉素耐药率高,造成Hp感染儿童的低根除率,掩盖了CYP2C19基因多态性对Hp根除治疗的影响,因此在本研究中CYP2C19基因多态性在Hp根除中的作用未充分显示。其次,在本研究中,患儿依从性均高、根除疗程长(14 d),且均采用标准剂量分2次餐前服用,增强了抑酸效果,更好地发挥了阿莫西林与克拉霉素的效果,一定程度上减少了CYP2C19基因多态性对奥美拉唑的影响,从而弱化了CYP2C19基因多态性在PAC方案中的作用。再次,本研究样本量较小,扩大样本量及精确根据CYP2C19基因型给药或可更深入地研究CYP2C19基因多态性对Hp根除疗效的影响。
为提高Hp根除率,应依据本地区患儿药物敏感性及CYP2C19基因型分布规律选用药物[24]。本研究中重庆地区克拉霉素耐药率高,传统三联疗法根除率低,可根据药敏试验选择敏感的抗生素,同时可选用受CYP2C19基因多态性影响小的PPI(如埃索美拉唑或雷贝拉唑)或正确使用经CYP2C19酶代谢的PPI,高剂量、高频率(2~4次)PPI给药,适当延长治疗时间[25],提高患儿依从性,或者根据CYP2C19基因代谢型测定结果精确给药,以降低CYP2C19基因多态性对Hp根除治疗的影响。
总之,影响Hp根除疗效的因素众多,应首先考虑当地抗生素的耐药性及确保患儿的依从性,对于难治性患者或有条件的患者可正确应用CYP2C19基因检测,进行个体化治疗,而没有条件进行CYP2C19基因检测的患儿也可正确服用PPI以提高患儿Hp根除率,为家庭和社会减少负担。同时基因分型测试应侧重检测已知常见的基因,而非旨在检测新的变异体。因此,临床工作者应了解靶向基因分型测试的局限性,与所有实验室检查一样,CYP2C19基因型只是临床医师在应用PPI时应考虑的一个因素。
所有作者均声明不存在利益冲突































