
非典型溶血尿毒综合征(atypical hemolytic uremic syndrome,aHUS)是罕见病和危重性疾病,由补体旁路调节蛋白异常所致。急性期病死率高,且病情反复,容易进展为终末期肾病。近年来,随着补体抑制剂依库珠单抗的应用,aHUS患者的预后有了较大改善。我国aHUS诊治水平在不同地区差异较大,临床医师对aHUS认识不足,会导致疾病诊断及治疗延迟。为进一步规范我国儿童aHUS的诊断、治疗和管理,由中国罕见病联盟儿童非典型溶血尿毒综合征专业委员会牵头,结合我国病例特点及临床经验,组织国内专家制定本共识。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
血栓性微血管病(thrombotic microangiopathy,TMA)是一组以微血管性溶血性贫血、血栓性血小板减少以及血管内皮损伤导致的缺血性器官损伤为主要表现的临床病理综合征,其发病的关键环节为内皮细胞损伤引发微血栓形成[1,2]。TMA存在一系列不同的病因,所造成的病变范围、临床表现、诊断治疗以及预后有较大差异。由于肾小球内皮细胞容易发生损伤,肾脏是TMA最常受累的器官。TMA的发病取决于患者自身的先天遗传因素和所处环境的触发因素之间的相互作用。触发因素涉及微生物感染、内外毒素、自身免疫性疾病、肿瘤、移植、高血压、药物等方面[3,4]。TMA包括产志贺毒素大肠杆菌溶血尿毒综合征(Shiga-toxin producing Esherichia coli hemolytic uremic syndrome,STEC-HUS)、血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)、非典型溶血尿毒综合征(atypical hemolytic uremic syndrome,aHUS)以及继发TMA。由补体旁路途径调节蛋白异常引起的TMA属于aHUS,而由各种基础疾病或触发因素造成的TMA,属于继发性TMA。儿童aHUS属于罕见病,发病机制复杂,临床呈进行性破坏性表现,病死率高,普及儿童aHUS知识,规范儿童aHUS的临床诊治非常重要。2017年,由国家儿童医学中心(北京)aHUS管理协作组专家,根据我国儿童的发病人群、种族和国情,因地制宜建立适合我国国情、简洁有效、统一规范的诊疗标准,制定了《中国儿童非典型溶血尿毒综合征诊治规范专家共识》[5]。5年来,该共识为儿科临床医师诊治aHUS提供了重要的参考依据,促进儿童aHUS的早期诊断和早期治疗,对降低aHUS患儿的病死率起到了关键的指导作用,从而惠及国内各地的aHUS患儿。随着对aHUS病理生理学、免疫学、遗传学等发病机制深入研究,以及补体抑制剂依库珠单抗的问世,开启了aHUS精准诊断和治疗的时代,将会降低终末期肾病(end-stage kidney disease,ESKD)的发生率和死亡率。中国罕见病联盟儿童非典型溶血尿毒综合征专业委员会和国家儿童医学中心(北京)牵头国内专家,对2017版共识中aHUS的定义、诊断、补体检测、肾脏病理、治疗和管理等方面进行了更新。
aHUS是罕见病,在2018年被我国罕见病第一批目录录入。据欧洲最大一项调查研究报道,全年龄段人群aHUS的年发病率为0.39/1 000 000,患病率为4.96/1 000 000;在20岁以下人群aHUS年发病率为0.26/1 000 000,患病率为2.21/1 000 000[6]。法国的研究显示,aHUS的年发病率在2000年至2008年间为0.23/1 000 000,而在2009年至2016年间为1.9/1 000 000,呈现上升趋势[7,8],可能与aHUS诊断水平的提高和相关知识的普及有关。aHUS不仅是罕见病,同时也是危重病,aHUS的缺血性器官损伤范围较大,除肾脏外,可广泛累及神经、心脏、肝脏、胰腺、消化道和眼部等多个部位。多数患儿病情呈进行性、破坏性进展,aHUS急性期病死率高达20%~25%。且病情容易反复,大约50%的患儿病程迁延进展为ESKD[9,10]。
aHUS属于TMA系列疾病中的一种,临床表现为微血管病性溶血性贫血、血小板减少和内皮细胞损伤导致的缺血性器官损伤,尤以肾脏受累最为常见。病理特征为肾脏毛细血管和小动脉中的纤维蛋白和血小板血栓,内皮细胞肿胀以及肾小球基底膜双轨征样改变。随着实验室技术的不断发展和对疾病临床过程的深入理解,TMA分类原则更侧重于发病机制方面,尤其关注患者自身的遗传背景和环境、感染、免疫等触发因素。目前aHUS特指补体旁路途径调控蛋白异常所致,即补体介导溶血尿毒综合征(complement-mediated hemolytic uremic syndrome,CM-HUS),而与感染、自身免疫性疾病、恶性高血压、药物、代谢病、造血干细胞移植、实体器官移植及恶性肿瘤等相关的称为继发性TMA和继发性溶血尿毒综合征(HUS)[11,12]。
aHUS是一种罕见的补体旁路途径调控蛋白异常导致的TMA,包括遗传性和获得性的补体调节功能异常。前者主要是由补体相关致病基因变异导致,后者与抗H因子抗体产生有关。
所有可疑aHUS的患者都建议进行基因筛查,这有助于明确诊断、病因分类、指导治疗和预测预后。aHUS相关基因包括补体调控蛋白基因和其他基因,目前认为以下7个基因变异:补体H因子(complement factor H,CFH)、补体I因子(complement factor I,CFI)、膜辅助蛋白(membrane cofactor protein,MCP)、补体C3(complement 3,C3)、补体B因子(complement factor B,CFB)、二酰甘油激酶ε(diacylglycerol kinase epsilon,DGKE)、血栓调节蛋白(thrombomodulin,THBD),与aHUS发病易感性增加有关[7,13,14,15,16]。在5种补体调控因子:CFH、CFI、MCP、C3、CFB中,CFH是最重要的一种,其在体内与CFB竞争C3b,降解C3转化酶,抑制C3转化酶的形成,且能辅助CFI发挥作用。MCP为结合于细胞膜表面的补体调节因子,辅助CFI降解C3b和C4b。CFI在CFH和MCP存在情况下,使C3b和C4b失活。而CFB是补体C3的激活剂前体,在细胞表面与C3b结合裂解成为旁路途径C3的转化酶,属于补体激活促进剂。正常情况下,血管内皮细胞通过系列调控因子发挥作用,避免补体过度激活[17]。如果上述基因出现致病性变异,可能使补体旁路过度激活,从而易感aHUS。C3基因突变为功能获得性突变,突变导致C3与CFB结合能力增强,C3转化酶生成增多。CFB基因突变较为罕见,也是功能获得性突变,导致CFB与C3b结合能力增强,抑制C3转化酶的降解。
其他aHUS相关基因THBD,参与体内凝血纤溶反应过程,亦参与C3b的失活过程,其致病性变异可引起aHUS;与其他基因不同,DGKE为常染色体隐性遗传,非补体调控相关基因,其引起aHUS的机制尚不清楚,尽管部分专家认为应将其单独归类,但目前多数共识仍将DGKE基因致病性变异归属于aHUS[18,19,20]。近年提出纤溶酶原(plasminogen,PLG)、inverted formin 2(INF2)和玻连蛋白(vitronectin,VTN)基因变异与aHUS发病相关,但致病性还需要进一步证实。此外,H因子相关蛋白(complement H related proteins,CFHRs)基因的拷贝数异常与抗H因子抗体阳性的aHUS发病相关。
据报道,30%~60%的aHUS患者携带基因变异[12,21,22,23,24],不同国家aHUS患者的上述基因变异的构成比和预后有所不同。欧洲aHUS队列报道CFH变异比例最高(占21%),其次是MCP变异(占9%)和C3变异(占6%)[25]。北京儿童医院单中心队列研究报道显示,aHUS也是CFH变异比例最高,占13%,其次是C3变异,占9%[24]。日本aHUS的C3变异最高,高达31%,CFH和MCP分别占10%和5%[23]。据文献报道[26],CFH变异5年后ESKD发生率为70%~80%,长期复发率为30%~50%,肾移植后复发率为68%~90%;MCP变异5年后ESKD发生率为10%~20%,长期复发率为58%~90%,肾移植后复发率为11%~20%;C3变异5年后ESKD发生率为45%~65%,长期复发率为50%,肾移植后复发率为40%~50%;CFI变异5年后ESKD发生率为45%~60%,长期复发率为10%~30%,肾移植后复发率为70%~80%。
由于aHUS在基因变异携带者中表现出不完全外显,对于家族中健康携带者,尚无法预测他们是否会发展为aHUS[27]。遗传背景使患者易于患病,而不是直接导致疾病。存在联合致病基因变异、CFH和MCP风险单倍型的患者增加了aHUS患病的风险[28]。aHUS补体遗传学结果的解释复杂,因为补体介导的aHUS不是经典的单基因疾病,而是与补体调节遗传易感性因素相关。
抗H因子抗体干扰H因子功能,造成补体旁路途径过度激活,为获得性补体调控异常。建议所有诊断aHUS的患儿,检测H因子水平及抗H因子抗体。北京儿童医院单中心队列研究报道抗H因子抗体阳性率为65%[29]。欧洲aHUS队列抗H因子抗体阳性率为5%~21%,其中英国及爱尔兰为13%[30,31]、德国为21%[25],亚洲的韩国为29%[32]、印度为56%[33]。获得性aHUS的好发年龄为4~15岁[29,33]。补体H因子相关蛋白1(complement factor H related protein 1,CFHR1)和H因子相关蛋白3(complement factor H related protein 3,CFHR3)基因纯合缺失增加了aHUS患病的风险,与抗H因子抗体相关aHUS有关[34,35],建议通过多重连接依赖性探针扩增(multiplex ligation-dependent probe amplification,MLPA)检测CFHR基因的拷贝数变异。意大利队列抗H因子抗体相关aHUS患者CFHR1纯合缺失的比例为80%[36],欧洲为77%[37],韩国为73%[32],印度为81%[38],北京儿童医院单中心队列研究报道为47%,CFHR1纯合缺失可能与患者存在持续蛋白尿和疾病复发有关[24]。CFHR1纯合缺失患者中45%~92%合并CFHR3纯合缺失[24,32,36,38]。
法国抗H因子抗体相关aHUS队列研究报道死亡率为9%,ESKD发生率为27%,慢性肾脏病发生率为39%,复发率为57%[39]。印度抗H因子抗体相关aHUS队列研究报道慢性肾脏病4~5期和死亡的发生率为25.6%,持续高血压和/或蛋白尿的发生率为26.7%,复发率为17.1%[40]。北京儿童医院单中心队列研究报道,抗H因子抗体相关aHUS死亡率为1.8%,ESKD发生率为1.8%,持续高血压和/或蛋白尿的发生率为30.9%,复发率为21.8%[24]。
部分aHUS患儿既未检测到相关基因变异,也未检测到抗H因子抗体,且未发现与特定疾病相关,这部分aHUS患者被定义为不明原因的aHUS。需要进一步的研究来明确这部分aHUS患者的病因。
aHUS是基于临床表现做出的诊断,初始诊断aHUS时不需要常规完成肾活检。aHUS病理改变核心为内皮细胞损伤,腔内纤维蛋白、血小板栓塞和微血栓形成。但有些患儿病理检查仅有微血管病变,并未显示血栓形成。微血管病变包括内皮细胞的肿胀和剥脱、系膜溶解、肾小球基底膜双轨征、内皮细胞下电子絮状物沉积。在动脉和小动脉中,可出现壁内纤维蛋白、黏液样内膜增厚和内膜洋葱皮样改变。TMA病理形态特征分为活动性病变和慢性病变[12]。
肾小球:光镜下可见毛细血管内血栓形成,内皮细胞肿胀或剥蚀、破碎红细胞;电镜可见内皮细胞下絮状物质沉积,毛细血管内由无定形的电子絮状物、纤维蛋白、血小板和变形红细胞形成的血栓;系膜区水肿,系膜溶解;微动脉瘤形成。小动脉:可见血栓形成,内皮细胞肿胀或剥蚀,壁内纤维蛋白,破碎红细胞,内膜肿胀,肌细胞坏死。动脉:可见血栓形成,黏液样内膜肿胀,壁内纤维蛋白和破碎红细胞。
肾小球:光镜下可出现毛细血管壁双轨征,伴系膜插入;电镜下可见新生内皮下基底膜形成,导致内皮下疏松层增宽。小动脉:可见玻璃透明样物质沉积。动脉:可见内膜纤维样增厚分层,即洋葱皮样改变。
aHUS患儿具有TMA微血管溶血性贫血、血栓性血小板减少及缺血性多器官损伤(尤以肾脏损伤为主)三大特征[12]。约70%的患者具有至少1种前驱触发因素,其中感染因素最为常见,约50%的患者有消化道和呼吸道前驱感染史[7,13,41]。各年龄段患儿均可发病,肾脏表现为血尿、蛋白尿、血红蛋白尿、高血压、尿量减少甚至无尿;除急性溶血性贫血、血小板减少和肾损害症状外,亦可有神经系统症状、心力衰竭、呼吸紊乱、胰腺炎、肝损伤,小肠结肠炎等多脏器损害。aHUS病情容易复发,对具有家族遗传史的患者,需要密切关注复发倾向。某些患儿初发或者复发时,临床三联征未全部出现,如血小板为正常临界值,末梢血涂片未见破碎红细胞,血红蛋白未见明显下降等,呈不典型aHUS表现,需予以注意。
血常规检查:外周末梢血涂片查找破碎红细胞,血红蛋白、网织红细胞及血小板计数。尿常规:镜检红细胞,尿蛋白,血红蛋白尿。便常规镜检,大便聚合酶链反应(polymerase chain reaction,PCR)和便培养。
血乳酸脱氢酶、总胆红素、非结合胆红素、尿素氮、肌酐、转氨酶、脂肪酶及胰淀粉酶等。
直接抗人球蛋白试验(Coombs′试验);抗核抗体、抗双链DNA抗体、抗磷脂抗体及抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibodies,ANCA)等。
血浆总补体(total hemolytic complement,CH50)、C3、C4、C3肾炎因子、C5a、C5b-9、H因子、B因子、I因子水平、抗H因子抗体。需在患儿接受血浆治疗前留取样本。
需要检测以下基因:CFH、CFI、CFB、CFHR、MCP、C3、THBD和DGKE基因,血管性血友病因子裂解酶(A disintegrin and metalloproteinase with thrombospondin motifs 13,ADAMTS13)相关基因,钴胺素C(cobalamin,cblC)缺陷相关基因;建议进行全外显子基因检查,MLPA检测CFHR基因的拷贝数变异。
ADAMTS13活性及抗体、血、尿有机酸代谢检测,血同型半胱氨酸测定,凝血检查及骨髓穿刺等。
鉴于急性期患儿血小板低下,出血风险增高,不推荐在急性期常规进行肾脏穿刺。如果有下列情况,可考虑进行肾脏穿刺检查:诊断不明确时,如不具有完全三联征的表现,血尿、蛋白尿进行性加重,恶性高血压;aHUS治疗效果不佳;病情迁延,需要了解肾脏损害程度、是否有活动病变、慢性病变;而一部分继发性HUS或TMA是通过肾穿刺发现病理TMA样改变,进一步行补体基因及抗体检测诊断aHUS。在肾脏穿刺前,应该充分评估血小板计数、凝血因子指标及高血压程度,并进行相应的处理,以规避不可控制的出血风险。
具有临床三联征的表现:微血管性溶血性贫血、消耗性血小板减少及血栓导致的器官受损。血红蛋白<100 g/L,外周血涂片有破碎红细胞,网织红细胞升高,乳酸脱氢酶升高;血小板<150×109/L;同时存在急性器官损伤,尤以肾损伤为主,即血肌酐升高超过同年龄同性别健康儿童水平上限(儿童血肌酐水平受年龄、性别影响[42],因此,采用中华人民共和国卫生行业标准——儿童临床常用生化检验项目参考区间[43],见表1),除外STEC感染、TTP、继发性TMA和继发性HUS,即考虑诊断为aHUS[18]。具体的诊断流程及鉴别诊断见图1。

中国儿童血清肌酐参考区间
Reference intervals of serum creatinine for Chinese children
中国儿童血清肌酐参考区间
Reference intervals of serum creatinine for Chinese children
| 年龄 | 参考区间(μmol/L) | |
|---|---|---|
| 男 | 女 | |
| 28 d~<2岁 | 13~33 | |
| 2~<6岁 | 19~44 | |
| 6~<13岁 | 27~66 | |
| 13~<16岁 | 37~93 | 33~75 |
| 16~18岁 | 52~101 | 39~76 |
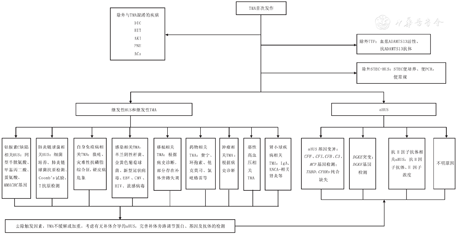

注:TMA:血栓性微血管病;DIC:弥散性血管内凝血;HIT:肝素介导的血小板减少症;AKI:急性肾损伤;PNH:阵发性睡眠性血红蛋白尿;ACs:自身免疫性血细胞减少;TTP:血栓性血小板减少性紫癜;ADAMTS13:血管性血友病因子裂解酶;STEC-HUS:产志贺毒素大肠杆菌溶血尿毒综合征;STEC:产志贺毒素大肠杆菌;PCR:聚合酶链反应;HUS:溶血尿毒综合征;aHUS:非典型溶血性尿毒综合征;EBV:EB病毒;CMV:巨细胞病毒;HIV:人类免疫缺陷病毒;ANCA:抗中性粒细胞胞质抗体;CFH:补体H因子;CFI:补体I因子;CFB:补体B因子;C3:补体C3;MCP:膜辅助蛋白;THBD:血栓调节蛋白;CFHRs:H因子相关蛋白;DGKE:二酰甘油激酶ε TMA:thrombotic microangiopathy;DIC:disseminated intravascular coagulation;HIT:heparin-induced thrombocytopenia;AKI:acute kidney injury;PNH:paroxysmal nocturnal hemoglobinuria;ACs:autoimmune cytopenias;TTP:thrombocytopenic purpura;ADAMTS13:A disintegrin and metalloproteinase with thrombospondin motifs 13;STEC-HUS:Shiga-toxin producing Esherichia coli hemolytic uremic syndrome;STEC:Shiga-toxin producing Esherichia coli;PCR:polymerase chain reaction;HUS:hemolytic uremic syndrome;aHUS:atypical hemolytic uremic syndrome;EBV:Epstein-Barr virus;CMV:cytomegalovirus;HIV:human immunodeficiency virus;ANCA:anti-neutrophil cytoplasmic antibodies;CFH:complement factor H;CFI:complement factor I;CFB:complement factor B;C3:complement 3;MCP:membrane cofactor protein;THBD:thrombomodulin;CFHRs:complement H related proteins;DGKE:diacylglycerol kinase epsilon
其他形式的溶血性贫血、其他原因导致的急性肾损伤、弥散性血管内凝血、恶性贫血及肝素诱导的血小板减少等,进行Coombs′试验和凝血检查等加以鉴别,必要时行骨髓穿刺。
钴胺素C(维生素B12)代谢基因MMACHC突变是导致儿童继发性HUS的原因[49]。钴胺素转化为活性形式甲钴胺和腺钴胺的过程受阻,同型半胱氨酸和甲基丙二酰辅酶A不能分别转化为蛋氨酸和琥珀酰辅酶A,同型半胱氨酸和甲基丙二酸在内皮细胞积聚[50],使得血小板聚集,自由基增加、局部促凝因子过度表达,导致内皮细胞损伤。患儿除TMA三联征外,常有神经系统发育落后,喂养困难、心脏损害和眼部受累等症状。多伴有大细胞性或正细胞性贫血,不同程度肾损害。血和尿有机酸测定显示甲基丙二酸升高,血同型半胱氨酸增高,基因检测可助于临床分型和预后的判断。及时注射羟钴胺,口服甜菜碱、叶酸和左卡尼汀,可使部分患儿TMA症状得到缓解[51]。PE和依库珠单抗治疗无效[52,53,54]。对于有家族史、病史迁延难治,对PE及依库珠单抗治疗无效,尤其是合并神经系统发育落后的患儿,建议尽早行血、尿有机酸筛查及钴胺素代谢基因检测。
好发于2岁以下的婴幼儿,占儿童所有HUS的5%~15%。可能与肺炎链球菌疫苗未覆盖到某些血清型有关[55]。pHUS的发病机制尚不明确,一般认为,肺炎链球菌菌株产神经氨酸酶,分解血小板、红细胞和内皮细胞表面的神经氨酸,暴露出隐蔽的T抗原,与体内存在的IgM冷抗体结合,引发内皮细胞损伤。临床表现除TMA三联征以外,多有坏死性肺炎合并脓胸,部分患儿有化脓性脑膜炎及硬膜下积液。体内炎症指标显著升高,存在肺炎链球菌感染的证据,如深部痰培养或血培养肺炎链球菌阳性,应选用敏感抗生素,如头孢霉素和万古霉素等积极抗感染治疗。病情危重时通常需要呼吸支持。贫血严重时输注洗涤红细胞。有研究显示神经氨酸酶亦影响CFH发挥作用,继而不能有效抑制补体活化,造成内皮细胞损伤[56,57],近来有依库珠单抗治疗pHUS取得良好效果的报道[58]。PE可以清除神经氨酸酶,移除与T抗原结合的抗体,并能补充CFH,是PE用于治疗pHUS的依据。不过,理论上血浆含有IgM抗体,与暴露出的T抗原结合,存在加重TMA病情的可能,采用白蛋白替代新鲜血浆作为置换液,可以降低这种可能。但持异议者认为,冷IgM抗体在体内37 ℃情况下理论上不可能引起红细胞凝集,T抗原抗体反应并非导致pHUS发生的原因,因此,新鲜冰冻血浆不会加重TMA病情,临床无需避免使用[55]。有病例总结显示,使用冰冻血浆作为置换液进行PE治疗pHUS,取得良好效果[59]。目前,尚无大样本PE在pHUS的应用报道。2023年美国血浆置换学会发布的第9版指南建议,PE在pHUS的应用属于Ⅲ类指征,即尚未明确PE在pHUS的最佳作用,制定相关决策时应个体化处理[60]。
细菌和病毒及其他病原造成的重症感染可以触发TMA,包括革兰阴性杆菌、金黄色葡萄球菌;流感病毒、EB病毒、巨细胞病毒、人体免疫缺陷病毒;钩端螺旋体、立克次体、疟原虫等。经过PE和抗感染治疗无好转,要考虑有无补体参与致病,及时调整治疗方案。
新型冠状病毒感染相关TMA:急性重症新型冠状病毒感染亦是补体过度激活的触发因素,导致感染相关TMA[61]。在这些新型冠状病毒感染患儿中,可见明显的补体激活,内皮细胞损伤[62],血浆可溶性C5b-9与疾病严重程度相关[63]。在有潜在补体调控异常的患儿中,新型冠状病毒感染触发补体过度活化,引发TMA。在这类情况下,可以考虑使用依库珠单抗[61]。
造血干细胞移植术后TMA的发生与移植前的预处理、移植排斥反应、抗排异药物的使用以及免疫低下引起的各种感染有关。某些预后较差的患儿抗H因子抗体阳性,补体基因异常,提示补体系统参与了移植相关TMA。目前,二次打击学说认为,在移植前预处理和移植早期阶段,内皮细胞处于促凝状态;移植后造血重建阶段,各种危险因素使得补体旁路途径异常活化,介导了内皮细胞再损伤。积极去除病因,可以采用PE、去纤苷及支持治疗。部分经针对触发因素治疗效果不佳,体内补体成分异常的患儿,可以考虑应用依库珠单抗治疗[64]。
肾移植相关TMA:肾移植可继发TMA,部分未表现出TMA三联征的患者通过肾活检诊断TMA。肾移植后TMA为多种因素所致:钙调磷酸酶抑制剂的使用,抗体介导的排斥反应、病毒感染、移植物抗宿主反应,人类白细胞抗原不匹配,化疗药物、放射治疗等。其中钙调磷酸酶抑制剂和抗体介导的排斥反应可能为主要致病因素。支持治疗和去除各种诱发因素为主要处理措施,如果无好转,可以考虑依库珠单抗治疗[65]。见图2。
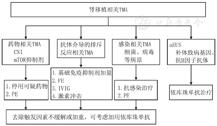

注:TMA:血栓性微血管病;CNI:钙调磷酸酶抑制剂;mTOR:哺乳动物雷帕霉素靶蛋白;aHUS:非典型溶血尿毒综合征;PE:血浆置换;IVIG:静脉注射用丙种球蛋白 TMA:thrombotic microangiopathy;CNI:calcineurin inhibitor;mTOR:mammalian target of rapamycin;aHUS:atypical hemolytic uremic syndrome;PE:plasma exchange;IVIG:intravenous immune globulin
狼疮TMA临床表现与系统性红斑狼疮(systemic lupus erythematosus,SLE)高度重叠,容易漏诊,狼疮性肾炎患儿出现血栓、高血压、溶血性贫血、血小板减少、肾损伤加重时,应及时检测ADAMTS13活性和抑制物、抗磷脂抗体、补体因子和肾脏病理以明确诊断,根据ADAMTS13活性和相关结果进一步区分SLE相关TTP、SLE相关aHUS,以指导下一步治疗[66]。
狼疮TMA病情较重,肾脏预后差,病死率高,治疗难度较大,缺乏统一的治疗共识。目前糖皮质激素、免疫抑制剂及B细胞靶向药物为主要治疗手段,辅以PE、抗凝治疗和抗血小板药物等对症综合治疗。但仍有约半数患者治疗困难,针对这类狼疮TMA患者,有应用依库珠单抗取得良好效果的报道,提示依库珠单抗有可能是一个治疗难治性狼疮TMA的选择[67]。
灾难性抗磷脂综合征相关TMA病情重,病死率高。糖皮质激素、抗凝治疗和PE及丙种球蛋白联合治疗可降低病死率。近年有研究报道,灾难性抗磷脂综合征患者体内有补体过度激活,使用依库珠单抗显示了良好的治疗效果[54]。
多种药物可致TMA,致病机制分为免疫性诱导损伤和直接细胞毒损伤。常见药物有抗疟疾药物奎宁;免疫抑制剂环孢素、他克莫司等;抗血小板聚集药物噻氯匹定、氯吡格雷;丝裂霉素,血管内皮生长因子抑制剂(贝伐珠单抗)等多种抗肿瘤药物。支持治疗和停用相关药物为主要处理措施。
恶性高血压可致内皮细胞损伤,肾小球毛细血管和小动脉纤维素样坏死,引起继发性TMA。针对恶性高血压相关TMA患儿,应该更积极地控制血压,以缓解TMA症状和防止肾损伤进行性加重。如果控制高血压后,TMA临床无好转或加重,要注意考虑补体可能参与了恶性高血压相关TMA的发病,进行补体基因和抗体检测,应该更早使用依库珠单抗治疗,改善肾脏预后[68]。
恶性肿瘤患儿体内凝血与抗凝血纤溶系统调节紊乱,微血管内瘤栓,接受化疗、放疗以及合并的各种感染、B淋巴细胞功能失调等均可能参与了肿瘤继发TMA的发生发展。抗肿瘤治疗以及对症支持治疗为主要处理措施。
肾小球疾病:IgA肾病、ANCA相关性肾炎、感染后肾小球肾炎/感染相关性肾小球肾炎等也可合并TMA。部分患者是亚临床型,通过肾穿刺发现病理TMA样改变而诊断。病情相对较重,器官损害较重。可以进行补体基因和抗体检测。
针对aHUS的治疗策略是纠正补体系统的失调。在补体抑制剂应用以前,血浆治疗是一线选择,但血浆疗法对补体基因异常患者效果不佳,且不能解决复发率高、肾损害进展等问题[19]。依库珠单抗是一种重组人源化单克隆抗体,抑制C5裂解为C5a和C5b并防止末端补体复合物C5b-9的形成,保留了上游补体因子(如C3a和C3b)的功能[66,69]。依库珠单抗的使用极大地改善了aHUS患儿的预后[11,70]。依库珠单抗治疗aHUS患者的前瞻性、观察性和多中心研究证实了依库珠单抗的有效性和安全性,特别是在PE抵抗或依赖的患者[71],目前依库珠单抗已成为aHUS的一线治疗药物[72,73,74]。临床确立aHUS的诊断后,应尽快启动依库珠单抗的治疗。
aHUS临床诊断确立后,患儿应在发病或入院后24~48 h内接受依库珠单抗治疗,如果无法获得依库珠单抗,可行PE。开始依库珠单抗不需要得到基因检测结果。
对于抗H因子抗体相关aHUS患者采用依库珠单抗作为初始治疗,如果无法获得依库珠单抗,则应开始PE。还需要加用糖皮质激素及免疫抑制剂治疗,当抗H因子抗体滴度<1 000 AU/mL时复发风险较低,可以考虑停用依库珠单及血浆治疗[11,12]。对于存在急性、严重的多器官损伤(神经系统表现、心力衰竭)的患者,建议依库珠单抗治疗[11]。在特殊情况下采用了PE联合依库珠单抗,要注意,如果依库珠单抗治疗后应用PE,要充分考虑到PE后能够使依库珠单抗清除出体外,需要补充依库珠单抗,以维持有效的依库珠单抗血浓度。如补体基因存在致病性变异,则继续应用依库珠单抗;未发现补体基因异常,应评估病情,考虑停用依库珠单抗;对于DGKE突变者,可采用PE和支持治疗,依库珠单抗治疗的获益不明确。总之,对于临床诊断为aHUS的患儿,建议将依库珠单抗作为一线治疗,延误治疗可能会增加ESKD的风险[75,76,77]。依库珠单抗使用剂量及给药间隔见表2,治疗流程见图3。
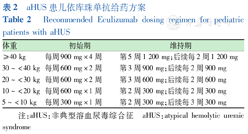
aHUS患儿依库珠单抗给药方案
Recommended Eculizumab dosing regimen for pediatric patients with aHUS
aHUS患儿依库珠单抗给药方案
Recommended Eculizumab dosing regimen for pediatric patients with aHUS
| 体重 | 初始期 | 维持期 |
|---|---|---|
| ≥40 kg | 每周900 mg×4周 | 第5周1 200 mg;后续每2周1 200 mg |
| 30~<40 kg | 每周600 mg×2周 | 第3周900 mg;后续每2周900 mg |
| 20~<30 kg | 每周600 mg×2周 | 第3周600 mg;后续每2周600 mg |
| 10~<20 kg | 每周600 mg×1周 | 第2周300 mg;后续每2周300 mg |
| 5~<10 kg | 每周300 mg×1周 | 第2周300 mg;后续每3周300 mg |
注:aHUS:非典型溶血尿毒综合征 aHUS:atypical hemolytic uremic syndrome

注:aHUS:非典型溶血尿毒综合征;PE:血浆置换;PI:血浆输注;CTX:环磷酰胺;GFR:肾小球滤过率;MMF:吗替麦考酚酯;DGKE:二酰甘油激酶ε aHUS:atypical hemolytic uremic syndrome;PE:plasma exchange;PI:plasma infusion;CTX:Cyclophosphamide;GFR:glomerular filtration rate;MMF:Mortemycophenol;DGKE:diacylglycerol kinase epsilon
末端补体复合物C5b-9对脑膜炎球菌有杀伤作用,而依库珠单抗阻断了C5b-9的形成,接受依库珠单抗治疗的患儿会发生危及生命的脑膜炎球菌感染[78,79],需在接受第1剂依库珠单抗治疗之前至少2周,对患儿进行脑膜炎球菌的疫苗接种[11,12,79]。建议接种四价脑膜炎疫苗(ACYW135),并在有条件的情况下接种脑膜炎B型疫苗,保护其免受脑膜炎球菌感染[79,80]。此外,患者还应接种肺炎球菌多价疫苗避免严重的肺炎链球菌感染[12,79,80]。但患儿可能由于病情严重无法在治疗前接种疫苗,一旦情况稳定,就应进行疫苗接种。患儿应接受抗生素预防,如青霉素、阿莫西林、大环内酯类或头孢菌素药物,以预防脑膜炎球菌感染,直到接种疫苗后至少2周。在肾功能损伤的情况下,应用补体抑制剂治疗期间可能会影响抗体的产生,抗体也不可能覆盖全部的脑膜炎球菌血清型。也有建议抗生素预防时间应覆盖整个依库珠单抗的治疗时期,直到停用依库珠单抗后的2~3个月[12]。由于疫苗和抗生素预防都不能提供完全保护,要监测患儿是否有脑膜炎球菌感染的早期症状,如果怀疑有感染,立即进行评估[80]。此外,儿童用药初期最常报道的不良反应为头痛,其他不良反应还包括输液反应、胃肠道症状、肝酶升高及胆汁淤积等,需要对症处理[81]。
依库珠单抗治疗期间需要监测补体活性[12,73]。依库珠单抗谷浓度与补体阻断之间相关性的研究表明依库珠单抗谷浓度在50~100 μg/mL会显著降低CH50的活性。大多数患者接受推荐的治疗方案能够达到完全补体阻断。CH50测定开展广泛,是补体阻断的标志物[82]。依库珠单抗在给药1 h内就可达到补体阻断[76]。完全抑制者的CH50应小于正常值的10%。在接受依库珠单抗治疗的aHUS患者中,可溶性C5b-9的血浆水平仍可检测到或升高,因此不推荐使用可溶性C5b-9评价依库珠单抗的疗效[83,84]。依库珠单抗治疗期间,临床常规监测应包括尿常规、血生化和血常规。
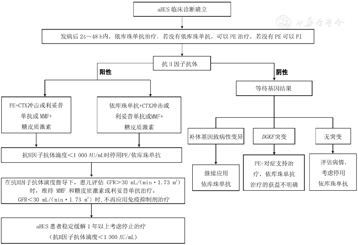
依库珠单抗的使用阻断了补体的激活,可以有效治疗TMA及保护肾脏功能。依库珠单抗的治疗方案目前仍有争议,需要个体化治疗。抗H因子抗体相关aHUS的复发风险取决于抗体滴度,当抗H因子抗体滴度<1 000 AU/mL时复发风险较低,可以考虑停用依库珠单抗[11,69]。MCP致病性变异的aHUS患儿,如果肾功能迅速缓解和恢复,治疗3个月时可以考虑停用[12]。存在CFH、C3、CFB、CFI致病性基因变异的儿童,依库珠单抗至少连续应用12个月,病情稳定,血液学参数正常化和肾功能稳定3个月的患者,方可停药[12,85]。由于儿童季节性感染作为触发因素可能会造成aHUS反复发作,撤药应推迟到3~5岁以上[11]。未发现CFH、C3、CFB、CFI及MCP致病性基因变异的aHUS患者停药后复发风险<5%,但存在这些补体基因致病性变异的患者复发风险高达50%[86]。尝试减停药物时可逐渐延长给药间隔时间,当治疗间隔为8周且无aHUS迹象时,可停用依库珠单抗[72]。依库珠单抗停药后,应对患者密切监测,寻找复发的征象:血常规、尿常规、血生化、CH50,监测血压[11,12],停药后前3个月至少每月由肾脏科医师随访1次,随后每3个月随访1次。血肌酐、乳酸脱氢酶、血红蛋白、血小板计数、尿蛋白/尿肌酐、尿常规检查在前6个月应至少每2周进行1次,随后每月1次。患者在家也应进行尿试纸监测,至少1周2次[86]。
aHUS复发时的临床表现多样,不一定具备全部三联征。部分患儿表现为新发血尿和蛋白尿,或血尿蛋白尿加重。针对复发病例,迅速重新使用依库珠单抗治疗可缓解aHUS,应密切监测患者疾病复发的早期征象并尽早治疗[85,86]。aHUS复发时,依库珠单抗的使用方法同初始启动方案[11,87]。依库珠单抗应用期间的监测方法及停药策略见图4。
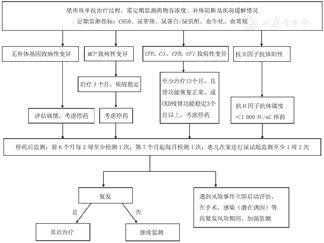

注:CH50:血浆总补体;MCP:膜辅助蛋白;CFH:补体H因子;C3:补体C3;CFB:补体B因子;CFI:补体I因子;CKD:慢性肾脏病;补体阻断情况:补体完全阻断CH50<10%。有条件可以检测依库珠单抗谷浓度,依库珠单抗谷浓度50~100 μg/mL可以达到有效补体阻断。当存在感染、疫苗接种、手术等情况应加强监测。完全缓解标准:血小板、乳酸脱氢酶正常,肌酐水平正常或肌酐复原 CH50:total hemolytic complement;MCP:membrane cofactor protein;CFH:complement factor H;C3:complement 3;CFB:complement factor B;CFI:complement factor I;CKD:chronic kidney disease;the status of complement blockade:complete complement blockade CH50<10%.Eculizumab trough concentration can be tested when available,and Eculizumab trough concentration of 50-100 μg/mL can achieve effective complement blockade.Intensify monitoring in the presence of infection,vaccination,and surgery.Complete remission criteria:normalization of platelets and lactate dehydrogenase,normalization or stabilization of creatinine
预防性应用依库珠单抗可以减少患者肾移植后的aHUS复发和提高移植肾的存活率[11,12,70]。当使用亲属的供体进行移植时,受体和供体均应完善基因筛查。亲属活体肾脏捐献存在受体复发的风险[12]。应根据aHUS患者的基因缺陷分层采取预防措施,对复发风险中等和高风险的患者,应在移植当日开始预防性使用依库珠单抗[12,82]。复发风险低的患者不需要接受预防性治疗[73]。预防性血浆治疗能够改善移植肾的存活率和减少复发,但依库珠单抗预防的效果优于血浆治疗[73,87]。根据风险评估对aHUS移植后复发的防治策略见图5。
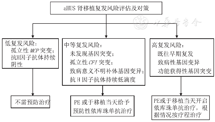

注:aHUS:非典型溶血尿毒综合征;MCP:膜辅助蛋白;CFI:补体I因子;PE:血浆置换 aHUS:atypical hemolytic uremic syndrome;MCP:membrane cofactor protein;CFI:complement factor I;PE:plasma exchange
CFH是由肝脏产生,CFH基因变异介导的重度aHUS患者,既往报道以CFH异常发展到ESKD患者行肝肾联合移植为主[88]。对于复发风险高且肾功能尚可的患儿,可行单纯肝移植[89]。但肝移植会造成移植后继发感染、排异反应及抗排异药物不良反应,因此,肝移植并非是aHUS患儿好的治疗选择,而依库珠单抗的使用将会减少ESKD的发生,而且避免移植一系列相关并发症。
aHUS患儿肾移植术后还可以由于抗排异药物、抗体介导的排异反应、病毒感染,甚至供者因素导致术后TMA的发生[65]。治疗方面应该去除病因,清除感染,如治疗困难,可以考虑应用依库珠单抗治疗。肾移植相关TMA的常见病因和治疗方法见图2。
雷夫利珠单抗(Ravulizumab)是长效补体C5抑制剂,其半衰期增加,从而减少给药频率,延长补体抑制时间,从短效的每2~3周延长至每4~8周,并有良好的安全性[90]。
血浆疗法包括血浆输注和PE,可以补充补体的调控因子。而PE可相对快速地清除CFH自身抗体及有缺陷的突变补体蛋白。保证CFH调节功能和稳定补体的替代途径。但是aHUS患者血浆治疗的临床远期结果较差。治疗死亡率可以达到25%,50%的患者未恢复肾功能[21]。
PE对抗H因子抗体相关aHUS有一定的疗效。在无法获得依库珠单抗的情况下,PE仍为aHUS的首选治疗,诊断aHUS后应尽早在24 h内应用新鲜冰冻血浆进行PE。每次PE置换液剂量为1.5倍血浆容量,即60~75 mL/kg。建议每天置换1次,连续5 d;之后每周5次,连续2周;继之每周3次,连续2周。争取达到血清学缓解,至少2周血小板>150×109/L,溶血停止(即外周血涂片无破碎红细胞、乳酸脱氢酶水平正常),再考虑停止PE治疗[91]。
血浆输注补充功能蛋白缺失的补体成分和调节因子,当PE或依库珠单抗治疗不可及时,可选择新鲜冰冻血浆输注,可能对遗传性aHUS患儿有一定的疗效。输注时应严密监测患儿的生命体征,尤其是血压、呼吸和出入量。需要注意的是与PE等量置换不同,短期内输注大量血浆会加重容量负荷,导致肺水肿甚至呼吸衰竭,建议每次按10~20 mL/kg输注,单次最大量:婴儿≤100 mL,幼儿≤200 mL,儿童≤400 mL。输注血浆后给予利尿剂减轻容量负荷,防止肺水肿的发生[5]。
糖皮质激素及免疫抑制剂是抗H因子抗体相关aHUS治疗方案中重要的组成部分,可有效抑制抗体的产生,降低抗体滴度,抑制组织过度炎症反应,改善患儿预后。针对抗H因子抗体相关aHUS患儿,依库珠单抗并不能降低抗H因子抗体的滴度,需要加用糖皮质激素和免疫抑制剂治疗。在依库珠单抗或PE联合免疫抑制剂的治疗下,抗体水平下降到1 000 AU/mL以下,可减停依库珠单抗或PE。在治疗期间,通过监测抗H因子抗体滴度,辅以糖皮质激素及免疫抑制剂治疗,有助于减少复发及维持缓解[11,12,92,93],见图3。可供选择的免疫抑制药物包括糖皮质激素、环磷酰胺、利妥昔单抗和吗替麦考酚酯(Mortemycophenol,MMF)。免疫抑制治疗分为起始治疗和维持治疗2个阶段。起始阶段包括泼尼松和环磷酰胺或利妥昔单抗,对轻症患者(无或轻度肾外表现者),起始阶段可以考虑选择MMF治疗。泼尼松应在抗体相关aHUS确诊后立即使用,剂量为1 mg/(kg·d),持续4周,然后隔天逐渐减量。环磷酰胺500 mg/m2静脉注射,每4周1次,共3~5次,或利妥昔单抗375 mg/m2,每周1次,共2次,2周内输入。以达到完全B细胞耗竭。CD20单抗给药前须检查乙型肝炎病毒滴度及治疗前后监测IgG水平。由于卡氏肺孢子菌肺炎具有高死亡率,建议对利妥昔单抗治疗者予以复方磺胺甲 唑3~6个月预防卡氏肺孢子菌肺炎。上述治疗完成后,如果患儿评估肾小球滤过率(glomerular filtration rate,GFR)>30 mL/(min·1.73 m2),则进入免疫抑制维持治疗阶段,一般是在病程3个月左右开始,此阶段泼尼松逐渐减停,疗程9~12个月。MMF每日500~750 mg/m2,分2次给药,维持治疗12~24个月。维持阶段也可考虑再次输注利妥昔单抗(根据CD19细胞及抗H因子抗体的滴度的监测)。如果患儿评估GFR<30 mL/(min·1.73 m2),不再应用免疫抑制剂治疗。
唑3~6个月预防卡氏肺孢子菌肺炎。上述治疗完成后,如果患儿评估肾小球滤过率(glomerular filtration rate,GFR)>30 mL/(min·1.73 m2),则进入免疫抑制维持治疗阶段,一般是在病程3个月左右开始,此阶段泼尼松逐渐减停,疗程9~12个月。MMF每日500~750 mg/m2,分2次给药,维持治疗12~24个月。维持阶段也可考虑再次输注利妥昔单抗(根据CD19细胞及抗H因子抗体的滴度的监测)。如果患儿评估GFR<30 mL/(min·1.73 m2),不再应用免疫抑制剂治疗。
抗体相关aHUS易复发,特别是在感染的情况下。发病后的前2年复发是常见的,患者应在此期间接受维持治疗。多次复发是抗体相关aHUS预后不良的危险因素。目前多通过检测抗体滴度作为预测复发的手段。推荐抗体每3~6个月监测1次。目前认为缓解期抗体水平升高(6个月时≥1 300 AU/mL)的患儿复发风险明显升高[94]。因此针对此类患者需要高度警惕,可以考虑通过免疫抑制剂的应用降低复发风险。有研究报道,接受维持治疗的患者1年无复发生存率为92%,而未接受维持治疗的患者分别为69%和46%[33]。Puraswani等[40]报道了436例抗体阳性患儿,72%的患儿接受了PE后,应用了泼尼松和环磷酰胺或利妥昔单抗,随访6年时间展现出了良好的肾脏生存率。有文献报道利妥昔单抗用于抗H因子抗体相关aHUS取得了较好的疗效[95]。北京儿童医院的队列研究抗H因子抗体阳性率为65%,显示H因子抗体相关aHUS为主要的病因。对于初发抗体阳性患儿应用免疫抑制治疗可以显著降低患儿的复发率,达到长期缓解。维持治疗持续6~20个月[29]。北京儿童医院另报道了10年队列52例抗H因子抗体相关aHUS,随访中位时间58(28,91)个月,仅23.1%的患儿复发,肾功能正常且无高血压、无蛋白尿患儿高达73.1%。70%的复发病例伴有CFHR1或CFHR1并CFHR3纯合缺失,提示了抗H因子抗体相关aHUS合并H因子相关蛋白纯合缺失是复发的危险因素。首次发病使用免疫抑制治疗的患儿1年无复发生存率为89.9%,而未使用免疫抑制治疗的患儿为66.7%。且发现复发主要发生在第1年,占66.7%(8/12)[96]。
总之,aHUS的治疗需要结合当地的医疗资源、年龄、药物疗效、药物不良反应及费用等进行个体化制定。目前国际上针对抗H因子抗体相关aHUS治疗的疗程及方案还在探讨。未来还需要进一步开展更多前瞻性的研究来优化依库珠单抗、PE、环磷酰胺、利妥昔单抗和MMF对抗H因子抗体相关aHUS的最佳治疗方案。
纠正水电解质紊乱,补充营养、利尿降压、输血纠正贫血等。输注血小板会加重微血栓形成,通常不建议血小板输注。在进行性少尿、无尿,尿素氮及肌酐迅速升高,血钾顽固升高,伴有严重水肿,心力衰竭和顽固性高血压时,给予降压及强心治疗,应联合血液透析或腹膜透析治疗。
(刘小荣 樊剑锋 陈植 执笔)
项目负责人:倪鑫(国家儿童医学中心、首都医科大学附属北京儿童医院)
参与本共识讨论和审阅专家(按单位及作者汉语拼音排序):首都医科大学附属北京儿童医院(刘小荣、沈颖、陈植、樊剑锋);重庆医科大学附属儿童医院(李秋、王墨);成都市妇女儿童中心医院(冯仕品);复旦大学附属儿科医院(徐虹、沈茜);复旦大学附属儿科医院安徽医院(邓芳);福建省儿童医院(余自华);贵阳市妇幼保健院(邵晓珊、李宇红);海南省妇女儿童医学中心(徐志泉);河北省儿童医院(张东风);河南省儿童医院(刘翠华);湖南省儿童医院(李志辉);华中科技大学同济医学院附属同济医院(周建华);兰州大学第一医院(李宇宁);内蒙古自治区妇幼保健院(陈丽清);南京医科大学附属儿童医院(张爱华);山东大学附属儿童医院(刘雪梅、张洪霞);山东省立医院(孙书珍);山西省儿童医院(赵丽君);上海市儿童医院(黄文彦);深圳市儿童医院(高晓洁);四川大学华西第二医院(陶于洪);苏州大学附属儿童医院(李晓忠);新乡医学院第一附属医院(韩子明);武汉儿童医院(栾江威、王筱雯);中南大学湘雅二医院(党西强);郑州大学第一附属医院(张建江);中国人民解放军东部战区总医院(夏正坤);中山大学附属第一医院(蒋小云)
所有作者均声明不存在利益冲突



























