
探讨伴认知障碍的肾上腺脑白质营养不良(ALD)患儿行单倍体异基因造血干细胞移植的预后,寻找影响其预后的因素。
采用单中心回顾性研究,收集2014年1月至2022年10月在北京大学人民医院行单倍体异基因造血干细胞移植治疗的31例儿童ALD患者的临床数据。通过Kaplan-Meier法绘制生存曲线和Cox回归分析寻找影响患儿预后的因素。
31例患儿中,1例在移植期间因心源性休克死亡,余30例患儿移植成功。10例在移植前伴认知障碍,其中3例患儿移植前LOES≥10分,8例患儿移植前神经功能评分(NFS)>0分;6例患儿移植后发生主要功能障碍(MFD),2例患儿因原发病进展死亡。20例患儿移植前不伴认知障碍,其中3例患儿移植前LOES≥10分,6例患儿移植前NFS>0分;移植后有4例患儿发生MFD,2例患儿因原发病进展死亡。移植前不伴认知障碍的ALD患儿,移植后3年生存率为100.0%,5年生存率为72.9%,5年不发生MFD的概率为61.6%。伴认知障碍的ALD患儿,移植后3年生存率为83.3%。对比移植前LOES<10分的ALD患儿,LOES≥10分的ALD患儿移植后发生MFD的风险是其9.243倍(P=0.024,95%置信区间:1.332~64.127)。伴认知障碍的ALD患儿移植后发生MFD的风险是移植前不伴认知障的ALD患儿的9.749倍(P=0.023,95%置信区间:1.358~66.148)。
儿童ALD患者单倍体异基因造血干细胞移植前伴认知障碍及影像学评分LOES≥10分均是移植后发生MFD的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾上腺脑白质营养不良(ALD)是一种罕见的X染色体隐性遗传代谢性疾病,发病率约为1/17 000,其发病与血浆极长链脂肪酸(VLCFA)异常增高有关,主要累及大脑白质、脊髓和肾上腺皮质等[1,2,3,4]。儿童ALD患者30%~35%会累及脑部,一般在诊断后5年内死亡[5,6]。目前,异基因造血干细胞移植是脑部受累ALD患儿的唯一有效治疗方法[1,7]。其中,ALD患者移植前头颅磁共振成像(MRI)LOES评分及神经功能评分(NFS)被认为是影响ALD患者移植后预后的重要指标[8]。本研究通过分析在北京大学人民医院进行单倍体造血干细胞移植的ALD患儿数据,以期阐明影响ALD患儿移植后发生主要功能障碍(MFD)的因素。
本研究为单中心回顾性研究,共纳入2014年1月至2022年10月在北京大学人民医院行单倍体异基因造血干细胞移植的患儿31例。患儿在移植前均于北京大学人民医院儿科或北京大学第一医院儿科就诊。依据血清VLCFA升高及ABCD1基因突变,31例患儿均明确诊断ALD[1],移植前均行头颅MRI检查。31例患儿均有异基因造血干细胞移植的指征,但缺乏匹配的同胞供者,亦缺乏匹配的非亲缘供者。因此,31例患儿均行单倍体异基因造血干细胞移植。其中1例患儿因在移植过程中出现心源性休克而死亡,其余30例患儿均移植成功。为进一步研究影响ALD患儿单倍体异基因造血干细胞移植的因素,本研究纳入了这30例成功进行单倍体异基因造血干细胞移植的患儿。本研究通过北京大学人民医院医学伦理委员会批准(批准文号:2022PHB-001),并批准豁免知情同意。
LOES评分作为ALD疾病特异性评分,在1994年由LOES首次提出,并广泛应用于ALD的临床研究中。LOES评分根据ALD患者头颅MRI进行评分,评分系统0~34分[9]。NFS根据ALD患者的症状进行评分,评分系统0~25分[8](表1、表2)。
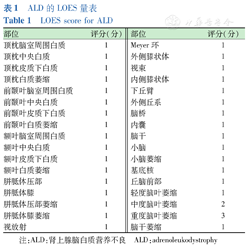
ALD的LOES量表
LOES score for ALD
ALD的LOES量表
LOES score for ALD
| 部位 | 评分(分) | 部位 | 评分(分) |
|---|---|---|---|
| 顶枕脑室周围白质 | 1 | Meyer环 | 1 |
| 顶枕中央白质 | 1 | 外侧膝状体 | 1 |
| 顶枕皮质下白质 | 1 | 视束 | 1 |
| 顶枕白质萎缩 | 1 | 内侧膝状体 | 1 |
| 前颞叶脑室周围白质 | 1 | 下丘臂 | 1 |
| 前颞叶中央白质 | 1 | 外侧丘系 | 1 |
| 前颞叶皮质下白质 | 1 | 脑桥 | 1 |
| 前颞叶白质萎缩 | 1 | 内囊 | 1 |
| 额叶脑室周围白质 | 1 | 脑干 | 1 |
| 额叶中央白质 | 1 | 小脑 | 1 |
| 额叶皮质下白质 | 1 | 小脑萎缩 | 1 |
| 额叶白质萎缩 | 1 | 基底核 | 1 |
| 胼胝体压部 | 1 | 丘脑前部 | 1 |
| 胼胝体膝 | 1 | 轻度脑叶萎缩 | 1 |
| 胼胝体压部萎缩 | 1 | 中度脑叶萎缩 | 2 |
| 胼胝体膝萎缩 | 1 | 重度脑叶萎缩 | 3 |
| 视放射 | 1 | 脑干萎缩 | 1 |
注:ALD:肾上腺脑白质营养不良 ALD:adrenoleukodystrophy
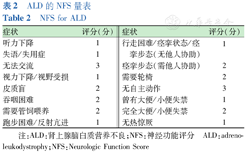
ALD的NFS量表
NFS for ALD
ALD的NFS量表
NFS for ALD
| 症状 | 评分(分) | 症状 | 评分(分) |
|---|---|---|---|
| 听力下降 | 1 | 行走困难/痉挛状态/痉挛步态(无他人协助) | 1 |
| 失语/失用症 | 1 | ||
| 无法交流 | 3 | 痉挛步态(需他人协助) | 2 |
| 视力下降/视野受损 | 1 | 需要轮椅 | 2 |
| 皮质盲 | 2 | 无自主动作 | 3 |
| 吞咽困难 | 2 | 曾有大便/小便失禁 | 1 |
| 需要管饲喂养 | 2 | 完全大便/小便失禁 | 2 |
| 跑步困难/反射亢进 | 1 | 无热惊厥 | 1 |
注:ALD:肾上腺脑白质营养不良;NFS:神经功能评分 ALD:adrenoleukodystrophy;NFS:Neurologic Function Score
已有研究表明,移植前LOES<10分、NFS=0分的ALD患者在异基因造血干细胞移植后有更高的生存率[8,10,11,12]。将LOES<10分且NFS=0分的ALD患儿定义为疾病早期患儿,他们移植后的生存率更高。通过评估ALD患儿移植后是否发生MFD以评价预后情况。NFS的局限性在于,包括记忆力下降、注意力缺陷多动障碍、学习障碍在内的认知障碍作为ALD患儿的常见临床症状,并没有涉及在NFS系统中。因此,本研究着重探讨伴认知障碍的ALD患儿单倍体异基因造血干细胞移植后的预后情况。
采用SPSS 26.0软件进行统计分析。分别以死亡、发生MFD为结局事件,通过Kaplan-Meier法绘制生存曲线,通过Log Rank检验进行生存率的比较。通过Cox回归分析以探讨不同因素对于ALD患儿进行单倍体异基因造血干细胞移植的影响。P<0.05为差异有统计学意义。
入选的30例ALD患儿的中位起病年龄为6.5岁(1~18岁),中位移植年龄为7.5岁(3~18岁)。将30例ALD患儿根据移植前是否伴认知障碍分为2组。30例患儿中,10例患儿在移植前伴认知障碍(表3)。其中,3例患儿移植前韦氏智力测验为边缘性智力水平。3例患儿移植前LOES≥10分,8例患儿移植前NFS>0分。6例患儿移植后发生MFD,2例患儿移植后因原发病进展死亡。20例患儿移植前不伴认知障碍,其中3例患儿移植前LOES≥10分,6例患儿移植前NFS>0分。移植后有4例患儿发生MFD,2例患儿因原发病进展死亡。将30例ALD患儿根据移植前ALD患儿的LOES评分是否<10分以及NFS是否为0分分为2组(表4),进行生存分析。

伴认知障碍的10例ALD患儿的临床特征
Clinical features of 10 ALD children with cognitive disorder
伴认知障碍的10例ALD患儿的临床特征
Clinical features of 10 ALD children with cognitive disorder
| 分组依据 | 患儿例数(%) | |
|---|---|---|
| 是否伴其他临床症状 | 是 | 8(80) |
| 否 | 2(20) | |
| NFS(分) | NFS=0 | 2(20) |
| NFS>0 | 8(80) | |
| LOES评分(分) | LOES<10 | 7(70) |
| LOES≥10 | 3(30) | |
| 是否发生MFD | 是 | 6(60) |
| 否 | 4(40) | |
| 死亡或存活 | 死亡 | 2(20) |
| 存活 | 8(80) |
注:ALD:肾上腺脑白质营养不良;NFS:神经功能评分;MFD:主要功能障碍 ALD:adrenoleukodystrophy;NFS:Neurologic Function Score;MFD:major functional disability

入组ALD患儿30例分组情况
Different groups of 30 children with ALD
入组ALD患儿30例分组情况
Different groups of 30 children with ALD
| 分组依据 | 患儿例数(%) | |
|---|---|---|
| 认知障碍 | 伴 | 10(33.3) |
| 不伴 | 20(66.7) | |
| NFS(分) | NFS=0 | 16(53.3) |
| NFS>0 | 14(46.7) | |
| LOES评分(分) | LOES<10 | 24(80.0) |
| LOES≥10 | 6(20.0) |
注:ALD:肾上腺脑白质营养不良;NFS:神经功能评分 ALD:adrenoleukodystrophy;NFS:Neurologic Function Score
30例ALD患儿中,4例在移植后因原发病进展分别在移植后4、5、12、37个月死亡。死亡的ALD患儿中2例诊断急性移植物抗宿主病(GVHD),2例未诊断GVHD。1例在移植后5个月癫痫合并脑疝死亡,1例在移植后临床症状快速进展,最终因呼吸衰竭死亡,故不考虑由GVHD引起ALD患儿死亡。移植后死亡或发生MFD的ALD患儿临床特征见表5。
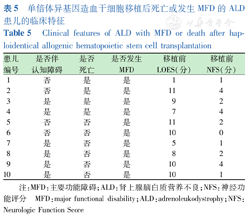
单倍体异基因造血干细胞移植后死亡或发生MFD的ALD患儿的临床特征
Clinical features of ALD with MFD or death after haploidentical allogenic hematopoietic stem cell transplantation
单倍体异基因造血干细胞移植后死亡或发生MFD的ALD患儿的临床特征
Clinical features of ALD with MFD or death after haploidentical allogenic hematopoietic stem cell transplantation
| 患儿编号 | 是否伴认知障碍 | 是否死亡 | 是否发生MFD | 移植前LOES(分) | 移植前NFS(分) |
|---|---|---|---|---|---|
| 1 | 否 | 是 | 是 | 1 | 1 |
| 2 | 否 | 是 | 是 | 11 | 4 |
| 3 | 是 | 是 | 是 | 9 | 2 |
| 4 | 是 | 是 | 是 | 7 | 4 |
| 5 | 否 | 否 | 是 | 11 | 2 |
| 6 | 否 | 否 | 是 | 10 | 0 |
| 7 | 是 | 否 | 是 | 5 | 1 |
| 8 | 是 | 否 | 是 | 8 | 2 |
| 9 | 是 | 否 | 是 | 10 | 4 |
| 10 | 是 | 否 | 是 | 10 | 1 |
注:MFD:主要功能障碍;ALD:肾上腺脑白质营养不良;NFS:神经功能评分 MFD:major functional disability;ALD:adrenoleukodystrophy;NFS:Neurologic Function Score
ALD患儿单倍体异基因造血干细胞移植后5年生存率为80.3%,LOES<10分且NFS=0分的ALD患儿移植后无MFD生存率为100.0%。所有发生MFD或死亡的ALD患儿,无论是否伴认知障碍,在移植前均有LOES≥10分或NFS>0分。
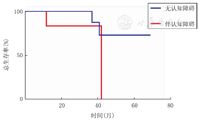
以ALD患儿在移植后发生MFD为终点事件,以Kaplan-Meier法绘制两组患儿生存曲线(图1)。
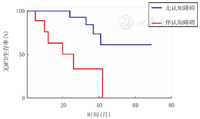

注:MFD:主要功能障碍;ALD:肾上腺脑白质营养不良 MFD:major functional disability;ALD:adrenoleukodystrophy
进行单倍体异基因造血干细胞移植的不伴认知障碍的ALD患儿,移植后5年不发生MFD的概率为61.6%。移植后3年生存率为100.0%,移植后5年生存率为72.9%。伴认知障碍的ALD患儿,移植后3年生存率为83.3%(图2)。其中伴认知障碍的ALD患者移植后随访最长时间为42个月,且因原发病进展导致死亡。

注:ALD:肾上腺脑白质营养不良 ALD:adrenoleukodystrophy
以单倍体异基因造血干细胞移植前的LOES评分和NFS对ALD患儿分组,分别以死亡以及发生MFD为结局事件进行生存分析(图3、图4)。
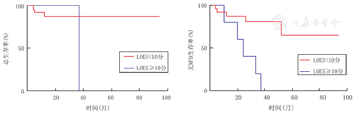

注:MFD:主要功能障碍;ALD:肾上腺脑白质营养不良 MFD:major functional disability;ALD:adrenoleukodystrophy
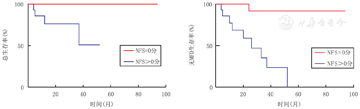

注:NFS:神经功能评分;ALD:肾上腺脑白质营养不良;MFD:主要功能障碍 NFS:Neurologic Function Score;ALD:adrenoleukodystrophy;MFD:major functional disability
进行单倍体异基因造血干细胞移植的LOES≥10分的ALD患儿,预估移植后3年生存率为100.0%,预估移植后3年无MFD率为20.0%。LOES<10分的ALD患儿,预估移植后5年生存率为87.1%,预估移植后5年无MFD率为64.7%。
进行单倍体异基因造血干细胞移植的NFS=0分的ALD患儿,移植后预估5年生存率为100.0%。NFS>0分的ALD患儿,移植后预估3年生存率为50.8%。2组生存曲线使用Long Rank检验,差异有统计学意义(P=0.014)。
进行单倍体异基因造血干细胞移植的NFS=0分的ALD患儿,移植后预估5年无MFD率为91.7%。NFS>0分的ALD患儿,移植后预估3年无MFD率为35.3%。2组生存曲线使用Long Rank检验,差异有统计学意义(P<0.001)。
通过生存分析曲线的绘制,发现伴认知障碍、LOES≥10分、NFS>0分的ALD患儿在单倍体异基因造血干细胞移植后的MFD发生率高。本研究以发生MFD为结局事件,纳入以下影响因素:(1)移植前ALD患儿LOES≥10分;(2)移植前ALD患儿NFS>0分;(3)移植前ALD患儿伴认知障碍;(4)ALD患儿的移植年龄;(5)ALD患儿的起病年龄;(6)ALD患儿的病程。首先将这6个因素进行单因素分析,将P<0.05对应的影响因素筛选后纳入多因素Cox回归模型当中(表6)。
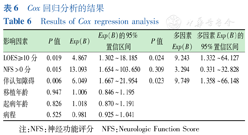
Cox回归分析的结果
Results of Cox regression analysis
Cox回归分析的结果
Results of Cox regression analysis
| 影响因素 | P值 | Exp(B) | Exp(B)的95%置信区间 | P值 | 多因素Exp(B) | 多因素Exp(B)的95%置信区间 |
|---|---|---|---|---|---|---|
| LOES≥10分 | 0.019 | 4.867 | 1.302~18.185 | 0.024 | 9.243 | 1.332~64.127 |
| NFS>0分 | 0.015 | 13.093 | 1.654~103.650 | 0.309 | 3.294 | 0.331~32.828 |
| 伴认知障碍 | 0.006 | 6.049 | 1.667~21.954 | 0.023 | 9.749 | 1.358~66.148 |
| 移植年龄 | 0.947 | 1.006 | 0.846~1.195 | |||
| 起病年龄 | 0.826 | 1.018 | 0.870~1.191 | |||
| 病程 | 0.525 | 0.981 | 0.925~1.041 |
注:NFS:神经功能评分 NFS:Neurologic Function Score
纳入的6个影响因素中的3个因素行Cox回归分析:移植前ALD患儿LOES≥10分、移植前ALD患儿NFS>0分、移植前ALD患儿伴认知障碍在单因素分析中有统计学意义(均P<0.05)。将这3个影响因素进行Cox回归分析,结果显示移植前ALD患儿LOES≥10分有统计学意义(P=0.024)。对比单倍体异基因造血干细胞移植前LOES<10分的ALD患儿,LOES≥10分的患儿在移植后发生MFD的风险是其9.243倍(95%置信区间:1.332~64.127)。单倍体异基因造血干细胞移植前ALD患儿伴认知障碍有统计学意义(P=0.023)。对比移植前不伴认知障碍的ALD患儿,伴认知障碍的患儿在移植后发生MFD的风险是其9.749倍(95%置信区间:1.358~66.148)。而移植前ALD患儿NFS>0分无统计学意义(P=0.309)。移植前ALD患儿伴认知障碍或LOES≥10分均是其移植后发生MFD的独立危险因素。
本研究是迄今单中心最大的ALD患儿行单倍体异基因造血干细胞移植的回顾性临床研究。近20年来,很少有关于ALD患者进行单倍体异基因造血干细胞移植的临床研究。全相合异基因造血干细胞移植的局限性在于,并不是每一个患者都能够匹配到相应的供者,导致无法匹配到供者的患者无法进行全相合异基因造血干细胞移植。单倍体异基因造血干细胞移植使得每一个人都可有单倍体相合的供者。随着单倍体异基因造血干细胞移植技术的成熟,儿童骨髓衰竭性疾病、遗传代谢性疾病均可使用单倍体异基因造血干细胞移植治疗[13]。
迄今世界最大的关于异基因造血干细胞移植治疗ALD的临床研究结果显示,ALD患儿移植治疗后预估5年生存率为75.0%,早期ALD患儿的生存率为100.0%,无MFD率为100.0%[8]。本研究ALD患儿总体5年生存率为80.3%,LOES<10分且NFS=0分的ALD患儿生存率为100.0%,无MFD率为100.0%。首个使用单倍体异基因造血干细胞移植治疗ALD的双中心临床研究由Fernandes等[11]于2018年发表,该研究纳入9例ALD患儿,其中4例(44.4%)移植失败,3例接受了2次移植,1例死亡。本研究纳入31例ALD患儿,1例因移植期间心源性休克死亡,其余30例(96.8%)移植成功。体外基因疗法的自体造血干细胞移植作为新出现的治疗方法,其优势为能够避免GVHD。在早期ALD患儿行体外基因疗法的自体造血干细胞移植治疗的临床研究中,1例早期ALD患儿发生了MFD。早期患儿行全相合或单倍体异基因造血干细胞移植后的无MFD率可达100%。本研究结果表明,单倍体异基因造血干细胞移植治疗ALD患儿的生存率及无MFD率与全相合异基因造血干细胞移植治疗相当。体外基因疗法的自体造血干细胞移植作为新治疗方法,虽有可避免GVHD的优势,但仍需更长的随访时间以判断其对ALD患儿的疗效[14,15]。
本研究结果表明,ALD患儿在单倍体异基因造血干细胞移植前伴认知障碍和LOES≥10分均是导致移植后发生MFD的独立危险因素。移植前NFS>0分的ALD患儿在单倍体异基因造血干细胞移植后的生存率与无MFD率亦显著低于NFS=0分的ALD患儿。在LOES与NFS评分系统方面,本研究结论与既往全相合异基因造血干细胞移植治疗ALD的临床研究一致,即移植前LOES≥10分、NFS>0分的ALD患儿的预后均较差[8]。本研究结果发现移植前ALD患儿伴认知障碍亦为移植后发生MFD的独立危险因素。由于NFS量表未纳入认知障碍相关的临床症状,可能需要制定包含认知障碍的新量表。由于样本量所限,本研究没有制作临床预测模型。期待未来能够通过多中心研究等方法,建立异基因造血干细胞移植治疗ALD的临床预测模型,并制定新的评分量表系统,进一步阐明可能影响ALD患儿单倍体异基因造血干细胞移植预后的因素。
同样由于样本量较少,本研究伴认知障碍的10例ALD患儿仅3例在移植前行韦氏智力测验,均为边缘性智力水平。本研究证实,ALD患儿伴认知障碍是单倍体异基因造血干细胞移植后发生MFD的独立危险因素,提示对伴认知障碍的ALD患儿,在移植前应进行更系统的评估。此外,本研究结果提示,LOES<10分且NFS=0分的ALD患儿在单倍体异基因造血干细胞移植后有更好的预后,临床应尽快对这部分ALD患儿进行移植,以免错过有效治疗的窗口期。
所有作者均声明不存在利益冲突



























