
探讨颅内血管外皮细胞瘤(HPC)与脑膜瘤的MRI特征,提高其临床诊断准确率。
回顾性分析经手术病理证实的16例颅内HPC和95例脑膜瘤患者的MRI资料,MRI征象分析包括肿瘤边缘及形态、肿瘤内血管流空信号、肿瘤内囊变坏死、有无硬膜尾征、肿瘤增强的程度和强化方式。
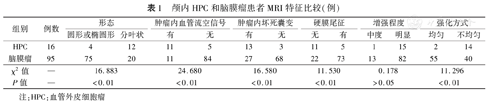
颅内HPC最大径为(5.40±1.72)cm,脑膜瘤最大径(4.43±1.35)cm,差异有统计学意义(t=2.551,P<0.05)。MRI在显示颅内HPC和脑膜瘤肿瘤边缘、肿瘤内血管流空信号、肿瘤内囊变坏死、强化方式、硬膜尾征等特征上的差异均有统计学意义(χ2=16.883、24.680、16.580、11.296、11.530,P值均<0.05);两者在增强程度上差异无统计学意义(χ2=0.178, P>0.05)。
MRI对肿瘤边缘及形态、肿瘤内血管流空信号、肿瘤内囊变坏死、强化方式、硬膜尾征等具有特征表现,对颅内HPC和脑膜瘤的鉴别诊断具有重要价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
颅内血管外皮细胞瘤(hemangiopericytoma,HPC)由Stout和Murray在1942年首次命名[1],是起源于脑膜毛细血管及微静脉Zimmerman细胞的罕见恶性肿瘤。HPC可发生于全身各个部位,最多见四肢、盆腔及腹膜后软组织。颅内HPC非常罕见,约占中枢神经系统原发性肿瘤的0.4%[2]。其临床表现、影像学特征和好发部位与脑膜瘤均十分相似,术前多误诊为脑膜瘤。笔者收集经手术病理证实的颅内HPC 16例和脑膜瘤95例,对比分析两者的MRI特征,以提高MRI在两者鉴别诊断中的准确性。
收集2008年3月–2013年11月安徽医科大学第一附属医院颅内HPC和脑膜瘤的患者资料进行回顾性分析。纳入标准:经手术标本病理学确诊;术前均行MRI平扫及增强扫描。排除标准:患者有外伤史、手术史和传染病史,术前接受过放、化疗。共纳入111例,其中颅内HPC 16例,男8例,女8例,年龄17~62岁,平均43.3岁;脑膜瘤95例,男31例,女64例,年龄26~76岁,平均54.1岁。患者主要临床表现均为头痛头晕、呕吐、视物模糊、肢体抽搐、肢体乏力、行走不稳及记忆力下降。16例颅内HPC术前MRI正确诊断1例,诊断胶质瘤和转移瘤各1例,余13例均诊断为脑膜瘤。95例脑膜瘤术前MRI正确诊断92例,诊断为星形细胞瘤、转移瘤伴卒中及良性骨源性肿瘤各1例。
采用GE Signa HDx 3.0T超导MR扫描仪(美国),8通道头颅线圈,视野22 cm×22 cm,层厚5 mm,层间距2 mm,矩阵320×224。获得轴位自旋回波T1WI(重复时间、回波时间、反转时间分别为2 000 ms、20 ms、750 ms),快速自旋回波T2WI(重复时间、回波时间分别为5 000 ms、120 ms,回波链长度26),FLAIR序列(重复时间、回波时间、反转时间分别为9 500 ms、140 ms、2 500 ms),平扫结束后经静脉注入0.1 mmol/kg钆喷替酸葡甲胺(Gd-DTPA),速率2 mL/s行增强扫描。
由2位有经验的MRI诊断医师共同阅片,如有分歧通过讨论达成一致。分析的病变MRI特征包括肿瘤边缘及形态、肿瘤内血管流空信号、肿瘤内囊变坏死、肿瘤附着硬膜类型、有无硬膜尾征、肿瘤增强的程度、肿瘤强化方式。选择海绵窦强化程度作为参考标准,肿瘤强化程度低于海绵窦者为中度强化,等于或高于者为明显强化[3]。测量肿瘤最大径。
应用SPSS 17.0统计学软件包进行统计分析。颅内HPC和脑膜瘤肿瘤最大径服从正态分分布且方差齐,以 ±s表示,采用成组设计t检验比较;颅内HPC和脑膜瘤MRI征象采用χ2检验比较。以P<0.05为差异有统计学意义。
±s表示,采用成组设计t检验比较;颅内HPC和脑膜瘤MRI征象采用χ2检验比较。以P<0.05为差异有统计学意义。
颅内HPC最大径为(5.40±1.72) cm,脑膜瘤最大径(4.43±1.35)cm,差异有统计学意义(t=2.551,P<0.05)。
颅内HPC和脑膜瘤MRI特征表现除在增强程度上差异无统计学意义(P>0.05)外,在肿瘤的边缘及形态、肿瘤内血管流空信号、肿瘤内囊变坏死、强化方式、硬膜尾征等特征上差异均有统计学意义(P值均<0.05)。见表1。见图1、图2。
颅内HPC和脑膜瘤患者MRI特征比较(例)
颅内HPC和脑膜瘤患者MRI特征比较(例)
| 组别 | 例数 | 形态 | 肿瘤内血管流空信号 | 肿瘤内坏死囊变 | 硬膜尾征 | 增强程度 | 强化方式 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 圆形或椭圆形 | 分叶状 | 有 | 无 | 有 | 无 | 无 | 有 | 中度 | 明显 | 均匀 | 不均匀 | ||
| HPC | 16 | 4 | 12 | 11 | 5 | 13 | 3 | 11 | 5 | 1 | 15 | 2 | 14 |
| 脑膜瘤 | 95 | 75 | 20 | 11 | 84 | 27 | 68 | 22 | 73 | 13 | 82 | 55 | 40 |
| χ2值 | – | 16.883 | 24.680 | 16.580 | 11.530 | 0.178 | 11.296 | ||||||
| P值 | – | <0.01 | <0.01 | <0.01 | <0.01 | >0.05 | <0.01 | ||||||
注:HPC:血管外皮细胞瘤
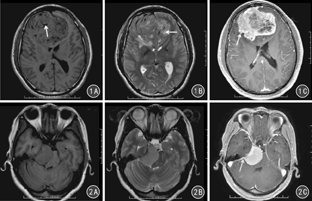

HPC属于恶性肿瘤,其细胞核异型性多、核分裂活跃,肿瘤生长速度快,且各部分生长速度不同,因此常呈分叶状。而脑膜瘤是良性肿瘤,生成缓慢,肿瘤常呈圆形、椭圆形或扁圆形。肿瘤形态上的差异,提示形态对其鉴别有一定价值,然而HPC和脑膜瘤的边界和形态特征有一定的重叠,因此在定性诊断中需要结合其他征象综合评价。本研究中,颅内HPC最大径显著大于脑膜瘤的,这可能与肿瘤的生长时间有关。
本组16例颅内HPC中11例瘤内出现粗大的血管流空信号,而95例脑膜瘤中有84例(88.4%)瘤内未发现血管流空信号,差异有统计学意义(P<0.01)。曹代荣等[4]研究发现,CTA显示颅内HPC肿块内部见多发粗大的供血动脉及颈内动脉参与供血,而脑膜瘤内则未见粗大血管。DSA术中出现多发螺旋状供血动脉为HPC特征性表现;镜下HPC内见有大量"鹿角"状血管,有的血管扩张成血窦样,有的挤压呈裂隙状;而脑膜瘤内血管小,壁薄,不同于HPC内的血管结构。因此,瘤内是否出现血管流空信号对颅内HPC的诊断及与脑膜瘤的鉴别具有较高的可靠性。
本组资料中,颅内HPC中13/16瘤内出现囊变坏死、14/16呈不均匀强化;71.6%(68/95)脑膜瘤肿瘤信号均匀、瘤内未出现囊变坏死、57.9%(55/95)呈均匀强化,差异均有统计学意义(P值均<0.01)。本组研究结果与尚海龙等[5]报道基本一致。颅内HPC具有恶性潜能,其生长速度快、侵袭性生长、丰富的供血血管中存在不成熟的血管,所以易发生囊变、坏死出血[6]。肿瘤中出现出血、坏死、囊变,其MR信号必然不均匀,同时囊变坏死区不强化,增强后肿瘤即表现为不均匀性强化。而脑膜瘤生长速度缓慢,肿瘤血管较成熟,因此肿瘤内出血、坏死囊变少见,多表现为均匀性强化。
硬膜尾征形成一方面是由于硬脑膜受到肿瘤长时间的刺激与侵袭,从而反应性增厚、纤维细胞和毛细血管增殖而生成;另一方面亦可因肿瘤通过硬膜延伸而引起。本组资料中76.8%(73/95)的脑膜瘤可见硬膜尾征,而11/16的颅内HPC中未见硬膜尾征,差异有统计学意义。脑膜瘤中出现硬膜尾征的频率较高也符合其生长缓慢的特点;而HPC生长速度快、生长时间短,对硬膜刺激还无法形成脑膜尾征[7]。潘锋等[8]研究认为,硬膜尾征对颅内HPC与脑膜瘤鉴别无统计学意义(P>0.05),与本组统计结果存在差异,可能与样本的数量或病例分析的标准不同有关。
由于颅内HPC发病率低,本次收集病例数与脑膜瘤相比较少,并且脑膜瘤患者中没能纳入全部亚型,所以得到的结论或许不够全面。根据临床经验,具有典型影像学脑膜瘤还是容易与颅内HPC鉴别的,主要是Ⅱ~Ⅲ级脑膜瘤与颅内HPC难鉴别,以后随着临床病例的增多,拟对脑膜瘤全部亚型与颅内HPC鉴别。尽管如此,本研究初步证实MRI在鉴别HPC和脑膜瘤方面具有一定价值,综合考虑肿瘤的边缘及形态、肿瘤内流空血管信号、肿瘤内囊变坏死、强化方式、硬膜尾征等有助于提高HPC的正确诊断及与脑膜瘤的鉴别,可为临床医生制定更加合理、更有针对性的治疗方案提供依据。



























