
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
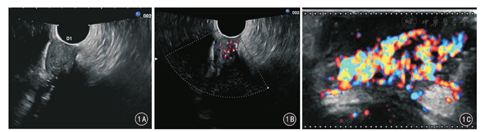
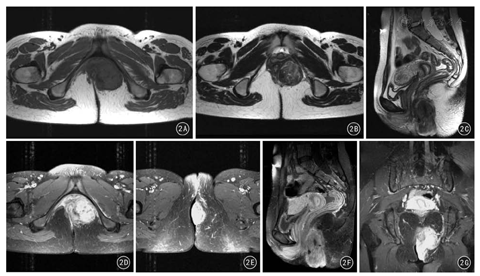
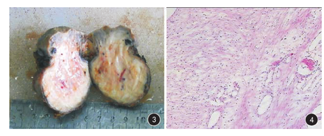
患者女,23岁,2015年1月发现肛周左侧臀部皮下肿物,伴间断胀痛,无发热、恶心、呕吐、腹痛、腹泻等症状,无便血,自以为"痔疮",就诊于当地医院,临床诊断"痔疮合并感染"予以抗感染治疗,肛周疼痛症状缓解,但肿物未见缩小。2015年6月再次出现肛周胀痛,遂二次就诊初诊医院,并以"肛周脓肿、肛瘘"行肛周肿物切除术,术中发现肿物为肛周皮下并累及深部实性软组织肿瘤,未予切除,建议至上级医院进一步治疗。2015年6月16日,患者就诊于山西省肿瘤医院,以"肛周肿物"收住院。患者自发病以来精神、食欲、睡眠可,大、小便正常,无明显消瘦。入院后行血常规、尿常规、凝血5项、肝肾功能、乙肝系列、人类免疫缺陷病毒等实验室检查,结果均无异常。经直肠超声检查提示肛门左侧皮肤及皮下软组织内实性不均质低回声病变,形态欠规则,边界较清,见低回声纤维包膜;彩色多普勒血流显像(color Doppler flow imaging, CDFI)检测见丰富血流信号(图1)。MRI提示:肛门左侧皮肤及皮下深部软组织内见软组织信号影,范围约5.3 cm×4.1 cm ×4.0 cm,信号不均匀,T1WI与肌肉呈等信号,T2WI呈中、高混杂信号,病变内见点状、小灶状低信号区,DWI呈不均匀等信号,注射对比剂钆喷酸葡胺注射液增强扫描呈明显强化,强化区域似呈条带状、旋涡状强化,病变内点状及灶状低信号区未见强化(图2)。患者于2015年6月22日在全身麻醉下行臀部肛周肿物切除术。术中见肿物位于肛门左后方3 cm处,皮肤表面可触及的肿瘤直径约4 cm,色白、质硬。沿肿物边缘切开皮肤,仔细分离肿物与周围组织粘连,避免损伤肛门括约肌及直肠,完整游离肿物,切除标本送病理检查。大体标本见:附皮肤软组织一块,大小6 cm×5 cm×4 cm,皮肤大小5.5 cm×4.5 cm;皮肤表面可见一隆起,范围4.5 cm×4 cm,肿物切面灰白、质韧。术后病理检查提示:镜下瘤细胞呈梭形,围绕血管呈束状、结节状排列;免疫组织化学检测:AE1/AE3阴性,Vimentin阳性,S-100阴性,平滑肌肌动蛋白阳性,CD34阳性,Ki67约2%,β-catenin阳性。病理诊断:血管平滑肌瘤(图3、图4)。



皮肤血管平滑肌瘤(cutaneous angioleiomyoma,CAL)是一种良性软组织肿瘤[1],由Stout于1937年首次报道[2]。CAL好发于30~50岁女性,女∶男为1.7∶1,多为单发,可发生于全身各处,最常见于下肢,其次是头颈部和躯干部,也有发生于颅内、头皮、耳廓、鼻前庭等部位的报道[3,4,5]。临床上,CAL位于真皮深层或皮下脂肪组织内,多为孤立且伴有疼痛的结节,直径多<2 cm[3]。本例瘤体较大,最长径达6 cm,较为罕见。Hachisuga等[3]报道50%的患者出现典型的轻中度疼痛症状,50%~70%的患者表现为自发痛、触痛,甚至体温改变引起的疼痛。手术切除是治疗CAL的唯一方法,术后复发率较低。Hachisuga等[3]报道562例CAL患者中仅有2例复发。
CAL起源于血管的平滑肌组织,病理形态表现为增生的平滑肌束围绕在血管周围呈肿瘤性生长,呈致密的漩涡状排列,切面灰黄、灰白。光镜下肿瘤细胞形态类似于正常的平滑肌细胞,HE染色胞质嗜酸性、嗜品红。大的平滑肌瘤内常见纤维化、玻璃样变、钙化和黏液变等[5]。CAL依据分化成熟的平滑肌束和血管组成比例,病理上分为实体型、静脉型和海绵型。实体性较常见,约占全部CAL的80%[3]。免疫组织化学检查显示平滑肌细胞表达梭形细胞平滑肌肌动蛋白、vimentin、desmin阳性,血管内皮细胞CD34阳性,而HMB45、Melan-A、CD117均为阴性。因此,CAL与血管平滑肌脂肪瘤不是同一类型病变[6,7]。
CAL术前影像学检查主要依赖超声、CT及MRI检查,对判断肿瘤大小、位置、侵犯范围、与周围组织关系、血供提供参考。传统X线检查对该病诊断价值有限,仅表现为病变部位软组织肿胀,对钙化的CAL较为敏感;当病灶邻近骨质或关节时,X线检查具有一定价值[5,8]。CT的检出率较X线高,对显示病变位置、大小、周围关系具有一定优势[9]。
超声检查是诊断此类病变的常用方法。CAL的超声声像图表现为圆形、椭圆形、边界清晰的不均质低回声肿块,可见包膜回声,包膜主要为纤维性假包膜。超声声像图的回声高低与病变内部的病理改变有关。本例患者超声检查肿瘤内部呈均匀的低回声,与病灶内部的平滑肌纤维细胞及平滑肌束排列规整、界面少相关。CDFI显示肿瘤血流信号丰富,与肿瘤内部血管数目相应较多、管腔内径较大、流速快及血流丰富有关。CDFI对CAL诊断具有特殊重要意义。CDFI的血流信号强度与CAL血流分级及病理类型相关[10,11],丰富的彩色血流信号以Alder Ⅲ级者多见[10,11,12]。超声引导穿刺活检术可以明确诊断CAL,适用于部分术前不能确定诊断或无法鉴别良恶性肿瘤的患者[10]。
MRI软组织分辨率高、多方位成像对显示软组织肿瘤具有较大优势。MRI图像上,CAL多表现为T1WI低信号,T2WI为高信号病变内夹杂斑点状、小灶状均匀或混杂低信号。一般认为高信号代表血管和平滑肌细胞成分,低信号代表血管内血栓、泥沙样或斑点状钙化。病灶内部的平滑肌和血管的比例多少,是否伴发出血、血栓及钙化,是MRI信号的病理基础。本例DWI亦呈中等信号强度,可能与肿瘤细胞密度相对较小、细胞外间隙较大,对水分子限制较小,导致水分子弥散增高有关;注射钆喷酸葡胺后,T2WI高信号区域呈持续性明显、漩涡状强化,可能与肿瘤血管和固有平滑肌排列形态有关;另外,注射钆喷酸葡胺后增强扫描,肿瘤明显强化再次印证了CAL为富血供肿瘤。CAL的纤维性假包膜在T1WI、T2WI呈低信号,增强扫描强化不明显。MRI对显示漩涡状强化结构较敏感,对诊断CAL具有一定特异性[13,14]。
CAL在影像上需与脂肪瘤、肌纤维母细胞瘤、神经纤维瘤、神经鞘瘤、孤立性纤维瘤等软组织肿瘤鉴别。脂肪瘤诊断较易,超声、CT、MRI敏感性均较高。肌纤维母细胞瘤亦属于间叶源性软组织肿瘤,影像表现与CAL相似,但瘤体通常较小,缺乏分层状结构,术后很少复发。神经纤维瘤罕见发生于臀部。神经鞘瘤T2WI信号较CAL高,多见坏死,呈不均匀明显强化。孤立性纤维瘤呈实体瘤,T2信号较低,增强扫描呈中度均匀强化,较易鉴别[14]。
尽管CAL罕有发生于会阴部,但依据典型的超声、MRI影像学表现,结合病史,不难诊断臀部血管平滑肌瘤。术前影像学检查可评价臀部血管平滑肌瘤的大小、病变范围,可为术式选择提供依据。


























