
探讨手指屈肌腱粘连的原因、治疗及预防的研究进展。
以指屈肌腱、肌腱粘连、肌腱愈合为关键词,在PubMed、CNKI、万方数据等数据库中使用计算机检索2016年6月之前的有关手指屈肌腱粘连的原因、治疗及预防的相关文献,进行分析总结。
手指屈肌腱粘连原因是因为屈肌腱损伤和腱周环境的破坏,导致外源性愈合参与过多形成肌腱粘连。通过手术锐性分离肌腱粘连组织,修复或重建腱周组织,可治疗屈肌腱粘连;而通过应用生物屏障、采用防粘连药物和改良的缝合方法等能有效预防屈肌腱粘连。
根据手指屈肌腱粘连原因,屈肌腱粘连应以预防为主。在损伤修复过程中,行多种方法综合干预,可有效减少手指屈肌腱粘连的发生。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
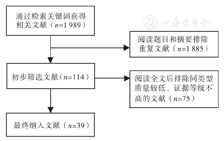
手指屈肌腱位于较表浅的皮下,缺乏保护,经常会受到撕裂伤、挤压伤、断裂伤等[1],屈肌腱损伤后的修复问题成为了学者关注的焦点,术后粘连问题也成为了临床上待解决的难题。本文以"Tendon adhesion""Tendon healing",以及"指屈肌腱""肌腱粘连""肌腱愈合"作为关键词,在PubMed、CNKI、万方数据等数据库中使用计算机检索1969年3月—2016年6月有关手指屈肌腱粘连的原因、治疗及预防的相关文献,共查阅文献1 989篇,删除1 950篇,最终纳入39篇(图1)。

手指屈肌腱位于手的掌侧,由指浅屈肌腱、指深屈肌腱各4条以及1条拇长屈肌腱构成。屈指肌腱共分为5个区:Ⅰ区,仅有指深屈肌腱穿过,损伤后易导致关节挛缩和肌腱滑动性减弱;Ⅱ区,有着狭长并且硬韧的纤维鞘管,在鞘管内包着3条肌腱,此区肌腱发生损伤后经常发生肌腱粘连;Ⅲ区,包括指浅屈肌腱、指深屈肌腱共8条,在屈肌腱损伤修复术后6周内需要将把手维持在保护性姿势(掌指关节屈曲、指间关节伸直位),会导致屈肌腱粘连;Ⅳ区即腕管区,该区通过9条肌腱和正中神经,空间小并且没有缓冲的空间,术后肿胀易导致肌腱粘连;Ⅴ区肌腱被四周的松软组织包绕,术后一般较少肌腱粘连。此分区方法临床应用广泛。Moiemen等[2]根据各个屈肌腱鞘滑车的位置关系将Ⅰ区分为3个亚区:Ⅰa区即A5腱鞘滑车远端以远区域,Ⅰb区即A5腱鞘滑车远端到A4腱鞘滑车远端,Ⅰc区即A4腱鞘滑车远端到指屈肌腱止点远端。而汤锦波等[3]根据Ⅱ区屈肌腱解剖特点将此区细分成4个亚区:Ⅱa区即从指浅屈肌腱止点远端到止点近端;Ⅱb区即从指浅屈肌腱止点近端到A2腱鞘滑车远端;Ⅱc区即A2腱鞘滑车区域;Ⅱd区即A2腱鞘滑车近端到滑膜鞘反折处。
屈肌腱损伤后,有内源性和外源性两种方式参与愈合过程。20世纪60年代前,主流思想是外源性愈合观点,认为肌腱周围的滑膜及皮下组织在损伤处产生肉芽组织,并且腱外膜中的成纤维细胞向断端增殖,导致肌腱粘连。Potenza等[4]通过对犬屈肌腱进行模拟实验,用导管将肌腱与周围组织分开,愈合受到抑制,得出结论:肌腱愈合通过腱鞘及其周围组织生成的肉芽组织的长入得以实现,即肌腱愈合是靠肌腱和周围组织的粘连而完成的。20世纪70年代,持内源性愈合观点的学者认为,肌腱细胞经过自身增殖和迁移完成修复,可以避免肌腱粘连。Lundborgs等[5]实验发现,屈肌腱通过滑液获得营养,在没有发生粘连时,肌腱自身可以愈合。20世纪90年代以来,多数学者认为内、外源性愈合同时存在于屈肌腱损伤的愈合过程中[6]。Khan等[7]报道兔屈肌腱损伤后早期,滑膜鞘、腱内膜和腱外膜细胞共同参与修复过程,通过促进肌腱细胞增殖和抑制腱周细胞的增殖,可以达到预防肌腱粘连的目的。
随着分子生物学发展,在分子水平探讨手指屈肌腱粘连的变化日益受到学者们关注。Berglund等[8]模拟修复兔屈肌腱损伤实验,发现在肌腱损伤后,转化生长因子β1(transforming growth factor beta1, TGF-β1)表达活性增强,改变了局部环境,促进肌腱Ⅰ型胶原的合成,与肌腱粘连密切相关。Sahin等[9]通过实验证明,血管内皮生长因子和基质金属蛋白酶在术后7天含量升高,诱导新血管形成,成为肌腱粘连的一个因素。Banes等[10]通过鸟类肌腱实验,发现胰岛素样生长因子和血小板衍生生长因子可以被损伤的肌腱细胞迅速激活,促进周围成纤维细胞迁移和分化,导致肌腱粘连。
手指肌腱有明显粘连且影响手指活动时,Derby等[11]主张手术行肌腱粘连松解术,腱鞘滑车周围的粘连常常比较致密,需要锐性切割分离粘连结构,手术时应保护A2和A4腱鞘滑车。Lalonde等[12]提出在臂丛麻醉下行肌腱粘连松解手术,可以部分切开滑车,粘连的肌腱松解更加彻底,术后仔细止血,放置引流条。肌腱的营养直接影响肌腱生存的状态和肌腱修复的效果,腱系膜在不同部位局部转变形成腱纽,供养在腱纽内部通过的肌腱、神经、血管[13]。指屈肌腱缺少血供,腱旁组织、腱系膜和腱纽成为其主要营养来源。屈肌腱各区营养的供应有血液灌注和滑液扩散两种途径。Manske等[14]通过实验证明屈肌腱的营养是双重的,肌腱血供呈阶段性分布,腱鞘的滑液则可以营养无血管区。保证肌腱充足的营养,可以促进肌腱损伤的内源性愈合,抑制肌腱粘连。
目前,治疗屈肌腱损伤公认的原则是:早期修复,预防术后肌腱粘连。屈肌腱损伤的修复方式是手术缝合修复。胡明山等[15]通过与传统手术方法对比认为,显微手术修复手指肌腱损伤,可以抑制粘连发生。余林权[16]等应用精细的显微外科技术吻合断裂的肌腱,提高肌腱修复效果,减少肌腱粘连发生。张开欣等[17]通过切取自体部分鹅足囊修复破损的腱鞘,对屈肌腱形成机械保护,腱鞘分泌的滑液能够营养肌腱并促使其滑动,有效预防肌腱粘连。
合适的手术缝合方法不仅能减小肌腱滑动的摩擦力,促进肌腱的功能恢复,还可以预防肌腱粘连。手术缝合方法从间断缝合法、Kessler缝合法、双十字缝合法、Tsuge缝合法、Becker缝合法到各种改良的缝合方法,使术后肌腱质量不断改善[18]。苏云等[19]改良的埋结缝合方法可以保证肌腱表面光滑,减少肌腱断端的摩擦阻力,有效预防肌腱粘连。潘张军等[20]通过对比不同缝合方法认为,汤氏缝合法促进肌腱对合完整,抗拉强度大,可以有效抑制肌腱粘连。
Karaaltin等[21]在鸡屈肌腱损伤模型实验中发现,5-氟尿嘧啶能起到良好地促进肌腱滑动的效果,有效地预防肌腱粘连。陈帅等[22]在白兔第3趾屈肌腱损伤区应用一类抑制细胞因子释放或者抑制炎性反应的药物,达到有效预防粘连的效果。Xia等[23]在白兔屈肌腱吻合术后应用6-磷酸果糖治疗的研究中发现,6-磷酸果糖可以抑制TGF-β1和Ⅰ型胶原mRNA的表达,进而预防肌腱粘连的产生。Tan等[24]在白兔肌腱修复术后应用非甾体类抗炎药物治疗的实验中发现,布洛芬可抑制环氧化酶-1和环氧化酶-2,减少肌腱粘连。
研究显示,通过各种生物屏障把外源性愈合阻断,可以预防肌腱粘连[25]。随着材料科学的发展,学者尝试利用屏障隔离肌腱和周围组织,促进内源性愈合[26]。Ni等[27]在白兔跟腱修复术中利用静电纺丝包裹肌腱形成屏障,有效抑制肌腱粘连。生物屏障现在比较流行的是药物膜,一方面通过屏障作用抑制肌腱粘连,另一方面可以通过药理作用减轻肌腱粘连。Chen等[28]通过兔趾深屈肌腱实验,证明了应用透明质酸不仅对肌腱有营养、润滑作用,而且可以促进肌腱细胞增殖抑制肌腱粘连。Liu等[29]通过在鸡屈肌腱术中加入纤维膜实验发现,对比不加入纤维膜治疗的对照组,负载布洛芬的纤维膜抑制肌腱粘连的效果更佳。
肌腱损伤采用如红外线、分米波、超声波等物理治疗在临床上得到了广泛应用并且疗效明显。术后应用物理治疗可以促进肌腱的内源性愈合、减轻局部肿胀和软化瘢痕组织。王春渤等[30]在手指肌腱损伤修复术后每日采用红外线治疗,结果证明红外线可以预防肌腱粘连。田德虎等[31]通过96只来亨鸡的足趾模拟肌腱损伤,术后每日照射分米波10 min,结果发现肌腱粘连疏松,证明分米波可以抑制肌腱粘连。刘沐青等[32]临床研究结果显示,低强度脉冲超声波明显提高患手功能,减轻肌腱粘连。
手指屈肌腱损伤修复术后康复锻练能有效地预防肌腱粘连形成,是一种防止肌腱粘连的重要措施。术后的康复锻炼一方面可以抑制成纤维细胞长入肌腱损伤处;另一方面可以促进肌腱细胞的增殖,同时促进肌腱细胞向肌腱断裂处的迁移,在一定程度上加速了内源性愈合[33]。早期功能锻炼还可诱发新的血管再生,同时可以促使肌腱塑形,增加愈合的强度,通过术后康复锻炼预防肌腱粘连的理论被广泛接受[34];但是,肌腱修复术后手指的主动活动又容易诱发屈肌腱再断裂。所以,保持两者平衡是一个技术性难题。与传统肌腱修复术后石膏固定3周对比,汤锦波等[35]提出,在医生指导下,手指屈肌腱损伤患者应在术后3~4 d开始被动的轻柔活动,过迟活动则易发生肌腱粘连。
随着对分子及基因治疗研究的不断深入,细胞因子及基因治疗为肌腱损伤后功能恢复提供有效的解决方法。通过实验,柯尊山等[36]证明了核因子、Erk2、STAT3、STAT5和Smad2基因等在肌腱粘连形成过程中发挥重要作用,为将来在基因水平预防肌腱粘连提供新的思路。Loiselle等[37]利用TGF-β抗体降低TGF-β1生成,减少肌腱粘连,在肌腱损伤后预防粘连中起到一定作用。Chen等[38]利用慢病毒作载体,完成滑膜细胞的转染,滑膜蛋白过表达刺激滑膜细胞的增殖形成生物膜包绕腱周和促进透明质酸合成酶2合成透明质酸,有效地减少了肌腱粘连发生,达到防止肌腱粘连的效果。细胞因子及基因的调控在一定程度上影响着内、外源性愈合的过程,所以应该调节其表达水平,抑制外源性愈合,减轻肌腱粘连[39]。
手指屈肌腱的粘连问题在手外科领域越来越被人们重视,屈肌腱损伤修复后保证手部功能恢复仍是极具挑战性的难题。随着对肌腱愈合生物学认识的深入和对屈肌腱粘连机制的研究,对于屈肌腱粘连应以预防为主,通过改变肌腱局部环境、改良手术缝合方法、物理治疗、术后早期康复锻炼、细胞因子和基因转移治疗等多种途径,抑制肌腱外源性愈合,减少肌腱粘连的发生。在今后的研究中,进一步探讨屈肌腱粘连发生的解剖机制和预防方法,并将其应用于临床,对促进屈肌腱损伤修复技术的进步具有重要意义。



























