
探讨四肢骨巨细胞瘤(GCT)的外科治疗方法及其临床疗效,评估影响复发的因素及辅助治疗的必要性。
回顾性分析2004年1月—2017年1月西安交通大学医学院附属红会医院骨病肿瘤科收治的154例四肢GCT患者的临床资料。其中男79例,女75例;年龄16~68岁。Campanacci影像学分级:Ⅰ级16例,Ⅱ级106例,Ⅲ级32例。Enneking外科分期:1期56例、2期61例、3期37例。根据患者年龄、GTC病灶部位、Campanacci影像学分级、Enneking外科分期采用不同手术方式,其中病灶刮除+植骨/骨水泥填充(A组)64例、病灶刮除+辅助治疗+植骨/骨水泥填充(B组) 48例、病灶段切除+缺损部位重建(C组)42例。观察患者术后骨愈合情况,并发症发生情况。定期复查X线片,观察病灶转移、复发情况。术后6个月根据骨骼肌肉系统肿瘤协会(MSTS)制定术后重建功能评定标准评定临床疗效。采用χ2检验分析GCT术后复发情况。
所有患者手术顺利完成,术后伤口一期愈合,围手术期未出现异常及手术相关并发症。手术时间80~240 min,平均130 min;术中出血量150~800 mL,平均350 mL。154例患者随访10~84个月,平均40个月。术后随访X线片示植骨病例均融合,融合时间4~8个月,平均6个月。随访期间未发现内植物松动、断裂以及内植物周围感染等相关并发症,未发现肺转移者。局部复发16例(10.4%,16/154),复发时间为术后6~36个月,平均18个月。A组复发率10.9%(7/64),B组复发率10.4%(5/48),C组患者复发率9.5%(4/42)。不同性别、年龄段、肿瘤部位、Campanacci影像学分级、Enneking外科分期的患者术后局部复发率差异均无统计学意义(P值均>0.05);采用辅助治疗的B组与无辅助治疗A组比较,术后复发率差异无统计学意义(χ2=0.008, P>0.05)。术后6个月按MSTS术后重建功能评定标准评定疗效:优84例,良43例,中19例,差8例,满意率94.8%(146/154)。
根据Enneking外科分期以及Campanacci影像学分级选择合适手术方式治疗四肢GCT能够获得满意的疗效。患者性别、年龄、肿瘤部位、Campanacci影像学分级、Enneking外科分期及手术方式不能准确预测GCT患者术后病灶是否复发,术中辅助治疗的必要性有待进一步证实。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
骨巨细胞瘤(giant cell tumor of bone, GTC)是一种好发于长骨干骺端的原发性骨肿瘤,占原发骨肿瘤的3%~5%,占原发良性骨肿瘤的15%[1]。股骨远端、胫骨近端、肱骨近端、桡骨远端为最常见的发生部位。目前GTC组织发生关系尚不明确,组织学与临床过程间的关系亦不清楚,且20%~30%患者有持续进展的潜在恶性,组织学上没有恶变就可发生转移,因此很难预测GTC患者的预后。大宗资料报道GTC术后复发率可达4%~50%[1,2]。本研究中,回顾性分析2004年1月—2017年1月西安交通大学医学院附属红会医院收治的154例四肢GTC患者的临床及随访资料,探讨GTC的外科治疗方法及其临床疗效,评估影响复发的因素及辅助治疗的必要性。
纳入标准:(1)经临床、影像学及病理学诊断为GTC患者;(2)在我院接受初次手术治疗患者;(3)术后随访时间≥10个月。排除标准:(1)恶性GTC;(2)外院治疗后因局部复发或并发症等来我院治疗者。
共纳入154例四肢GTC患者,男79例、女75例,年龄16~68岁;病程2周~1年,平均1.5个月;临床均表现为局部疼痛、肿胀伴功能障碍。肿瘤均为单发病灶,其中肱骨近端18例、远端6例,桡骨远端15例,股骨近端10例、远端57例,胫骨近端24例、远端10例,腓骨近端8例,跟骨4例,距骨2例。患者术前均行病变部位X线、CT及MRI检查:X线及CT检查显示病灶呈溶骨性破坏,骨干侧见筛孔样改变,骨端见骨皮质膨胀、变薄;MRI显示周围软组织未受累积92例,周围软组织受累积但无肿块30例、周围软组织肿块形成32例。按照Campanacci影像学分级[3]:1级16例,2级106例,3级32例。根据Enneking外科分期[4]:1期(静止性)56例,2期(活跃性)61例,3期(侵袭性)37例。
根据患者年龄、GTC的部位及Campanacci影像学分级、Enneking外科分期采用不同手术方式。
设为A组,共64例。适用于病灶较小,关节软骨下骨皮质完整,Campanacci影像学分级Ⅰ、Ⅱ级,Enneking外科分期1期患者。全身麻醉。术中充分显露病变区,凿开病灶相对薄弱的一侧骨皮质开窗,充分显露病灶上下极,直视下彻底刮除病灶各个角落,尤其病变内壁的骨嵴。彻底刮除病灶并用磨钻处理内壁后,年龄≥60岁患者采用骨水泥填充,年龄<60岁患者采用自体或异体骨植入。本组中自体骨植骨填充18例,异体骨填充29例,骨水泥填充17例。
设为B组,共48例。适用于病灶较大(骨髁皮质破坏在25%~50%,骨横截面骨破坏在50%~80%,髁关节面破坏25%~50%),关节软骨下骨皮质完整,Campanacci影像学分级Ⅱ级,Enneking外科分期2期患者。全身麻醉。开窗彻底刮除病灶后高速磨钻处理内壁,再用10% NaCl注射液及95%医用乙醇浸泡瘤腔辅助治疗。髁关节面破坏<50%用自体骨和人工骨混合植入空腔;髁关节面破坏≥50%的复发风险较大者用骨水泥填充。最后接骨板坚强固定。本组采用自体骨与异体骨混合植骨33例,骨水泥填充植骨15例。
作为C组,共42例。适用于病灶大,骨质破坏严重,对于关节软骨下骨皮质不完整的关节,有软组织包块,Campanacci影像学分级Ⅲ级,Enneking外科分期3期患者。全身麻醉。分离显露病灶,完整切除病灶,重建缺损。发生于桡骨的GTC主要采用桡骨远端病灶切除,自体腓骨腕关节重建内固定术。发生于大关节的GTC采用病灶切除后异体骨关节移植、自体腓骨移植膝关节融合或假体重建术。本组病例人工关节假体重建19例,自体骨段重建(自体腓骨代桡骨重建腕关节)17例,自体腓骨移植膝关节融合4例,同种异体半关节移植2例。
术后常规使用抗生素治疗,引流液<30 mL/d拔除引流管并停用抗生素。上肢制动,下肢避免负重,必要时辅以支具。1周内进行患肢等长运动,2周后行等张运动。自体腓骨代桡骨重建腕关节者,术后6周去除外固定,拔除克氏针进行功能锻炼。下肢病灶段切除假体重建者引流管拔除后行连续被动运动仪(continuous passive motion,CPM)功能锻炼,4周后下床采用代步器锻炼。术后第1年每3个月复查1次,第2、3年每4个月复查1次,3年以后每6个月复查1次,5年以后每年复查1次。患者随访时,行局部体检、手术部位的X线检查,Campanacci影像学分级Ⅲ级者,怀疑复发或有肺部症状时行CT检查。
观察患者术后骨愈合情况,并发症发生情况。定期复查的X线片,观察病灶转移、复发情况。术后6个月根据骨骼肌肉系统肿瘤协会(Musculoskeletal Tumor Society,MSTS)制定术后重建功能评定标准评定临床疗效。
MSTS制定的骨骼肌肉系统肿瘤手术治疗后重建功能评估系统,对患者的肢体疼痛、功能活动、情感感受以及上肢的手部位置、手精细操作、抬举能力或者下肢支持物的使用、行走功能和步态进行评分,每项评分满分为5分,共30分:优,24~30分;良,18~23分;中,12~17分;差,<12分。优、良、中均属疗效满意,差为疗效不满意。
应用SPSS 16.0统计软件对数据进行分析。计数资料采用χ2检验。以P<0.05为差异有统计学意义。
患者均顺利完成手术,术后伤口一期愈合,围手术期未出现手术相关并发症。手术时间80~240 min,平均130 min。术中出血量150~800 mL,平均350 mL。
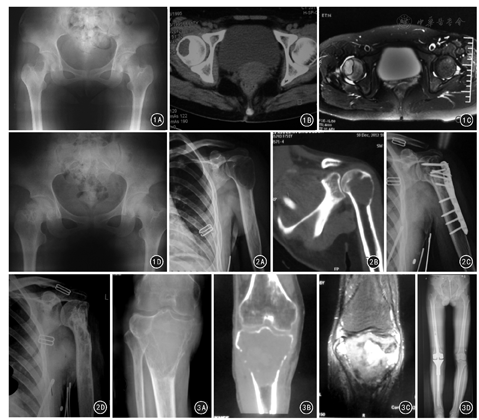
154例患者随访10~84个月,平均40个月。术后随访X线片示植骨均融合,融合时间4~8个月,平均6个月。随访期间无内植物松动、断裂,内植物周围无感染、骨折等相关并发症。154例患者中,局部复发16例,复发率10.4%;复发时间为6~36个月,平均18个月。未发现肺转移者。采用辅助治疗的B组与无辅助治疗的A组比较,术后复发率差异无统计学意义(χ2=0.008,P>0.05)。不同性别、年龄段、肿瘤部位、Campanacci影像学分级、Emnebing外科分期及手术方式的患者术后局部复发率比较,差异均无统计学意义(P值均>0.05)。见表1。MSTS骨骼肌肉系统肿瘤手术治疗后重建功能评定标准评定疗效:优84例,良43例,中19例,差8例,疗效满意率94.8%(146/154)。典型病例见图1,图2,图3。
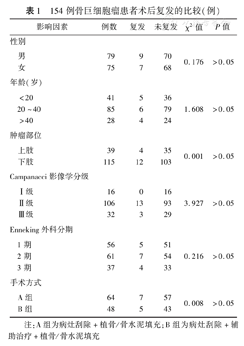
154例骨巨细胞瘤患者术后复发的比较(例)
154例骨巨细胞瘤患者术后复发的比较(例)
| 影响因素 | 例数 | 复发 | 未复发 | χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 性别 | ||||||
| 男 | 79 | 9 | 70 | 0.176 | >0.05 | |
| 女 | 75 | 7 | 68 | |||
| 年龄(岁) | ||||||
| <20 | 41 | 5 | 36 | |||
| 20~40 | 85 | 6 | 79 | 1.608 | >0.05 | |
| >40 | 28 | 4 | 24 | |||
| 肿瘤部位 | ||||||
| 上肢 | 39 | 4 | 35 | 0.001 | >0.05 | |
| 下肢 | 115 | 12 | 103 | |||
| Campanacci影像学分级 | ||||||
| Ⅰ级 | 16 | 0 | 16 | |||
| Ⅱ级 | 106 | 13 | 93 | 3.927 | >0.05 | |
| Ⅲ级 | 32 | 3 | 29 | |||
| Enneking外科分期 | ||||||
| 1期 | 56 | 5 | 51 | |||
| 2期 | 61 | 7 | 54 | 0.216 | >0.05 | |
| 3期 | 37 | 4 | 33 | |||
| 手术方式 | ||||||
| A组 | 64 | 7 | 57 | 0.008 | >0.05 | |
| B组 | 48 | 5 | 43 | |||
注:A组为病灶刮除+植骨/骨水泥填充;B组为病灶刮除+辅助治疗+植骨/骨水泥填充

GTC临床上表现为良性,但是其局部较强的侵袭性受到高度重视。目前,Enneking外科分期以及Campanacci影像学分级依然是选择合适外科手术方式治疗GTC的重要依据。原发GTC若侵犯关节面,骨皮质仍完整,周围无明显软组织肿块,首选囊内病灶刮除术[13],以最小限度的创伤保留相邻关节;而广泛切除重建术适用于出现广泛骨破坏伴有大的软组织包块、不可能保存关节的Campanacci影像学分级Ⅲ级肿瘤或者只有牺牲较多骨质才得以控制的肿瘤。Klenke等[5]对46例GCT复发病例进行分析,认为复发率的高低与手术方式有关。而国内研究报道,GCT的手术方式不是影响GCT复发的因素,其中扩大刮除术治疗GCT可以获得与切除术类似的局部控制,推荐使用;而切除术则需要根据适应证进行选择[6,7]。Abat等[8]研究结果显示,GCT的Campanacci影像学Ⅰ、Ⅱ级采用病灶刮除植骨和高速磨钻处理内壁治疗在长期随访后获得良好疗效;Campanacci影像学分级Ⅲ级需要肿瘤段整块切除和重建,术后总体复发率25.8%。这与本研究中手术方式的选择标准相似,但本研究中总体复发率10.4%,并且加辅助治疗的B组与无辅助治疗的A组比较,复发率差异无统计学意义。虽然囊内刮除仍然是初发GCT的标准治疗方法,但对于复发的GCT,是否优先选用囊内刮除而不是广泛切除仍有争议。对于外科治疗后反复复发的难治性GCT患者,手术作用十分有限,首选非手术治疗[9]。国内研究报道,桡骨远端GCT围手术期用药可降低手术难度,从而实现外科降级并降低复发风险[10]。笔者认为,对于复发患者仍可按Enneking外科分期以及Campanacci影像学分级选择外科治疗方案。
Campanacci影像学分级有助于初次手术治疗方案的制定,但分级与复发率是否有相关性仍存在争议。徐海荣和牛晓辉[7]报道,GCT的影像学特点不是影响GCT复发的因素。但也有学者认为Campanacci影像学分级Ⅲ级患者GCT复发率较高[11]。Campanacci等[3]认为,复发率与Campanacci影像学分级没有关系,GCT复发似乎反映了治疗不充分[3]。虽然理论上Campanacci影像学分级级别越高侵袭性相对较强,但GCT复发率与影像学分级没有相关性,Campanacci影像学分级高的患者复发率不一定高[12]。本研究中,不同Campanacci影像学分级患者的术后复发率无差异,与文献报道结果一致。
理论上辅助治疗可将病灶囊内刮除后残余的瘤组织经过热作用(液氮、骨水泥)或化学作用(石碳酸、过氧化氢、乙醇)进一步清除。为降低复发率,大多数学者建议使用辅助剂如:苯酚、液氮、过氧化氢、乙醇、双磷酸盐、地诺单抗等[13,14,15,16]。临床上各种方法选择主要是根据术者的个人经验和习惯,临床应用经验已证实其可以降低复发率。但是,目前辅助治疗是否能够降低GCT患者术后复发率仍有争议。有报道表明对于初发或复发的GCT,联合应用辅助治疗可以降低局部复发[5,17,18]。而另有报道认为,辅助治疗并未降低局部复发率:张帅等[19]使用多种治疗方法处理GCT残腔,结果提示乙醇、液氮等各种残腔处理方法联合使用可以降低术后复发率,但单独作用并不能降低术后复发率;Ruggieri等[20]报道,治疗骶骨GCT术中是否加用辅助治疗对术后局部复发无影响;Turcotte等[21]多中心研究报道,186例GCT行囊内手术复发率为18%,填充材料或辅助材料的天然特性对复发率无影响。本研究中,加辅助治疗的B组与无辅助治疗的A组术后局部复发率差异无统计学意义,未能证实辅助治疗的必要性;但笔者认为这可能与术中辅助治疗应用前肿瘤病灶清除比较彻底有关。
总之,根据Enneking外科分期以及Campanacci影像学分级选择合适外科手术治疗GCT能够获得满意的疗效。患者性别、年龄、肿瘤部位、Campanacci影像学分级、Enneking外科分期及手术方式不能预测GCT患者术后病灶是否复发,术中辅助治疗的必要性有待进一步证实。本研究不足之处系单中心回顾性分析,不同手术方式的病例数较少,尚需继续收集病例,进行前瞻性随机对照研究,尤其是多中心的随机对照研究,以期获得更加可靠的临床依据。



























