
总结低级别中央型骨肉瘤(LGCOS)的临床表现、影像学特征、组织学特点以及临床预后。
回顾性分析上海市第六人民医院2008年1月—2016年1月经病理学确诊的34例LGCOS患者的临床资料,其中男22例、女12例,年龄13~62岁,中位年龄40岁。28例为初发肿瘤,6例为术后复发。发病部位股骨远端11例,胫骨近端9例,股骨近端7例,肱骨近端3例,尺骨、桡骨、髂骨、腓骨各1例。所有患者行广泛性瘤段切除术,观察患者的临床表现、影像学及病理学特征、治疗及随访、预后情况。
LGCOS患者临床表现以疼痛或肿块为主。影像学主要表现为成骨性、溶骨性以及混合成骨,以混合成骨多见,18例中13例X线表现出2种以上的恶性征象。34例患者组织学表现温和,可见大量胶原纤维、分化相对成熟的骨样组织以及轻度异型的梭形细胞;其中11例有局灶去分化成分,表现为细胞丰富,有明显的异型性及病理性核分裂象。术后随访1~8(3.5±1.8)年,其中3例复发,2例出现转移而死亡。6名复发患者中3例行截肢治疗。
LGCOS是一种分化良好、恶性程度低的肿瘤,其临床特点为病程长、症状轻微;当X线表现为成骨与溶骨共存时,均应考虑到LGCOS的可能并完善CT及MRI检查;活检方式建议采取切开活检,尽可能多点取样;LGCOS的预后取决于其治疗方法,准确的诊断极其重要。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
低级别中央型骨肉瘤(low-grade central osteosarcoma,LGCOS)是骨肉瘤中较为少见的临床亚型,其发病率低,占骨肉瘤的1%~2%[1]。国内外文献中关于LGCOS的报道相对较少,大多以病例报告为主。1977年Unni等[2]报道了27例LGCOS病例。1990年Kurt等[3]整合以上27例病例并结合会诊资料,对80例LGCOS病例进行了详细的分析讨论,是迄今报道的样本数最大的文献。LGCOS的发病年龄多为20~30岁,相对于经典型骨肉瘤稍晚,其病程长,症状不典型,大多因轻微疼痛或肿块而首诊[4];影像学表现为多样化,溶骨、成骨或混合表现均有发生,部分恶性征象并不明显,甚至从组织学层面也难以与部分骨原发良性肿瘤(如纤维结构不良)区别,导致治疗不当。LGCOS的治疗方法不同对患者预后影响极大,如肿瘤切除不彻底,可导致反复复发甚至可能激惹肿瘤,促其向恶性转化;而经过恰当的外科治疗及化疗,五年生存率约90%[1]。因此,LGCOS的正确诊断极其重要。本研究对LGCOS患者的临床资料进行回顾性分析,总结其临床表现、影像学特征、组织学特点,诊疗方法与预后的关系,旨在为临床诊治提供参考。
纳入标准:(1)手术后病理诊断为LGCOS的患者;(2)随访时间不少于1年。排除标准:(1)临床及病理资料缺失;(2)失访病例。
共纳入上海交通大学附属第六人民医院骨科2009年1月—2016年1月LGCOS患者34例,男22例、女12例,年龄13~62岁,中位年龄40岁,其中20例患者发病年龄集中在30~50岁。34例患者中,28例为初发肿瘤,6例为院外诊断良性肿瘤而行病灶刮除植骨术术后复发的患者;肿瘤发病部位分别为股骨18例(股骨远端11例、近端7例),胫骨近端9例,肱骨近端3例,腓骨近端1例,桡骨远端1例,尺骨近端1例,髂骨1例。
34例患者中,接受X线检查18例,CT检查19例,MRI检查14例,其中9例患者X线、CT及MRI资料均齐全。
本研究符合《赫尔辛基宣言》的要求。患者家属均签署知情同意书。
28例初诊肿瘤患者中10例行切开活检术,组织学检查结果均提示LGCOS;18例行穿刺活检术,其中5例组织学检查结果提示普通型骨肉瘤,予以新辅助化疗,术后标本病理检查提示为LGCOS,未进行术后化疗。
所有患者行手术治疗,其中21例予以肿瘤瘤段切除+肿瘤关节假体置换术,5例行生物学重建。
活检或切除的病灶经10%甲醛溶液固定,常规脱水、石蜡包埋、切片,厚度为5 μm, HE染色,其中12例行免疫组织化学检测鼠双微基因2(murine double-minute type 2, MDM2)的表达,9例检测了周期素依赖性激酶4 (cyclin dependent kinase 4, CDK4)的表达,19例行Ki-67检测。所有标本经2名病理科医生共同诊断并记录。
观察患者临床表现、影像学表现、术后组织学表现,以及随访及预后情况。
采用电话或门诊随访的方式。患者术后第1、3、6、12个月时复诊,以后每年复诊一次。观察局部有无复发、肺部有无转移。随访时间截至2017年8月。
应用SPPS 19.0统计学软件对数据进行描述性分析,符合正态分布的计量资料用 ±s表示。对患者随访结果进行Kaplan-Meier生存分析。
±s表示。对患者随访结果进行Kaplan-Meier生存分析。
28例初发患者中,症状以患肢疼痛为主的有21例,其疼痛较轻微,呈间歇性,可自行缓解;6例为患处酸胀不适,无明显疼痛;1例为自检发现逐渐增大的无痛性肿块。6例复发患者中4例于术后随访过程中发现,无明显疼痛,2例表现为轻微疼痛。
X线片表现:18例患者的X线影像显示,病变均起源于髓内。18例中,以溶骨性病变为主的4例,表现为病变部位骨密度明显降低、边界不清、少量成骨表现,均有皮质变薄、破坏甚至缺损征象,骨膜反应不明显,其中1例呈明显膨胀性改变、骨皮质毛糙,另1例病灶内可见粗大的骨小梁及骨皮质扇形样破坏。成骨性改变为主的3例,表现为大片形状不规则斑片状密度增高影,中央有密度稍低的改变,周围边界模糊,其中2例病变累及骨外。11例表现为溶骨与成骨混合存在,在X线片上呈虫噬样改变或呈云雾状骨密度增高伴有散在不同程度的低密度灶,大部分可累及骨皮质,其中5例可见明显骨膜反应、边界不清(图1A、图2A、图3A)。18例患者中,有13例具有2种以上的恶性征象,包括病灶边界不清、骨质破坏累及皮质、骨膜反应与软组织肿块。
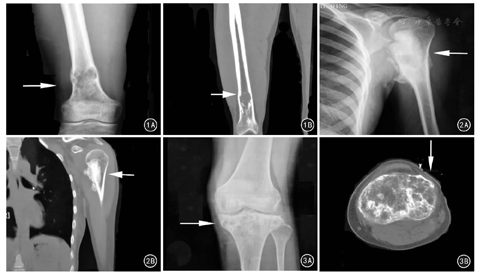

CT表现:19例患者的CT影像17例有不同程度的恶性肿瘤征象,其共同特征是具有明显骨皮质破坏,病灶内可见肿瘤骨(图1B、图2B、图3B)。4例病灶以成骨表现为主,即为大团块状致密影或云雾状密度增高影,其内伴有散在低密度灶,其中2例穿透骨皮质,累及周围软组织;5例表现以溶骨破坏为主,即髓腔内呈虫蚀样破坏,累及骨皮质,其中1例表现为一侧骨皮质明显缺损、另外4例表现为骨皮质渗透性破坏(1例形成骨外病灶);1例表现为骨皮质破坏伴一侧明显硬化带形成;4例患者有明显的恶性征象,CT表现与高级别骨肉瘤相似,即骨皮质明显破坏伴骨膜反应、髓腔内有成骨表现;其余5例表现为不同程度的骨质破坏,破坏区域内散在少量斑片状密度增高影,部分伴有明显的骨膜反应。
MRI表现:14例患者MRI显示肿瘤范围较X线及CT显示的广泛(图4)。T1WI见病变部位呈与肌肉信号相等或稍低的信号或伴有部分极低信号区域,T2WI显示病灶以高信号为主伴有部分散在低信号,并可见病变周围不同程度的水肿带;静脉内注射对比剂后可见病灶呈现不均匀强化,以肿瘤外缘为主,其中7例可见软组织病灶。
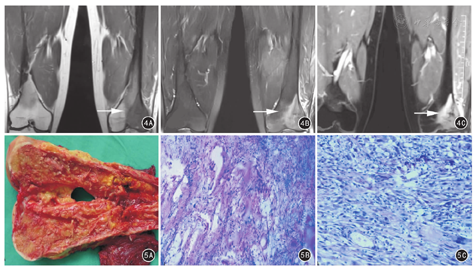

手术标本常规行组织学检查,均提示LGCOS。大体观:切除病灶的平均长度为(12.9±2.49)cm。25例病灶切面呈灰白色,质硬,呈浸润性生长,侵犯骨皮质;还有呈灰黄色或灰红色,质地中等、中央坏死等表现(图5A)。显微镜下可见大量胶原纤维、分化相对成熟的骨样组织以及轻度异性的梭形细胞。病灶呈浸润性生长,侵犯骨皮质。骨样组织周围无骨母细胞分布,呈金属丝、花边或部分呈团块状,具有平行排列倾向;肿瘤细胞呈梭形,不均匀分布或成群交错排列,表现为轻度异性,偶见核分裂象(图5B)。而其中11例表现为局部去分化,可见细胞中度丰富,具有明显的细胞异型性及病理性核分裂象(图5C)。
34例组织学检查中:仅12例行免疫组织化学检查MDM2表达,其中9例呈阳性;5例行CDK4检测,其中3例阳性;19例Ki-67检测中,平均表达范围为11.47%±8.30%,增殖指数相对较低。
患者均获随访,随访时间为1~8(3.5±1.8)年。34例中,有11例提示部分局部去分化成分,术后予以4到6周期化疗。23例单纯LGCOS患者中2例于术后1年、3年复发行截肢术;部分去分化的11例LGCOS患者中2例于术后5年因多发转移而死亡,其中1例初诊时已有转移病灶存在(图6)。6例外院术后复发的患者,复发时间为4个月~9年(29±41)个月:于我院就诊后,2例行截肢治疗,术后病理是肿瘤恶性程度增高;4例予以肿瘤瘤段骨切除及关节假体置换术,其中1例于术后1年余再次复发,行截肢治疗。
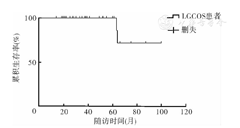

注:LGCOS为低级别中央型骨肉瘤
研究显示,LGCOS在发病率上并无明显的性别间差异,其发病年龄较普通型骨肉瘤晚,发病高峰位于30岁左右[1,5]。大多数患者因症状不明显,早期诊断困难,诊前时间长,有的甚至长达数年,因而难以正确判断其发病时间。LGCOS起源于下肢长骨者约75%,膝关节周围LGCOS占发病总数的50%以上[5,6,7]。
LGCOS并无特异性的临床表现,通常以轻微疼痛、酸胀不适或自检发现进行性增大的肿块而就诊,部分病人可持续5年之久,平均7~30个月[3,8]。本研究中34例LGCOS患者中有21例以轻微疼痛为主要症状,查体均无静脉怒张、皮温升高等明显恶性肿瘤征象。
X线作为骨科最常用的检查方法之一,在诊断LGCOS中扮演着重要的角色。但LGCOS患者的X线片表现各不相同,差异性较大,即有表现为良性病变倾向,又有表现为明显的恶性征象,主要表现为溶骨、成骨以及混合性病变。在Kurt等[3]报道的74例LGCOS患者中,61例X线片表现出边界不清、侵袭性破坏等恶性征象;肿瘤大小2~25 cm,平均9 cm,其中21例超过10 cm,10例小于5 cm。而Andresen等[6]研究的59例LGCOS患者中,27例表现为良性倾向,即未见肿瘤侵袭性征象,病灶大小为2~24(7.9±4.6 )cm 。笔者认为,LGCOS可能在早期时多呈现出良性病变的征象,随着疾病的进展,逐渐表现出侵袭性甚至明显的恶性征象。当X线检查难以判断肿瘤良恶性时,CT和MRI能够提供有效的帮助。CT具有更高的密度分辨率,能够更清楚地显示病变内的细节,特别是瘤骨的生成情况以及骨的破坏程度,甚至有学者认为混合型骨破坏是LGCOS中较为典型的表现[9]。MRI对于肿瘤累及的髓外病灶判断更加敏感,本组14例接受MRI检查的患者中,7例可见髓外病灶形成,累及周围软组织。MRI应用于LGCOS的诊断,可以更清楚地显示肿瘤累及的范围,尤其是对骨周围软组织的侵犯。笔者认为,MRI显示软组织病灶、骨膜反应、病变区域在造影剂下强化,是比较可靠的恶性征象,而病变周围水肿带可提示恶性可能。因此,经过X线片初步筛查,结合CT与MRI,能够明显提高LGCOS的诊断率。
在大体标本中,LGCOS病灶主要位于髓腔内,累及髓外者可见不同程度的骨皮质破坏及软组织病灶。肿瘤切面大多呈现灰白色,质地稍韧,有的较坚硬,触之可有砂砾感,偶见部分鱼肉状类似于肉瘤样的外观[8]。而镜下主要表现为肿瘤性骨样基质以及增殖缓慢的纤维母细胞样的梭形细胞,后者呈浸润性生长,分布不均匀,并且结构具有明显的多样性[10]。肿瘤细胞轻度异型性,核深染不显著,核仁丰富,形状大小不规则,核分裂象较少,Broder分级为Ⅰ~Ⅱ级。由于LGCOS恶性程度低,大多数患者病程较长,其骨样基质分化程度表现不一,呈渐进性变化,可由最初的细小的分支状幼稚骨样基质发展到粗大的肿瘤性编织骨,最后形成分化良好的板层骨,可表现出多种形态:瘤骨可连接成网状结构,排列具有平行倾向,也可依托宿主骨形成"脚手架"样结构,甚至部分区域可形成成熟的板层骨[11]。除了以上表现外,有的LGCOS病变中还可发现大量胶原纤维形成或软骨成分[3]。而10%~30%的LGCOS伴有局部去分化表现,表现为细胞丰富,有明显的细胞异型性及病理性核分裂象。
部分LGCOS较难与良性骨肿瘤相鉴别。这时,通过免疫组织化学标记物MDM2与CDK4的检测可以提供有效的帮助,70%~89%低级别骨肉瘤中能够被检测,而在其他良性骨肿瘤以及经典型高级别骨肉瘤中很少表达[12,13,14,15]。此外,还需要与纤维结构不良、普通型骨肉瘤、骨巨细胞瘤以及动脉瘤样骨囊肿等相鉴别[16,17,18]。
LGCOS的治疗以手术为主,根据病变部位的范围行广泛或根治性的肿瘤切除。一般情况下,单纯手术治疗即可达到满意的效果,不需要新辅助化疗及术后化疗。但对于组织学提示存在去分化成分的病例,是否需要化疗尚存在争议。在2018版的美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)指南中,将LGCOS归为高级别骨肉瘤,术后应进行化疗[19]。而Righi等[5]报道,在其临床中心诊治的29例局部去分化LGCOS患者中,去分化成分低于50%的患者通过足够边界的手术后能够获得一个较好的预后,术后化疗组(参照骨肉瘤化疗方案)相比较于未化疗组并没有明显的获益。本组34例LGCOS患者中有11例伴有局部去分化成分的患者,术后行4~6周期化疗,其中2例于术后5年死亡;而单纯LGCOS患者无一例死亡。由此可见,局部去分化成分及其大小是影响患者生存率的一个重要因素。由于化疗副作用明显,可影响患者生活质量,同时给患者带来沉重的经济负担;因此,对局部去分化的LGCOS,尤其是去分化成分较多者,建议根据NCCN指南按照高级别骨肉瘤的方案进行治疗。
有研究报道,术后对病灶局部伴有高级别成分的LGCOS患者进行化疗,总体5年及10年无瘤生存率可达90%和80%以上[1]。本组28例初发患者中仅2例于术后5年死亡。但是,当LGCOS被误诊为良性肿瘤而行病灶刮除治疗的患者,几乎都在其术后数月至数年复发。不论是手术不彻底还是其他原因导致的肿瘤复发,都可发生恶性程度增高、肺部转移甚至死亡[3,16,18]。因此,可以认为对LGCOS广泛的肿瘤切除能够控制疾病的发展,获得良好的预后。
本研究为回顾性研究,部分影像学资料缺失,病理免疫组织化学数量相对较少,部分结果具有一定的局限性。下一步针对LGCOS的研究,可对其病灶进行更进一步的检测,从分子层面对该疾病进行分析研究,甚至探索其与经典型骨肉瘤之间的差异。
所有作者均声明不存在利益冲突



























