
总结光学相干断层扫描血管成像(OCTA)在眼底疾病中的临床诊疗应用中的研究现状。
在中国知网、万方数据、谷歌学术、PubMed等数据库以"光学相干断层扫描血管成像""眼底疾病""糖尿病视网膜病变""视网膜静脉阻塞""湿性年龄相关性黄斑变性"和"optical coherence tomography angiography""fundus disease""diabetic retinopathy""retinal vein occlusion""wet type age-related macular degeneration"等为关键词进行检索,总结OCTA技术在眼底疾病临床诊疗中应用研究现状。
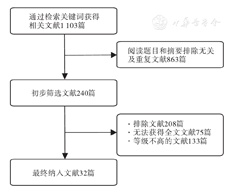
检索在2014年6月—2018年12月发表的与OCTA相关的文献1 103篇,最终纳入32篇,其中中文文献3篇,英文文献29篇。OCTA是近年兴起的一种无创性血管成像技术,它通过探测血管腔内血细胞的运动,快速、安全地获得高分辨的视网膜和脉络膜血管影像。OCTA技术可良好地显示视网膜血管缺失、异常吻合;对黄斑中心拱环大小和形状描绘准确;对脉络膜新生血管检出率高;有助于中心性浆液性脉络膜视网膜病变的诊断和鉴别诊断,并可以作为眼底疾病治疗后随访观察的有效检查手段。
OCTA作为一种具有临床应用潜力的新技术,可良好地显示视网膜和脉络膜的眼底病变,为此类疾病的诊断和治疗提供重要参考,但其存在的视野小、对眼球运动追踪差等缺点仍需进一步改进。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
光学相干断层扫描血管成像(optical coherence tomography angiography, OCTA)是一项基于运动对比度呈现视网膜和脉络膜任一层的血管结构视图的新技术[1]。与眼底荧光素血管造影(fundus fluorescein angiography, FFA)和吲哚菁绿血管造影(indocyanine green angiography, ICGA)相比,OCTA无绝对禁忌证,并且无需对比剂就能快速无创地获取多层次多部位血管系统的静态影像[2]。因此,OCTA有着巨大的技术优势和广阔的应用前景。深入了解OCTA的技术原理和在眼底疾病临床诊疗中的应用案例,不仅有助于阐明疾病的发病机制,而且为诊断和治疗提供重要参考。本文以"光学相干断层扫描血管成像""眼底疾病""糖尿病视网膜病变""视网膜静脉阻塞""湿性年龄相关性黄斑变性"和"optical coherence tomography angiography""fundus disease""diabetic retinopathy""retinal vein occlusion""wet type age-related macular degeneration"等为关键词,在中国知网、万方数据、谷歌学术、PubMed等数据库检索到在2014年6月—2018年12月发表的有关OCTA技术的文献共计1 103篇。纳入标准:(1)医学证据水平等级较高;(2)研究逻辑缜密,方法可靠。排除标准:(1)证据水平等级较低;(2)研究设计有缺陷、数据不完整、结论不清晰;(3)仅为评论或讲座。最终纳入32篇,包括3篇中文文献、29篇英文文献,见图1。现就OCTA在眼底疾病中的应用最新进展进行综述。

OCTA是一种新的非侵入性成像技术,它的作用原理为在视网膜完全相同的位置完成连续序列B扫描,然后分析扫描的振幅或相位是否发生变化[3,4]:如果发生变化,表示该位置视网膜内组织发生了移动;如血管内红细胞的流动,最后通过放大获得的信号和数字化处理,获取视网膜脉络膜的血管结构的三维结构图像。OCTA的三维成像特点结合自带的分层软件,将视网膜浅层、视网膜深层、视网膜外层、脉络膜血管分层提取,有利于临床医生进行对比观察并确定病变位置。
目前,FFA和ICGA虽然是检测脉络膜及视网膜新生血管形成的金标准,但在应用中如发生染料渗漏、出血或介质混浊等情况均可能掩盖视网膜病变。在二维模式下,染料渗漏和立体视觉不良使病灶深度的定位和新生血管大小的描绘变得困难。相比之下,OCTA无需使用对比剂、无需散瞳、采像时间短、图像分辨率高、三维成像等优势明显。OCTA在常见眼底疾病如糖尿病视网膜病变、视网膜静脉阻塞(retinal vein occlusion, RVO)、老年性黄斑变性、中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy, CSC)等的诊断和疗效评估方面具有重要的价值。主要体现在以下几方面:(1)OCTA能够检测到脉络膜血管流动的变化,并在多种条件下,特别是针对老年性黄斑变性问题可以阐明脉络膜新生血管的存在[5];(2)OCTA能够非常详细地提供视网膜血管系统的视图,可以精确描绘出糖尿病患者视网膜黄斑中央凹无血管区,并能检测出糖尿病性视网膜病和血管闭塞性疾病的微血管异常;(3)OCTA的en-face模式可以量化不同血管丛的血流密度;(4)OCTA提供的眼底断层图像能够清晰描绘出CSC的色素上皮层和神经感觉层的脱离。
首先,由于没有造影剂渗漏,降低了OCTA对视网膜血管屏障功能的观察能力。其次,屈光介质混浊,如玻璃体积血降低光线穿透眼睛深层的能力,遮盖视网膜的血液流动。再者,目前临床推出的采样尺寸仅有3种:3 mm×3 mm、6 mm×6 mm和8 mm×8 mm;当采样范围扩大时,图像质量显著下降。此外,患者的移动或眨眼等多种原因均能导致OCTA图像出现伪影。例如,由于OCTA基于眼球后部的运动判断血液流动,除红细胞之外的一些非血管结构,如精细组织可能引起去相关信号;OCTA中的投影伪影有时导致视网膜浅血管丛出现在深层视网膜丛的分层中[6];黄斑囊样水肿的囊壁、视网膜内的脂质也会产生伪影[6]。最后,OCTA可能会遗漏血流缓慢的区域,比如小动脉瘤或纤维化的脉络膜新生血管。
糖尿病视网膜病变是一种引起眼底微血管病变进而影响视力的慢性进行性疾病。刘青等[7]通过观察增生性DR患者的OCTA与FFA检查结果,认为两者对视网膜新生血管、视网膜无灌注区的检出结果一致性较好,但对于黄斑拱环结构改变、黄斑水肿、视网膜微血管瘤的检出结果一致性一般。Choi等[8]提出糖尿病视网膜病变的所有阶段均表现视网膜和脉络膜微血管异常,这些异常在OCTA上的表现包括:聚集的毛细血管、扩张的毛细血管节段、曲折的毛细血管、毛细血管部分丢失、毛细血管密度降低、异常的毛细血管循环和中心凹无血管区的扩大,并发现部分未检测出糖尿病视网膜病变的糖尿病患者已出现视网膜血管异常和/或脉络膜血流障碍,这在早期监测糖尿病患者的视网膜病变中非常重要。
黄斑区缺血表现在中心凹无血管区的扩大、部分血管无灌注区的出现及血流密度的下降。OCTA通过测量中心凹无血管区和血管无灌注区的总面积来定量计算黄斑缺血区大小。一些学者通过研究发现,与正常人相比,糖尿病视网膜病变患者表现为中心凹拱环血管不完整、形状不规则导致中心凹无血管区面积增大,并且拱环血管越不规则,中心凹无血管区面积就越大,这种拱环破坏的现象在深层毛细血管丛中表现得更为明显[9,10]。笔者分析其原因可能是深层毛细血管丛位于供氧分水岭附近,对缺血损伤更为敏感。Agemy等[11]发现,随着糖尿病视网膜病变严重程度的增加,视网膜毛细血管灌注密度显著降低。
微动脉瘤被认为是糖尿病视网膜病变的一个标志,在OCTA上可以被看作是小局灶的血管扩张。Miwa等[12]通过研究发现,FFA上的微动脉瘤只有大约一半在OCTA上可见,这可能是因为OCTA受到最小可检测血流速度的限制;同时还发现,有时OCTA能够识别一些未被FFA检测到的微动脉瘤,但这一观点有待进一步验证。
我们不仅可以利用OCTA聚焦内界膜层来寻找视网膜前病变,如网膜前新生血管,而且可以测量新生血管面积和血流指数,从而定量评价新生血管的范围和活性。这一功能允许临床医生跟踪评价抗血管内皮生长因子(vascular endothelial growth factor,VEGF)药物或眼底激光治疗新生血管的疗效。Savastano等[13]通过研究发现,OCTA比FFA能更清晰地显示增生性糖尿病视网膜病变患者视盘新生血管的形成。Matsunaga等[14]利用OCTA观察到棉絮斑周围血流灌注减少甚至缺失,这一研究成果有助于揭示棉絮斑的形成机制。
RVO的特征是中央或分支视网膜静脉的扩张和充血、视网膜出血、视网膜内或网膜下积液,以及不同程度的视网膜缺血。传统的FFA能够显示RVO疾病的血管异常,但是由于浅层血管系统的荧光遮挡,给深层的视网膜血管检测与评估造成了很大困难。Lee等[15,16]发现,OCTA能够清楚地显示黄斑部视网膜的无灌注区、血管扭曲或扩张、异常的毛细血管形态及视网膜内水肿,这些发现与临床、解剖、荧光血管造影结果是一致的。与大多数FFA相比,OCTA中扩张和异常的毛细血管显示更加清晰。有研究者认为,OCTA联合频域光学相干断层扫描在评估视网膜静脉阻塞患者的黄斑并发症方面与FFA同等有效[16]。
RVO的视力显著下降通常是由黄斑水肿、黄斑缺血性改变或视网膜新生血管的并发症引起。Suzuki等[17]观察发现OCTA能够很好地检测出分支静脉阻塞继发黄斑水肿患者视网膜无灌注区、浅表和深层毛细血管扩张。Tsuboi等[18]利用OCTA观察到一些血管只存在于浅层毛细血管丛而深层毛细血管丛缺失,称之为差异血管;在持续黄斑水肿的眼睛中,差异血管面积明显增大,导致血管灌注状态差异,可促进分支静脉阻塞黄斑水肿的发展。
wet-AMD的特点是视网膜下存在CNV,继而引起一系列渗出、出血、瘢痕改变。OCTA可以检测出视网膜脉络膜不同层次的血流,进而提供与wet-AMD所有亚型相关的病理性微血管的形态。根据不同类型CNV在光学相干断层扫描上的特征,将wet-AMD的新生血管形式分成3种亚型:1型CNV、2型CNV、3型CNV。有研究者认为,OCTA可以发现常规检查难以发现的隐匿性的1型CNV,表现为缠绕的血管网,或一圆簇小口径毛细血管丛,没有相伴的核心滋养血管[19,20]。有学者利用OCTA首次确定了3型CNV的微血管形态,并将其描述为起源于外层视网膜深层毛细血管网的、小的、高速流动血管簇,并且这些描述与病理检查具有高度可比性[21,22]。但是Reinhard等[23]发现同ICGA相比,OCTA在CNV面积和检出率方面存在不足:ICGA能够在所有眼睛中识别CNV,而OCTA只能在95%的1型和86%的2型wet-AMD眼睛中检测到CNV,并且两种病变类型在OCTA上显示的平均CNV面积明显小于ICGA。笔者分析,OCTA信号检测效果可能受血流速度的限制,与wet-AMD的病理类型无关。因此,突破最低可检测和最快可识别流量的限制是提高OCTA对CNV检测准确性的关键。
Inoue等[24]对100例(115只眼)1型CNV患者进行多中心、回顾性队列研究发现,OCTA联合频域光学相干断层扫描检测1型CNV的准确率要优于单独应用FFA或OCTA,因此提出将OCTA和光学相干断层扫描信息结合,作为1型CNV的非侵入性诊断和疗效监测的有效方法。Lumbroso等[25]观察经抗VEGF治疗的2型CNV初发患者的纵向发展情况发现,随着时间推移,OCTA图像出现小血管消失、血管直径缩小、CNV面积缩小和血管密度降低等结果,但始终有血流的残余。
CSC是一种以视网膜神经感觉层浆液性脱离为特征的疾病,有时伴有色素上皮层的脱离。CSC可以分为急性和慢性变异型。Feucht等[26]发现在急性CSC中,视网膜浅层血管丛和深层血管丛、外层视网膜和脉络膜的OCTA图像中并没有显示与渗漏点直接相关的血流改变,但是在脉络膜毛细血管层发现低灌注区伴有高灌注区的不规则血流模式。最近的一项研究发现,在慢性CSC中1/3的扁平不规则的色素上皮层脱离含有CNV[27]。许发宝等[28]应用OCTA和频域光学相干断层扫描分析比较急慢性CSC患者视网膜脉络膜形态改变,结果表明,在慢性CSC组,OCTA描述到了ICGA没有发现的CNV;在急性CSC组OCTA和ICGA中均没有发现CNV;在对OCTA脉络膜浅层图像分析中,慢性CSC组局部"暗区"的出现率远高于急性CSC组。值得注意的是,OCTA比其他成像方式的CNV检出率更高,可能是发生CNV时,视网膜色素上皮层过度反射引起的。在这种情况下,需要进一步开展纵向研究以评估抗VEGF治疗的适应证[27]。
息肉样脉络膜血管病变是一种常见的脉络膜视网膜病变类型,主要是指脉络膜血管网呈伞样、车辐样或树枝样异常扩张,血管网末梢出现息肉样膨大等疾病。目前,ICGA是诊断息肉样脉络膜血管病变的"金标准",表现为脉络膜异常分支血管网及异常血管网末端瘤样扩张。马楠等[29]研究发现,虽然ICGA检查表现为脉络膜异常分支血管网的患眼在OCTA检查中也有相应表现,但是形态和信号强度不完全一致。Wang等[30]在OCTA检查中,将位于视网膜色素上皮层与Bruch膜之间的脉络膜异常分支血管网形态描述为"海扇""水母"或"纠缠的血管团",息肉样膨大则表现为强信号亮点,刚好在视网膜色素上皮层顶部以下,比ICGA图像更为清晰。有时OCTA能检出ICGA不能发现的息肉样病变,但是出血也会遮挡OCTA的信号[29]。
针对OCTA的局限性,近年来不断有学者进行探索,以求改善它的性能,对眼科做出更多贡献。为了使OCTA有更大视野的同时保持高分辨率,Hirano等[31]提出将扩展视场成像技术与广谱光学相干断层扫描技术结合的方法。还有学者提出创建多个3 mm×3 mm扫描的蒙太奇图像的策略[32]。此外,广角OCTA技术研发仍在探索中,减少OCTA运动伪影和投影伪影也是未来的研究方向。目前而言,OCTA联合傅立叶光学相干断层扫描方法的应用前景较好,它独有的观察浅层和深层血管丛的诊断模式,在需要单独分析视网膜血管丛的疾病(如糖尿病视网膜病变)中应用价值显著。
综上,OCTA作为一种具有临床应用潜力的新技术,已被证明是一种有效评估眼底疾病的影像学方法。与当前眼底血管造影的金标准FFA和ICGA相比,OCTA的优点是利用运动对比代替静脉注射染料,可在数秒内获得容积扫描并分割到特定的深度,进而提供准确的血流图像。OCTA既简化了临床工作流程,又使患者的舒适度高于FFA检查。不过它存在视野小、对眼球运动追踪差、检测受血流速度限制、无法显示渗漏、经常需要检测者鉴别图像伪影等缺点。在未来,更快的扫描速度,更大的视野和更高的分辨率将是OCTA发展的新方向,期待它成为一种可清晰准确呈现视网膜脉络膜血管系统的检查方法。
所有作者均声明不存在利益冲突



























