
探讨不同年龄段成人大脑皮质厚度的偏侧性差异。
前瞻性研究。2017年9月—2018年12月寿光市人民医院CT磁共振室招募右利手汉族21~80岁的健康志愿者360人,分为青年组(21~40岁)、中年组(41~60岁)、老年组(61~80岁)三个年龄段组,采用3.0 T MR对志愿者行颅脑扫描,获取原始数据。使用FreeSurfer脑成像软件分析,获得左右大脑半球、各感兴趣区脑回皮质的厚度。观察不同年龄组左右大脑半球的皮质厚度是否存在偏侧性。观察不同年龄组间,各脑回的皮质厚度是否存在偏侧性,对有偏侧性的脑区计算侧化指数;统计有偏侧性的脑区的数量及偏侧程度。
青年组全脑、左右大脑半球皮质厚度分别为(2.506±0.027)mm、(2.508±0.015)mm、(2.504±0.015)mm,中年组分别为(2.372±0.012)mm、(2.372±0.007)mm、(2.373±0.008)mm,老年组分别为(2.264±0.021)mm、(2.264±0.015)mm、(2.263±0.014)mm。同一年龄组中,左、右大脑半球皮质厚度差异均无统计学意义(P值均>0.05)。不同年龄组间,全脑、左右大脑半球的皮质厚度均随着年龄的增加逐渐减少,差异均有统计学意义(F=64.907、34.843、34.863,P值均<0.01)。青年组、中年组、老年组大脑皮质厚度的偏侧性及侧化指数各不相同:3组中出现了侧化区域的保留(如外侧枕回、舌回、后扣带回、内嗅皮层等)、增加(如额下回三角部、中央前回、颞下回、颞极等)及减少(如额上回、额下回岛盖部、中眶额回、楔叶、前扣带回等)的现象;中年组侧化脑区数量多于青年组、老年组,呈倒"U"型模式;部分脑区皮质厚度偏侧性贯穿三个年龄段,但其偏侧程度有着明显的差异(外侧枕回、舌回呈现"大-小-大"模式,而后扣带回、内嗅皮层呈现"小-大-小"模式)。
成人大脑左右半球皮质厚度是不对称的,大脑皮质厚度的偏侧性及偏侧程度随年龄的变化而呈现不同模式的改变,为神经行为、神经生理疾病的认知提供了新的视角。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
功能不对称是人类大脑构造的一个明显的特征[1]。有时候,人们只重视大脑功能的不对称性,而忽略大脑结构的不对称。大脑半球结构基础的不对称性可以表现在不同方面,如细胞结构、皮质形态、两个半球内的结构网络等。研究显示,应用MR T1WI测量皮质厚度,可以用来评估人脑皮质的细微变化[2]。通常皮质厚度测量包括识别皮质内外边界或表面,通过使用图像信息和表面几何图形来构建灰质和白质的表面模型[2]。以往关于大脑皮质厚度的研究,忽略了年龄对大脑皮质厚度的影响作用[3,4]。本研究中,采用大样本健康成年人脑高场强MRI和计算机三维可视化及图像分析技术,通过对不同年龄段健康成年人大脑皮质厚度精确计算与统计学分析,探讨不同年龄大脑左右半球皮质的不对称性,旨在了解大脑的正常老化过程中皮质偏侧性的改变,同时也为精神疾病(如精神分裂症)的神经发育、神经变性病变诊治、神经心理学及人类学研究等提供形态学基础。
纳入标准:(1)智力正常,认知功能评分采用简易智力状态检查量表(mini-mental state examination,MMSE)评分均>27分;(2)常规头颅MRI扫描末见明显阳性病灶,有少量高信号、微小变性灶,并且数量不多于5个,分布不集中;(3)右利手;(4)签署书面知情同意。排除标准:(1)有脑外伤、药物滥用或癫痫发作等病史;(2)有神经障碍、精神疾病、学习障碍或发育迟缓等病史;(3)有高血压、糖尿病、脑梗死、脑血管畸形、脑肿瘤等病史。
前瞻性研究。2017年9月—2018年12月寿光市人民医院CT磁共振室招募右利手汉族健康志愿者360人,男179人、女181人,年龄21岁~80岁。按年龄分为青年组(21~40岁)、中年组(41~60岁)、老年组(61~80岁)。
本研究经院伦理委员会批准(批文号2019YX093)。志愿者均签署知情同意书。
使用德国西门子3.0 T MR仪对所有志愿者进行全脑扫描,获取3D-T1WI数据。3D-T1WI序列扫描参数:TR 2 300.0 ms,TE 2.27 ms,层厚1 mm,体素1 mm×1 mm×1 mm, FOV read 250 mm,FOV phase 100.0%,层数192层,时间约6 min。
应用FreeSurfer 6.0.0软件(http://www.freesurfer.net/),在计算机(Windows XP系统)运行,通过使用图像信息和表面几何图形来构建大脑灰质和白质的表面模型,获得全脑、两侧半球及各感兴趣区脑回的皮质厚度。见图1。在Matlab 2014软件中制作大脑示意图。

(1)观察不同年龄组间及同一年龄组中,全脑、左右大脑半球的皮质厚度是否存在偏侧性,对有偏侧性的计算其侧化指数(asymmetry index,AI )。AI是正值说明左侧化(左侧大于右侧),负值说明右侧化(右侧大于左侧);侧化程度的大小用AI绝对值表示。


(2)观察不年龄组间,每个脑回的皮质厚度是否存在偏侧性,对有偏侧性的脑区计算AI;统计有偏侧性的脑区的数量及偏侧程度。
应用SPSS 17.0软件对数据进行统计学分析。服从或近似服从正态分布的计量资料以 ±s表示,多组间比较采用方差检验,两组间比较采用独立样本t检验,组内不同侧别间比较采用配对t检验。分类资料采用χ2检验。以P<0.05为差异有统计学意义。
±s表示,多组间比较采用方差检验,两组间比较采用独立样本t检验,组内不同侧别间比较采用配对t检验。分类资料采用χ2检验。以P<0.05为差异有统计学意义。
青年组120人,男62人、女58人,中位年龄28岁;中年组114人,男52人、女62人,中位年龄52岁;老年组126人,男65人、女61人,中位年龄68岁。3组间性别差异无统计学意义(χ2=1.126, P>0.05)。
同一年龄组中,左、右大脑半球皮质厚度差异均无统计学意义(P值均>0.05),提示在同一年龄段,左、右半球皮质厚度无偏侧性。不同年龄组间,全脑、左右大脑半球的皮质厚度均随着年龄的增加逐渐减少,差异均有统计学意义(P值均<0.05)。见表1。
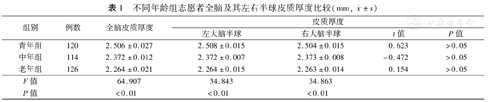
不同年龄组志愿者全脑及其左右半球皮质厚度比较(mm,  ±s)
±s)
不同年龄组志愿者全脑及其左右半球皮质厚度比较(mm,  ±s)
±s)
| 组别 | 例数 | 全脑皮质厚度 | 皮质厚度 | |||
|---|---|---|---|---|---|---|
| 左大脑半球 | 右大脑半球 | t值 | P值 | |||
| 青年组 | 120 | 2.506±0.027 | 2.508±0.015 | 2.504±0.015 | 0.623 | >0.05 |
| 中年组 | 114 | 2.372±0.012 | 2.372±0.007 | 2.373±0.008 | -0.472 | >0.05 |
| 老年组 | 126 | 2.264±0.021 | 2.264±0.015 | 2.263±0.014 | 0.154 | >0.05 |
| F值 | 64.907 | 34.843 | 34.863 | |||
| P值 | <0.01 | <0.01 | <0.01 | |||
青年组、中年组、老年组大脑皮质厚度的偏侧性及侧化指数各不相同:3组中存在偏侧性的区域比较,出现了偏侧性区域的保留、增加及减少的现象;中年组偏侧性脑区数量多于青年组、老年组,呈倒"U"型模式,见表2、图2。后扣带回、外侧枕回、舌回、内嗅皮层的皮质厚度偏侧性贯穿3个年龄段,但其侧化程度有着明显的差异,外侧枕回、舌回呈现"大-小-大"模式,而后扣带回、内嗅皮层呈现"小-大-小"模式,见表3。
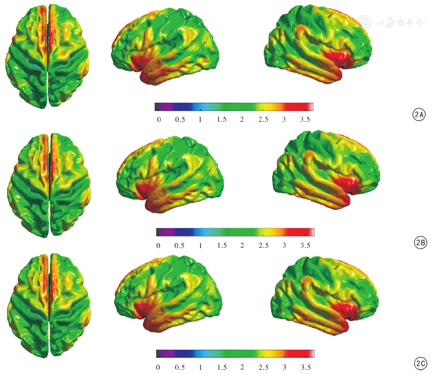


不同年龄组志愿者大脑皮质厚度偏侧性区域的分布情况
不同年龄组志愿者大脑皮质厚度偏侧性区域的分布情况
| 组别 | 皮质厚度左侧化的区域 | 皮质厚度右侧化的区域 |
|---|---|---|
| 青年组(120例) | 额上回、中眶额回、前扣带回、后扣带回 | 额下回岛盖部、外侧枕回、楔叶、舌回、颞中回、内嗅皮层 |
| 中年组(114例) | 额上回、中央前回、中眶额回、前扣带回、后扣带回 | 额下回岛盖部、额下回三角部、顶下缘角回、外侧枕回、楔叶、舌回、颞下回、梭状回、颞极、内嗅皮层 |
| 老年组(126例) | 中央前回、额极、后扣带回 | 额下回三角部、外侧枕回、舌回、颞下回、颞极、内嗅皮层 |
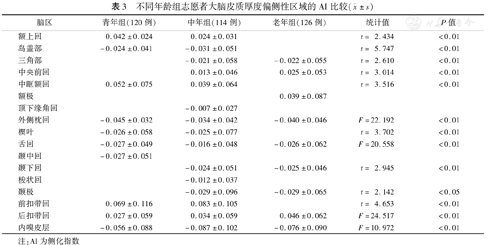
不同年龄组志愿者大脑皮质厚度偏侧性区域的AI比较( ±s)
±s)
不同年龄组志愿者大脑皮质厚度偏侧性区域的AI比较( ±s)
±s)
| 脑区 | 青年组(120例) | 中年组(114例) | 老年组(126例) | 统计值 | P值 |
|---|---|---|---|---|---|
| 额上回 | 0.042±0.024 | 0.024±0.031 | t= 2.434 | <0.01 | |
| 岛盖部 | -0.024±0.041 | -0.031±0.051 | t= 5.747 | <0.01 | |
| 三角部 | -0.021±0.058 | -0.022±0.055 | t= 2.610 | <0.01 | |
| 中央前回 | 0.013±0.046 | 0.025±0.053 | t= 3.014 | <0.01 | |
| 中眶额回 | 0.052±0.075 | 0.039±0.064 | t= 3.516 | <0.01 | |
| 额极 | 0.039±0.087 | ||||
| 顶下缘角回 | -0.007±0.027 | ||||
| 外侧枕回 | -0.045±0.032 | -0.034±0.042 | -0.040±0.046 | F=22.192 | <0.01 |
| 楔叶 | -0.026±0.058 | -0.025±0.077 | t= 3.702 | <0.01 | |
| 舌回 | -0.027±0.049 | -0.016±0.048 | -0.026±0.062 | F=20.558 | <0.01 |
| 颞中回 | -0.027±0.051 | ||||
| 颞下回 | -0.024±0.051 | -0.025±0.046 | t= 2.945 | <0.01 | |
| 梭状回 | -0.012±0.037 | ||||
| 颞极 | -0.029±0.096 | -0.029±0.065 | t= 2.142 | <0.05 | |
| 前扣带回 | 0.069±0.116 | 0.083±0.105 | t= 4.653 | <0.01 | |
| 后扣带回 | 0.027±0.059 | 0.034±0.059 | 0.046±0.062 | F=24.517 | <0.01 |
| 内嗅皮层 | -0.056±0.088 | -0.087±0.102 | -0.076±0.090 | F=10.972 | <0.01 |
注:AI为侧化指数
有关大脑皮质厚度有研究表明,在许多脑区神经元密度和皮质厚度存在着相反的关系,皮质厚的地方神经元密度降低,最有可能是由于每个神经元的树突和突触的数量增加[5];但是,目前尚缺乏神经生物学的证据证明此结论。还有研究显示,皮质厚度发生变化,通常与白质的扩张、萎缩以及在同一区域的轴突组织增加、减少相关[6],这表明在许多区域皮质厚度与皮质连接的变化有关。虽然在既往研究中,Wiegand等[7]发现皮质厚度与灰质体积存在明显相关性,Narr等[8]等发现灰质厚度与灰质的密度相关;但是近年来的研究显示皮质厚度、体积、表面积和折叠度可以相互独立[9],并在其遗传基础和发展轨迹也不相同[10]。因此,独立研究大脑皮质的每一个形态学指标是非常有必要的。
皮质厚度的研究在神经精神疾病的广泛研究中占有一席之地,近几年来的研究显示,检测大脑皮质厚度对临床免疫代谢失调、孤独症谱系障碍、偏头痛的诊断具有辅助作用[11,12,13]。既往对皮质厚度的相关性研究,以及对皮质厚度偏侧性的影响因素的研究报道较多,发现利手侧别、性别、精神分裂症等都会影响大脑皮质厚度的偏侧性[14,15]。笔者在前期对皮质体积、厚度、表面积和年龄相关性的研究中发现,皮质厚度是一个比皮质体积及表面积更加敏感的指标[16]。因此,笔者将皮质厚度作为一个独立的形态学指标,进一步观察大脑皮质在年龄及偏侧性的双重因素影响下皮质厚度发生的变化,以便于获得更多的信息。
采用MR T1WI测量大脑皮质厚度是一种可以用来评估人脑发育及老化过程中皮质细微变化的方法。前人多数研究都是基于体素信息来测量皮质厚度,即通过计算皮质内的体素点来测量皮质厚度。迄今为止,很少有研究用表面重建方法来测量皮质厚度。而利用FreeSurfer软件测量皮质厚度,取的是从一个曲面到另一个曲面的距离平均值,这样的算法使得皮质厚度的测量更加精准。在本研究中,笔者对大脑MRI进行表面重建,采用FreeSurfer图像分析软件,对大脑皮质厚度进行精确计算与统计学分析,旨在揭示年龄及偏侧性对大脑皮质厚度的双重作用影响,同时也为精神疾病(如精神分裂症)的神经发育、神经变性病变诊治、神经心理学及人类学研究等提供形态学基础。
Im等[17]采用直接计算皮质内外表面相应点之间距离的方法测量青年人大脑皮质厚度,发现青年人大脑皮质厚度为1~4.5 mm,平均2.5 mm。在本研究中,通过表面重建方法对大脑皮质厚度进行精确计算,青年组皮质平均厚度为2.51 mm,与既往研究结果相似。Luders等[18]利用MRI和皮质模式匹配方法,分析了青年健康成人大脑皮质厚度的偏侧性。与其研究结果比较,本研究中青年组大脑皮质厚度的偏侧性有部分相同:如左侧化区域前扣带回、中眶额回,右侧化区域额下回、颞中回、内嗅皮层;而另外一些脑区的皮质厚度偏侧性的结果是不一致的,如额极、楔叶、舌回等。笔者分析,这可能与样本的种族、性别、环境等有关。近年来,Koelkebeck等[19]报道了大脑皮质厚度有明显偏侧性的区域,本研究结果与其相似:如左侧化区域前后扣带回,右侧化区域额下回三角部和岛盖部、颞极、颞中下回、外侧枕回。然而,相对于Koelkebeck等[19]研究结果,笔者还观察到了更多的皮质厚度有明显偏侧性的区域,这可能是由于样本量更大,涵盖的年龄范围更广。这在很大程度上有助于对正常大脑发育及老化的了解,也必将为精神神经疾病的神经发育基础提供更多的理论依据。
有关皮层厚度偏侧性与年龄相关性的研究显示,特定区域皮质厚度的偏侧性随着年龄的变化而变化[20,21],但这些研究均未对偏侧程度(AI)进行观察。本研究结果显示,三个年龄组存在偏侧性的区域,出现了随着年龄的增大出现了偏侧区域的持续、增加及减少的现象,其偏侧性的程度也出现了先增加、再减少。本研究还发现有少数脑区(如后扣带回、外侧枕回、舌回、内嗅皮层等)皮质厚度偏侧性贯穿三个年龄段,但其偏侧程度有着明显的差异,呈现"大-小-大"模式或"小-大-小"模式。这表明随着年龄的改变,大脑皮质厚度的偏侧性、偏侧程度均随之发生了改变。笔者认为,不同脑区随年龄增大,其大脑皮质厚度偏侧性保留、增加、减少现象,提示大脑在正常衰老过程中可能存在代偿机制以应对认知功能的损伤,此结果为神经行为、神经生理疾病的研究提供了新的思路。隆晓菁等[22]在高分辨MRI上,利用多参数模型分析人脑衰老过程中偏侧性的改变情况,结果发现随着年龄增加,大脑偏侧性出现全局性的下降,部分认知相关的区域的偏侧性出现反转。本研究结果与隆晓菁等[22]研究结果有所不同,笔者发现中年组偏侧性脑区数量多于青年组、老年组,呈倒"U"型模式,并未发现偏侧性出现反转的脑区。笔者分析,这可能与样本的数量、分组、性别构成等因素有关。
此外,左智炜等[23]应用FreeSurfer软件进行大脑表面重建,皮层厚度、表面积和体积等解剖学结构测量,并对正常人群大脑皮层言语相关区域的偏侧性进行了研究,发现颞横回皮层厚度呈右侧化不对称,岛叶皮层厚度呈左侧化不对称。本研究得出相似结果,但本研究从不同年龄段中进行观察,发现三个年龄段的部分颞叶、枕叶、外侧裂皮质以及额外侧等区域均观察到皮质厚度呈明显的右侧化。这表明左半球语言网络的核心区域具有更薄的皮层。这种结构模式可能是由于左半球皮层下白质的膨胀延伸,从而使大脑皮层延伸、扩展、变薄[24]。
综上,三个年龄段组中大脑皮质厚度在大部分脑区域存在不同程度的偏侧性差异,不同年龄段组中偏侧性的区域及程度也不相同。因此,皮质厚度可以用来分析大脑皮质结构,在研究大脑病理改变及病理性老化方面也可能有一定价值。本研究局限性在于:(1)每组年龄跨度大,容易存在抽样误差;(2)缺少与其他皮质形态学指标(如皮质体积、表面积等)的对比,未对皮质形态学各指标交叉性进行研究,严谨性有待进一步提高;(3)没有排除性别的差异,在下一步研究中将进一步完善。
所有作者均声明不存在利益冲突



























