
探讨前列腺周围显微神经数目分布及其基本空间结构。
选取2015年1月—2017年12月浙江大学金华医院因膀胱恶性肿瘤行根治性膀胱和前列腺切除术的12例患者的标本进行研究。将12例新鲜全切标本前列腺组织根据自然解剖结构分为基底部、中部和尖部3部分,分别制成病理切片,应用Photoshop 7.0绘图软件以病理切片中心为中点按顺时针分成编号Ⅰ~Ⅻ的12个均等片区,再将前列腺左右两侧相对应的片区合并,成为腹侧区(Ⅻ+Ⅰ区)、腹前外侧区(Ⅱ+Ⅺ区)、前外侧区(Ⅲ+Ⅹ区)、后外侧区(Ⅳ+Ⅸ区)、背后外侧区(Ⅴ+Ⅷ区)和背侧区(Ⅵ+Ⅶ区)6个扇形区域。以前列腺包膜为界线,按照距前列腺包膜的距离2.0 mm和4.0 mm将对前列腺包膜外周围组织从内到外分成A1区、 A2区、A 3区3个环形观察区。分别统计3个解剖部位、6个扇形区域及18个观察区的神经纤维数目,观察神经纤维分布特点及其空间结构。
全组12例标本共获得合格切片168张,最终纳入切片108张,其中前列腺基底部、中部、尖端均纳入36张切片。在前列腺包膜外周围组织内共观察到17 881束神经纤维,其中基底部神经纤维9 443束(52.81%),中部6 102束(34.13%),尖部2 336(13.06%)。前列腺腹侧、腹前外侧、前外侧区神经纤维数目共5 819束(32.54%)少于后外侧、背后外侧和背侧区的12 062束(67.46%)。前列腺包膜外不同观察区神经纤维数目从大到小依次为A1区8 231束,A3区5 963束,A2区3 687束。在3个解剖部位、6个区域中,神经纤维主要分布于前列腺后外侧、背后外侧和背侧区,基底部、中部和尖端神经纤维数目分别为6 576束(36.8%)、4 112束(23.0%)、1 374束(7.6%),其中尤其在背后外侧区域神经纤维分布最多;而腹侧、腹前外侧、前外侧区分别为2 867束(16.0%)、1 990束(11.1%)和962束(3.4%),其中尤其是腹侧区域神经纤维分布最少。前列腺包膜外周围神经在不同解剖部位、区域的分布差异有统计学意义(χ2=552.700, P<0.01)。前列腺包膜外周围神经网三维空间分布特点:(1)后外侧、背后外侧和背侧区神经纤维数目明显多于腹侧、腹前外侧、前外侧区。(2)基底部神经纤维数目为A3区>A1区>A2区,离前列腺包膜远处数目最多;中部神经纤维数目为A1区>A2区>A3区,离前列腺包膜近处数目最多;尖端神经纤维数目下半部为A1区>A3区>A2区,上半部为A1区>A2区>A3区。
前列腺周围神经网络三维解剖结构:在前列腺基底部,神经纤维数目最多,绝大多数分布在前列腺背侧区,远离前列腺包膜的外层;在尖端部,神经纤维数目最少,神经纤维转向分布到腹侧区,离前列腺包膜最近的内层;中部为神经纤维逐渐移行演变区。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
在过去的几十年里,前列腺周围神经网的确切解剖结构一直存在争议,解剖分布似乎比经典描述的更加复杂,且变化多端[1,2]。大量研究结果显示,前列腺周围神经纤维可能更多地向四周扩展,并且可能有相当数量的神经纤维位于前列腺的前外侧和前部[3,4,5,6,7]。但在多项有关前列腺周围神经量化的解剖学研究中,其解剖观察结果均来源于前列腺癌根治手术切除的标本[4,7,8],而不是完整盆腔内脏标本。众所周知,在前列腺癌根治性手术中,手术者会尽可能多地保存前列腺外围组织,这样必然影响对标本周围组织含量和神经数量的研究。同时,以往学者多对前列腺周围神经解剖进行定量研究[4,5,6,7,8],有关前列腺周围神经的三维空间结构的研究未见报道。在本研究中,笔者采用包含较完整的前列腺周围组织结构的膀胱前列腺全切新鲜标本,对前列腺周围神经网络分布进行神经纤维束计数,并构建其空间结构,以期为临床手术中更精准地保留神经网提供解剖学基础。
标本纳入标准:(1)术前明确诊断为膀胱肿瘤,行膀胱前列腺全切+输尿管皮层造口或回肠膀胱的尿流改道手术者;(2)患者术前无前列腺、直肠、盆腔等手术史;(3)标本包含有完整的前列腺周围组织结构,即包含狄氏筋膜、膀胱、前列腺、精囊及输精管、前列腺尿道尖端、紧贴前列腺周围的盆筋膜和相邻的少部分盆底肌肉组织。标本排除标准:(1)膀胱肿瘤已浸润膀胱颈和前列腺;(2)术后病理检查诊断为前列腺癌;(3)膀胱全切后要求行正位新膀胱重建的尿流改道或要求保留性功能。本研究经金华市中心医院医学伦理委员会审查批准(批准号:15伦审第2号)。
纳入2015年1月—2017年12月浙江大学金华医院泌尿外科12例因膀胱恶性肿瘤行根治性膀胱和前列腺切除术患者的标本进行研究。患者年龄61~86岁,平均73岁;病程0.5~19个月,平均3.9个月。术后病理检查:浅表型膀胱尿路上皮癌5例,均为T1期,其中G3级3例、G2级2例;肌层浸润型膀胱癌7例,其中膀胱顶部腺癌1例、尿路上皮癌6例,均为T2~T3期,G2级4例、G3级3例,均未累及膀胱三角区。为确保取材标本的完整性,手术时将前列腺尖部的近端尿道和紧贴前列腺周围的所有盆底筋膜(包括相邻前列腺的盆底肌膜和部分盆底肌肉组织)均完整切除。
KD-3390科迪切片机、KD-TH电脑生物组织摊烤片烘片机,购于中国浙江金华科迪医疗有限公司;LEIKA ST5020染色机、CV5030封片机,购于中国北京中仪光科科技发展有限公司;德国徕卡BOND-MAX全自动免疫组化仪购于北京昊诺斯科技有限公司;樱花TIssue-Tek VIP全自动脱水机购于中国上海聚慕医疗器械有限公司。
根据自然解剖结构,将标本中的前列腺进行大体解剖分区:距前列腺尖端1.0 cm或1.5 cm范围内的区域为尖端区域,离前列腺膀胱交界处1.0 cm或1.5 cm范围内的区域为基底区域,两区域之间的前列腺标本为中部区域;根据前列腺长径选取划分范围标准:当前列腺长径<5 cm时,划分范围选用1.0 cm,≥5 cm时,划分范围选用1.5 cm。见图1。
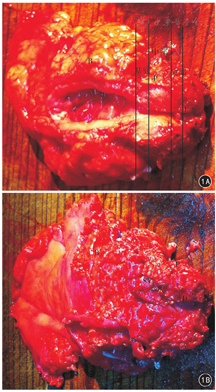

注:B为膀胱;D为狄氏筋膜;M为相邻少部分盆底肌肉组织;P为前列腺;SV为精囊及输精管;U为前列腺尿道尖端
根据分区,分别将标本横断切成厚5 mm的大病理切片,用10%甲醛固定,常规石蜡包埋。采用KD-3390科迪切片机连续切成3 μm的大切片,每3张连续的切片定为一组,每组第1和第3张S-100免疫组织化学神经染色用于神经数目计数,第2张HE染色用于切片质量筛查。
应用Photoshop 7.0绘图软件将大切片以病理切片中心为中点按顺时针分成12个均等片区并按顺时针编号,编号Ⅰ~Ⅻ。将前列腺左右两侧相对应的片区合并,成为腹侧区(Ⅻ+Ⅰ区)、腹前外侧区(Ⅱ+Ⅺ区)、前外侧区(Ⅲ+X区)、后外侧区(Ⅳ+Ⅸ区)、背后外侧区(V+Ⅷ区)和背侧区(Ⅵ+Ⅶ区)6个大切片扇形区域:其中,腹侧、腹前外侧、前外侧区为前列腺切片的上半部,后外侧、背后外侧和背侧区为前列腺切片的下半部;背后外侧区(V+Ⅷ区)为目前公认的经典神经血管束(neurovascular bundle, NVB )解剖区。然后再以前列腺包膜为界线对前列腺包膜外包含神经的周围组织进行更细分区:按照离前列腺包膜的距离2.0 mm和4.0 mm将每个片区进一步细分成3个环形观察区,从内到外距离前列腺包膜<2.0 mm为A1区、2.0~4.0 mm为A2区,>4.0 mm为A3区。至此所有标本前列腺包膜外区域均分为3个解剖区段、6个大切片扇形区域及18个观察区。见图2。
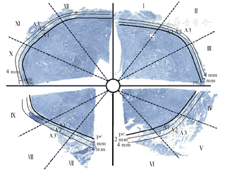

注:PC为前列腺包膜
由1位病理科主任医师抽取每组切片中HE染色的大切片进行初步评估筛查,对制作切片质量较差,或包含周围神经组织不完整者,此组3张切片均予以排除;对初步筛选合格者,选择该组中2张S-100神经染色的切片,作为神经纤维观察计数备用切片,从2张切片中再选1张最佳切片进行分区编号和观察区标记。
由另外2位病理科主任医师对入选切片中的18个观察区分别进行神经纤维观察计数。将合格的病理切片采用10、20、40、100、200倍放大倍数,分别观察每个观察区内神经纤维数目,最终选取观察效果最佳放大倍数进行计数:分别统计3个解剖部位、6个大切片扇形区域及18个观察区的神经纤维数目和百分比。
应用SPSS 16.0统计软件进行数据分析。服从或近似服从正态分布的计量资料以 ±s表示,不同部位间各解剖区段、片区及观察区神经数目的分类资料的比较采用χ2检验。以P<0.05为差异有统计学意义。
±s表示,不同部位间各解剖区段、片区及观察区神经数目的分类资料的比较采用χ2检验。以P<0.05为差异有统计学意义。
全组12例标本共获得合格大切片168张,其中前列腺基底部、中部、尖端纳入切片统计见表1。
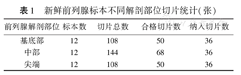
新鲜前列腺标本不同解剖部位切片统计(张)
新鲜前列腺标本不同解剖部位切片统计(张)
| 前列腺解剖部位 | 标本数 | 切片总数 | 合格切片数 | 纳入切片数 |
|---|---|---|---|---|
| 基底部 | 12 | 108 | 50 | 36 |
| 中部 | 12 | 144 | 68 | 36 |
| 尖端 | 12 | 108 | 50 | 36 |
在12例标本中,前列腺包膜外周围组织内共观察到17 881束神经纤维,位于尖端的神经纤维总数明显少于中部、基底部。6个切片扇形区:前列腺切片上半部的腹侧、腹前外侧、前外侧区神经纤维数目共5 819束(32.54%)少于下半部后外侧、背后外侧和背侧区的12 062束(67.46%)。前列腺包膜外不同观察区神经纤维数目总体分布为A1区>A3区>A2区。见表2。
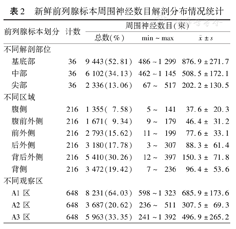
新鲜前列腺标本周围神经数目解剖分布情况统计
新鲜前列腺标本周围神经数目解剖分布情况统计
| 前列腺标本划分 | 计数 | 周围神经数目(束) | |||
|---|---|---|---|---|---|
| 总数(%) | min~max |  ±s ±s | |||
| 不同解剖部位 | |||||
| 基底部 | 36 | 9 443(52.81) | 486~1 299 | 876.9±271.7 | |
| 中部 | 36 | 6 102(34.13) | 462~1 145 | 508.5±172.1 | |
| 尖部 | 36 | 2 336(13.06) | 67~517 | 202.2±130.5 | |
| 不同区域 | |||||
| 腹侧 | 216 | 1 355( 7.58) | 5~141 | 37.6± 20.3 | |
| 腹前外侧 | 216 | 1 671( 9.34) | 9~179 | 46.4± 31.2 | |
| 前外侧 | 216 | 2 793(15.62) | 11~199 | 77.6± 33.1 | |
| 后外侧 | 216 | 3 180(17.78) | 3~307 | 88.3± 61.4 | |
| 背后外侧 | 216 | 5 410(30.26) | 12~397 | 150.3± 71.8 | |
| 背侧 | 216 | 3 472(19.42) | 7~236 | 96.4± 53.6 | |
| 不同观察区 | |||||
| A1区 | 648 | 8 231(64.03) | 598~1 323 | 685.9±173.6 | |
| A2区 | 648 | 3 687(20.62) | 236~511 | 307.5± 69.3 | |
| A3区 | 648 | 5 963(33.35) | 241~1 392 | 496.9±265.2 | |
在前列腺切片上半部的前外侧、腹前外侧和腹侧区域,神经纤维基底部前外侧区域最多、尖部腹前外侧区域最少;在前列腺切片下半部的后外侧、背后外侧和背侧表面区域,基底部背后外侧区域最多、尖部后外侧区域最少。
在3个解剖部位、6个区域中,神经纤维主要分布于前列腺切片的下半部的后外侧、背后外侧和背侧区,尤其在背后外侧区域最多;而上半部的前外侧、腹前外侧和腹侧区神经纤维分布明显减少,尤其是腹侧区区域最少。前列腺包膜外周围神经的分布差异有统计学意义(P<0.01)。见表3。
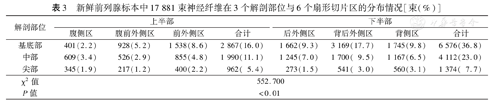
新鲜前列腺标本中17 881束神经纤维在3个解剖部位与6个扇形切片区的分布情况[束(%)]
新鲜前列腺标本中17 881束神经纤维在3个解剖部位与6个扇形切片区的分布情况[束(%)]
| 解剖部位 | 上半部 | 下半部 | ||||||
|---|---|---|---|---|---|---|---|---|
| 腹侧区 | 腹前外侧区 | 前外侧区 | 合计 | 后外侧区 | 背后外侧区 | 背侧区 | 合计 | |
| 基底部 | 401(2.2) | 928(5.2) | 1 538(8.6) | 2 867(16.0) | 1 662(9.3) | 3 169(17.7) | 1 745(9.8) | 6 576(36.8) |
| 中部 | 609(3.4) | 526(2.9) | 855(4.8) | 1 990(11.1) | 1 245(7.0) | 1 700( 9.5) | 1 167(6.5) | 4 112(23.0) |
| 尖部 | 345(1.9) | 217(1.2) | 400(2.2) | 962( 5.4) | 273(1.5) | 541( 3.0) | 560(3.1) | 1 374( 7.7) |
| χ2值 | 552.700 | |||||||
| P值 | <0.01 | |||||||
基底部:前列腺下半部的后外侧、背后外侧和背侧区神经纤维数目明显多于上半部的前外侧、腹前外侧和腹侧区。不同观察区神经纤维数目分布特点,均为A3区>A1区>A2区,离前列腺包膜远处数目最多。提示神经多分布于包膜下半部的A3区。
中部:下半部的后外侧、背后外侧和背侧区神经纤维数目明显多于上半部的前外侧、腹前外侧和腹侧区。不同观察区神经纤维数目分布特点均为A1区>A2区>A3区,离前列腺包膜近处数目最多。提示上下半部之间分布均衡,在A1、A2、A3区逐渐增多。
尖端:下半部的后外侧、背后外侧和背侧区神经纤维数目明显多于上半部的前外侧、腹前外侧和腹侧区。不同观察区神经纤维数目分布特点,下半部为A1区>A3区>A2区,上半部为A1区>A2区>A3区。提示神经多分布于上下半部的A1区。见图3、表4。
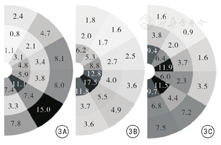

注:图中颜色的深浅表示占百分比的高低,颜色越深百分比越高。最内圈为A1片区,中间圈为A2区,最外圈为A3片区
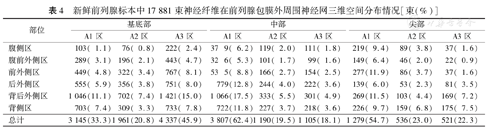
新鲜前列腺标本中17 881束神经纤维在前列腺包膜外周围神经网三维空间分布情况[束(%)]
新鲜前列腺标本中17 881束神经纤维在前列腺包膜外周围神经网三维空间分布情况[束(%)]
| 部位 | 基底部 | 中部 | 尖部 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| A1区 | A2区 | A3区 | A1区 | A2区 | A3区 | A1区 | A2区 | A3区 | |
| 腹侧区 | 103( 1.1) | 76( 0.8) | 222( 2.4) | 37 9( 6.2) | 119( 2.0) | 111( 1.8) | 219( 9.4) | 89( 3.8) | 37( 1.6) |
| 腹前外侧区 | 289( 3.1) | 196( 2.1) | 443( 4.7) | 32 6( 5.3) | 101( 1.7) | 99( 1.6) | 149( 6.4) | 46( 2.0) | 22( 0.9) |
| 前外侧区 | 449( 4.8) | 322( 3.4) | 767( 8.1) | 53 5( 8.8) | 166( 2.7) | 154( 2.5) | 277(11.9) | 86( 3.7) | 37( 1.6) |
| 后外侧区 | 555( 5.9) | 356( 3.8) | 751( 8.0) | 779(12.8) | 244( 4.0) | 222( 3.6) | 139( 6.0) | 53( 2.3) | 81( 3.5) |
| 背后外侧区 | 1 046(11.1) | 702( 7.4) | 1 421(15.0) | 1 066(17.5) | 333( 5.5) | 301( 4.9) | 269(11.5) | 103( 4.4) | 169( 7.2) |
| 背侧区 | 703( 7.4) | 309( 3.3) | 733( 7.8) | 722(11.8) | 227( 3.7) | 218( 3.6) | 226( 9.7) | 159( 6.8) | 175( 7.5) |
| 总计 | 3 145(33.3) | 1 961(20.8) | 4 337(45.9) | 3 807(62.4) | 1 190(19.5) | 1 105(18.1) | 1 279(54.7) | 536(23.0) | 521(22.3) |
近年来,神经保留的根治性前列腺切除术已成为治疗前列腺癌不可或缺的技术,尽管目前机器人神经保留手术使并发症有所降低,但疗效仍不满意[8,9,10]。目前,对前列腺周围神经纤维网的确切解剖结构一直未明,不同研究者分歧明显[11,12,13]。既往在对前列腺周围神经量化的解剖学研究中,应用的是前列腺癌根治手术切除的标本,其周围组织结构不完整,必然影响研究结果。在本研究中,选取的前列腺标本周围结构完整,包含附着狄氏筋膜、膀胱下半部、前列腺、精囊、输精管、前列腺尿道尖端、背静脉复合体和相邻的少部分盆底肌肉等周围组织;同时,将标本分为基底部、中部和尖部3个解剖部位,制成病理切片后,将前列腺包膜外组织分为6个区域、18个观察区,观察统计神经纤维数和解剖定位情况,探讨前列腺周围神经网分布和基本解剖空间结构。
1982年Walsh和Donker[14]通过对男性胎儿和新生儿尸体的血管神经走行进行解剖研究,发现了海绵体神经的走行,提出了NVB的概念,认为NVB是沿着前列腺后背外侧走行的束状结构,是负责男性勃起的副交感神经分支[15]。这一对前列腺周围神经网构成的报道,具有里程碑意义。然而,近年来较多学者在成人盆腔神经分布的研究中发现,前列腺部位的副交感神经以放射状分布,只有少数患者存在如Walsh等描述的与血管一起形成束状的经典NVB结构[16,17]。El-Hakim等[18]报道,组织学或生理学几乎没有相关文献报道宏观和微观假定的NVB解剖学结构。Tewari等[19]认为,在成人尸体神经血管走形存在三区神经结构,即膀胱颈与精囊周围神经,直肠前列腺交界连接部的经典NVB和前列腺两侧神经网。可见,前列腺周围神经网的真正解剖结构尚未明了。
Ganzer等[20]对前列腺周围神经纤维数目的进行研究,发现前列腺基底部多于中部,尖端显著降低,从基底(50.2 mm2)—中部(30.7 mm2)—尖端(13.3 mm2)神经总面积明显减少。还有研究认为,神经纤维数目的减少是由于神经纤维进入了周围组织器官中(如膀胱颈、精囊、前列腺、直肠及盆底肌肉等),正如树干发出树枝一样,发出功能性分支所致[21]。本组研究结果显示神经纤维总数目在基底部、中部和尖端分别占52.81%、34.13%和13.57%,也逐渐显著减少,与既往文献报道相仿。
Kiyoshima等[4]研究了140个连续根治性前列腺切除术标本发现:在前列腺后背外侧区存在典型NVB的病例只有48%,剩余的病例,整个外侧神经为分散分布。Eichelberg等[7]通过观察31例根治性前列腺切除标本患者的神经分布发现,大量的神经纤维位于更高的前外侧位置。而Ganzer等[8]对非保留神经的根治性前列腺切除术标本研究发现:前列腺周围神经总面积的百分比是后背外侧(后外侧和背后外侧)最高,其中基底部、中部和尖端分别占84.5%、75.1%和74.5%。本组研究结果显示:前列腺周围神经纤维有67.46%位于后外侧、背后外侧和背侧,其中背后外侧区的前列腺基底部、中部和尖部神经纤维占比分别为17.7%、9.5%和3%。本研究结果中神经网解剖分布特点与文献报道相似,绝大部分神经纤维位于前列腺后外侧、背后外侧和背侧,背后外侧和后外侧区神经纤维占比最高。
有关前列腺周围神经网的三维空间分布情况,未见描述详细的相关文献报道,只有少数文献进行过简略描述[2,19,20,21]:前列腺周围的盆腔神经丛与尾部神经相连,距前列腺两侧各自血管蒂只有0~7 mm,该神经丛在精囊和前列腺基底部几乎是贴近其表面行走,与精囊距离最短,1.50~1.76 mm,距膀胱颈约4 mm和距肛提肌2 mm。Costello等[12]用免疫组织化学分析发现:神经纤维主要位于前列腺的前外侧,但参与勃起功能的副交感神经只有极少数(18.8%),而大部分观察到的副交感神经纤维位于前列腺背外侧。Takenaka等[22]研究发现,副交感神经在前列腺尖端3~9点钟以上神经纤维绝对数目增加,但用电刺激NVB后部纤维增加海绵体内压力,而刺激前部纤维增加尿道内压力。在既往研究中仅对前列腺周围神经网三维解剖进行了粗略描述和简单神经类型分布的描述,缺乏较详细、精确的三维结构的研究。本组未对神经纤维进行分类,但通过对18个观察区神经纤维的三维结构研究发现:在前列腺基底部,神经纤维网主要分布在距离前列腺包膜较远的外周层筋膜;在尖端,神经纤维网发布在最靠近距离前列腺包膜最近的内层筋膜内;在中部为过渡区。可见,前列腺周围神经网从前列腺基底部到尖部分布是从远离前列腺包膜的外层(A3区)转为逐渐靠近包膜内层(A1区),存在神经纤维"向内集聚"现象;同时,总神经纤维数目显著减少,神经纤维逐渐从背侧向腹侧转移,存在神经纤维"向前移行"现象。
本研究结果提示,手术中最易损伤神经纤维网的解剖部位是前列腺尖端的腹侧、腹前外侧和前外侧区,因为该处神经网距离前列腺包膜最近。本研究为临床避免前列腺手术相关神经损伤提供了解剖学基础。由于本研究样本数相对较少,仅从解剖学角度观察前列腺周围神经数目分布及三维空间结构,缺乏影像解剖学支持。在今后尚需加大样本,拟从影像学的角度,进一步研究其三维解剖结构。
所有作者均声明不存在利益冲突



























