
探讨视神经脊髓炎谱系疾病(NMOSD)患者神经性瘙痒(NP)的临床特征及意义。
回顾性分析2016年7月—2019年3月蚌埠医学院第一附属医院35例NMOSD患者的临床资料,其中男9例、女26例,年龄13~85岁。依据是否合并NP,分为单纯NMOSD组(25例)和合并NP组(10例),比较两组患者的临床特征,包括水通道蛋白4抗体(AQP4-Ab)阳性、性别、发病年龄、受累脊髓节段、脊髓病变分布及扩展残疾状态量表(EDSS)评分等;分析NP的临床特点,NP发作与病程、病变部位的关系,NP的治疗效果。
35例NMOSD患者中10例(28.6%)有NP表现,男4例、女6例。合并NP组患者AQP4-Ab阳性(10/10)较单纯NMOSD组(60%,15/25)高,差异有统计学意义(P=0.033);两组患者性别分布、发病年龄、受累脊髓节段及EDSS评分等差异均无统计学意义(P值均>0.05)。10例NP患者均为10 d内先后出现NP及其他脊髓炎或脑干症状,其中2例NP为NMOSD首次发病的首发症状,3例为复发的首发症状。NP常发生于颈枕部、上肢、肩胛部、面部及其他部位,呈中重度;9例(9/10)NP的发生部位经MRI证实与受累的脊髓节段有明确的关系。
NP可能是NMOSD患者被忽视的一种较为常见的首发症状之一,可能与AQP4-Ab阳性有关,对脊髓的病变定位有一定的提示意义,也可能提示NMOSD急性脊髓炎的发作,了解其临床特征具有一定的诊断、定位诊断及指导治疗等临床价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders, NMOSD)是一组中枢神经系统(central nervous system, CNS)炎性脱髓鞘疾病,包括视神经炎、长节段横贯性脊髓炎、急性脑干综合征、极后区综合征、间脑综合征等。血清水通道蛋白4抗体(aquaporin-4 antibody, AQP4-Ab)作为NMOSD高度特异性生物标志物,具有重要的临床意义,但仍有高达40%的NMOSD不伴有AQP4-Ab[1]。除此之外,随着对NMOSD的认识不断深入,越来越多的非核心症状及其意义被神经病学临床所重视。神经性瘙痒(neuropathic pruritus, NP)是由皮肤的瘙痒神经元传导通路病变或功能失常所致而非瘙痒原刺激所致的瘙痒。近年有研究显示,NP可能是NMOSD被忽视的特异性临床症状之一,严重的NP可影响患者日常生活质量,并可引发情绪问题[2,3]。目前,国内对于NMOSD患者的NP情况了解甚少,因此,本研究通过对NMOSD患者NP的观察和分析,旨在进一步认识其临床特征,并探讨其可能的临床意义。
纳入标准:(1)患者符合2015版Wingerchuk等[4]修订的NMOSD诊断标准;(2)在发病或复发时行头颅及脊髓MRI;(3)随访时间≥3个月。排除标准:(1)其他中枢神经系统脱髓鞘疾病,如副肿瘤性神经病、多发性硬化、临床孤立综合征等;(2)合并其他神经系统疾病,如神经系统变性疾病、肿瘤、脑血管病、中毒等;(3)CNS外伤或手术史者。
回顾性分析。纳入2016年7月—2019年3月蚌埠医学院第一附属医院神经内科NMOSD患者35例,其中男9例、女26例,年龄13~85岁;合并系统性自身免疫性疾病5例,妊娠期或哺乳期2例。本研究符合《赫尔辛基宣言》要求。
经皮肤科有经验的医生会诊,排除皮疹等其他原因引起的瘙痒,且与神经症状有关,综合判定为NP。NP程度采用数字评分量表(numeric rating scale,NRS)[5]进行评定(0~10,0代表没有瘙痒,10代表可以想到最严重程度的瘙痒)。依据是否合并NP,将患者分为单纯NMOSD组和合并NP组。
患者入院后明确诊断为NMOSD急性发作期,即给予免疫治疗甲基强的松龙1 g/d,静脉注射5 d,及/或人血免疫球蛋白每天0.4 g/kg,静脉注射5 d,继以口服泌尼松60 mg/d,并逐渐规律减量维持治疗。NP组同时选择性给予抗癫痫药物奥卡西平、普瑞巴林等药物口服对症治疗,奥卡西平(10例)为基础治疗、效果不佳时添加普加巴林(5例)对症治疗;并确保治疗过程中避免使用任何有可能加重或引起瘙痒的药物及方法。
比较单纯NMOSD组和合并NP组患者的临床特征:性别、发病年龄、受累脊髓节段、脊髓病变分布、血清AQP4-Ab阳性,及扩展残疾状态量表(expanded disability status scale, EDSS)评分等。患者入院后在知情同意下采集静脉血,采用基于猴眼神经和猴小脑的间接免疫荧光法测定血清AQP4-Ab水平。影像学资料由一位影像科副主任医生阅片并判断中枢神经系统的MRI病灶部位、范围及有无强化并记录。EDSS评分,分别由两位神经内科主治医生独立完成并校对后取平均值。
分析NP发作临床特点、与病程和发病部位的关系,并观察治疗效果;记录患者发病时间、NMOSD的初发情况及复发情况;NP发作的部位、类型(阵发性/连续性)、程度、每次持续时间,瘙痒发作频率、昼夜变化、触发和缓解因素、与疼痛的关联、伴随症状的出现,有无抓伤的冲动及痕迹等。疗效判定标准:瘙痒程度对照NRS评分,下降20%以下为无效,下降20%~60%为好转,下降61%~90%为明显好转,下降91%~完全消失为缓解。
所有患者治疗后3个月进行电话随访,发生NP者在接受上述治疗后2周及3个月分别进行随诊及电话随访,主要记录NP症状的变化及其他神经系统症状体征的变化等临床资料。
应用SPSS 24.0统计软件进行统计学分析。服从正态分布的计量资料以 ±s表示,组间比较采用独立样本t检验;分类资料采用Fisher确切概率法。以P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验;分类资料采用Fisher确切概率法。以P<0.05为差异有统计学意义。
35例NMOSD患者中:2例有视神经炎和AQP4-Ab阳性者,无长节段横贯性脊髓炎,也未出现NP;另33例有长节段横贯性脊髓炎,其中8例AQP4-Ab阴性患者均未出现NP, 25例AQP4-Ab阳性患者中有10例(10/25,40%)出现NP。即35例NMOSD患者中共10例(10/35,28.6%)出现NP,其中男4例、女6例。瘙痒出现前后10 d内伴发有其他感觉症状,包括感觉减退(3/10)、感觉过敏(1/10)、麻木(4/10)、疼痛(5/10)。
合并NP组AQP4-Ab阳性率(10/10)较单纯NMOSD组(60%,15/25)高,差异有统计学意义(P=0.033),提示AQP4-Ab阳性的NMOSD有易于发生NP趋向。但两组间发病年龄、性别占比、受累脊髓节段、EDSS评分以及合并其他自身免疫抗体等因素比较,差异均无统计学意义(P值均>0.05)。见表1。
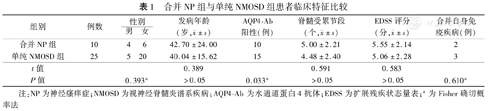
合并NP组与单纯NMOSD组患者临床特征比较
合并NP组与单纯NMOSD组患者临床特征比较
| 组别 | 例数 | 性别 | 发病年龄(岁, ±s) ±s) | AQP4-Ab阳性(例) | 脊髓受累节段(个, ±s) ±s) | EDSS评分(分, ±s) ±s) | 合并自身免疫疾病(例) | |
|---|---|---|---|---|---|---|---|---|
| 男 | 女 | |||||||
| 合并NP组 | 10 | 4 | 6 | 42.70±24.00 | 10 | 5.00±2.21 | 5.55±2.14 | 2 |
| 单纯NMOSD组 | 25 | 5 | 20 | 40.04±15.62 | 15 | 4.48±2.40 | 5.06±2.28 | 3 |
| t值 | 0.389 | 0.591 | 0.583 | |||||
| P值 | 0.393a | >0.05 | 0.033a | >0.05 | >0.05 | 0.610a | ||
注:NP为神经瘙痒症;NMOSD为视神经脊髓炎谱系疾病;AQP4-Ab为水通道蛋白4抗体;EDSS为扩展残疾状态量表;a为Fisher确切概率法
合并NP组10例中,NP的发生部位见于枕、颈部4例、肩胛部3例、上肢2例、面部2例、下肢1例,见表2。6例为单侧分布,4例为双侧分布。NP以阵发性为主,本组有6例,每次持续时间为10~600 s,每天发生1~5次不等;也可以表现为持续性,有4例患者NP发作持续数天至数月,其中1例患者持续约1周后随着其他神经系统症状的出现NP自发缓解。NP程度的NRS评分2~9分,中位数为5.5分。因出汗或局部温度变化而诱发NP 1例,在触摸、接触热水时加剧5例;搔抓多可临时减轻NP,1例患者因反复、过度搔抓而致局部皮肤抓伤。
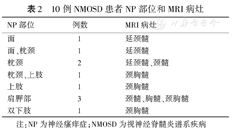
10例NMOSD患者NP部位和MRI病灶
10例NMOSD患者NP部位和MRI病灶
| NP部位 | 例数 | MRI病灶 |
|---|---|---|
| 面 | 1 | 延颈髓 |
| 面、枕颈 | 1 | 延颈髓 |
| 枕颈 | 2 | 延颈髓、颈髓 |
| 枕颈、上肢 | 1 | 颈胸髓 |
| 上肢 | 1 | 颈胸髓 |
| 肩胛部 | 3 | 颈髓、胸髓、颈胸髓 |
| 双下肢 | 1 | 颈胸髓 |
注:NP为神经瘙痒症;NMOSD为视神经脊髓炎谱系疾病
10例NP患者均在NP出现前或稍后表现出长节段横贯性脊髓炎相应的其他症状体征,且相应MRI均显示出新鲜病灶,部分有增强,高度提示NP与新发脊髓炎密切相关。其中5例NP为首次长节段横贯性脊髓炎时出现,且2例患者的NP为首发症状,出现在其他感觉、运动症状前2~10 d;3例患者NP是长节段横贯性脊髓炎复发的首发症状,其中1例患者的NP不仅是首次发病的首发症状,同时也是复发时的首发症状。
10例NP患者中,1例NP部位累及双下肢,其MRI显示颈髓、上胸髓炎症,NP部位与MRI显示病灶节段支配区无明确关联;余9例NP患者均经头部及脊髓MRI证实存在有与NP相应支配节段的脑干或脊髓的炎性责任病灶,呈T1略低信号、T2高信号,增强扫描偶呈局灶性斑点样轻度强化,且长节段横贯性脊髓炎的病变部位均位于脊髓中央,其中2例患者累及延髓最后区。见表2。
治疗后本组10例患者瘙痒症状均有改善:两周随访期NRS为0-4分,中位数为2分,其中3例完全缓解,5例明显好转,2例好转;3个月随访期NRS为0-3分,中位数为0.5分,其中7例完全缓解,3例明显好转,其中4例患者对症药物持续应用。
视神经脊髓炎由Devic和Gault于1894年首次描述,是一种针对星形胶质细胞的致残性自身免疫疾病,以严重的、复发性视神经炎、长节段横贯性脊髓炎为主要临床表现。2004年,Lennon等[6]发现了AQP4-Ab,自此将视神经脊髓炎与多发性硬化区别开来。欧洲神经科学协会联盟于2010年对NMOSD进行了明确的定义[7]:NMOSD是和视神经脊髓炎发病机制相似,但临床表现并不完全相符的一组相关性疾病。越来越多研究者认为AQP4-Ab是与NMOSD发病密切相关的生物学标志物,为此,视神经脊髓炎诊断国际专家组于2015年对NMOSD诊断标准进行了再次修订,凸显了AQP4-Ab在NMOSD中的诊断地位[4]。
NP的病理生理机制还不完全清楚,外周无髓C纤维是瘙痒感觉的传入纤维,背根神经节有一个特定的表达胃泌素释放蛋白的神经元亚群可以传递瘙痒冲动。瘙痒在中枢神经系统的传导可能是由组胺能神经元或非组胺能(5-羟色胺、P物质、前列腺素等)神经元完成的[8],在脊髓后角的胃泌素释放蛋白受体神经元对瘙痒的传导具有高度的特异性,传入冲动从脊髓后角通过脊髓丘脑束经丘脑到初级体感皮层[9]。类似的传导途径也见于三叉神经感觉系统。脊髓或大脑的中枢神经通路上任何一点的损伤都可能引起NP。
NP可以由多种周围神经疾病引起,如疱疹后神经痛、创伤性神经损伤等。也可以与中枢神经系统疾病有关,如脊髓肿瘤、脊髓空洞症等可以引起局灶性NP[10],均与脑和脊髓中枢神经机制有关。多发性硬化患者的NP最初报道于1975年,主要见于脊髓型多发性硬化,表现为发作性。笔者观察到,NMOSD的NP常见特征与多发性硬化的NP相似:表现为突然发作,局部性瘙痒,发作时间多从几秒到几分钟甚至持续性,以中重度瘙痒为主,个别病例NP程度较重,因搔抓可短暂性减轻瘙痒症状导致皮肤有抓痕。本研究结果显示,NMOSD患者的NP发生率为28.6%(10/35),远远高于多发性硬化报道的4.5%[11,12,13],且NMOSD并发NP组的AQP4-Ab阳性率明显高于单纯NMOSD组。笔者推测其差异的机制可能在于:(1)NMOSD典型的脱髓鞘病变在于脊髓灰质,以损伤脊髓前、后角神经元为主,而脊髓后角富含有参与NP调节的胃泌素释放蛋白受体和神经递质B受体神经元;但多发性硬化通常损伤脊髓周围的白质传导纤维[5,14,15],NMOSD脊髓损害时,NP相关神经元更易受累。(2)参与NP调节的神经元高度表达AQP4,在NMOSD中更易受累,故NMOSD发生NP较多,且AQP4-Ab阳性者NP更多[16]。(3)部分脱髓鞘损伤不足以造成永久性神经功能缺失,但可以引起周围轴突的轻微刺激,导致阵发性瘙痒;重要的是在NMOSD活动性髓鞘脱失病灶中,可见更多的血管周围免疫球蛋白、补体沉积及显著的嗜酸性粒细胞和嗜中性粒细胞浸润,这与多发性硬化不同[17],此病理方面的不同所致的内源性瘙痒刺激原的差异可能引起NP发生率的差异。但是,如想进一步明确NP罹患率的真实差异,仍需对NMOSD的各临床指标与发生NP的相关性进行前瞻性、对照性的大样本研究。
本研究中,有1例NMOSD患者的NP部位累及双下肢,其MRI显示有颈部、上胸部脊髓炎,即NP位于非病变脊髓节段支配区。其余9例NP均位于后枕颈部、肩胛部、面部及上肢,且伴有NP分布区其他类型感觉障碍(如神经痛、感觉过敏、麻木、感觉减退等),NP分布在其他类型感觉障碍范围之内,其中1例患者的NP分布区相应上肢出现周围性运动神经元受损的临床改变及电生理改变;该9例NP患者MRI均检出与症状、体征相对应节段的延髓及/或脊髓炎性责任性病灶,与既往的病例报道及多数研究结果相似[5]。说明NP的分布与其他临床表现及影像学表现有明显的关联,对NMOSD的定位诊断有一定提示意义。有研究发现,少数NP分布区与影像学脊髓病灶无明确相关[13],进而推测NP和同样富含有AQP4的中脑导水管周围灰质的NP传导抑制区域受损可能也有关系[13,18,19];此或是NMOSD之NP的又一发生机制,但也不能完全排除类似多发性硬化累及脊髓白质(脊髓丘脑束)传导路径而致NP的可能。由于此论点不能解释多数病例,故尚需进一步研究证实。
对于并发NP的NMOSD的治疗,因存在急性期发作证据,一般采用糖皮质激素治疗的基础上加用NP的对症药物治疗[13]。本研究中均采用甲基强的松龙及丙种球蛋白免疫治疗基础上,对症治疗主要加用奥卡西平、普加巴林,瘙痒症状无论短期随访或长期随访均获明显好转,但仍有患者需要维持药物的长期联合治疗。
本研究结果显示:NP是NMOSD的发病(包括首次发病及复发)主要症状之一;且可以作为首发症状,在其他NMOSD核心症状之前数日出现。与既往一些病例报道或研究结果类似[11,20,21],也就是说无法解释的瘙痒,尤其是有NMOSD发作史者,瘙痒有时可能是NMOSD发病的"警示性信号",像视神经炎、长节段横贯性脊髓炎等核心症状一样,其对NMOSD的定性及定位诊断可能有很大的价值,尤其对快速识别复发至关重要[5,21]。且NP随着免疫治疗后其他临床症状的好转而好转甚至缓解,同样提示对NMOSD的预后有着一定的预测意义。
综上,NP(尤其位于头颈部、上肢的局灶性NP)是NMOSD的又一可能被忽视的较常见症状之一,可为首次发病或复发的首发症状之一,且可能与AQP4-Ab及NMOSD的脊髓(尤其颈、胸髓)损伤有关,对脊髓病变的定位有一定的提示意义;也可能提示NMOSD急性脊髓炎的发作,具有一定的临床判断价值,值得临床重视。但因样本量等原因,我们的研究可能存在一定的选择性偏倚,后续将进一步扩大样本量,进行前瞻性研究,尽量纳入更为细致的指标及进行更长时间的随访,以期更加全面而准确地认识NMOSD的NP临床特征及其意义。
所有作者均声明不存在利益冲突



























