
探讨全髋关节置换术(THA)治疗脊髓灰质炎后遗症患者非瘫痪侧髋关节发育不良(DDH)的临床效果。
回顾性分析2015年1月—2018年4月解放军东部战区总医院骨科收治的12例非瘫痪侧因DDH行THA的脊髓灰质炎后遗症患者的临床资料。其中男5例,女7例;年龄35~52岁,平均40.2岁;CroweⅠ型6髋,CroweⅡ型5髋,CroweⅢ型1髋。患者均采用后外侧入路治疗。观察患者手术时间、术后住院时间、出血量及并发症;对比手术前后患者Harris髋关节评分和疼痛VAS变化,采用Harris髋关节评分评定疗效。
本组12例患者均顺利完成手术。手术时间51~91(64.9±11.0)min;术中出血量203~347(282.7±44.4)mL,术后急性失血量353~485(414.2±51.6)mL;术后住院时间4~9 d。术后无感染、骨折、神经血管损伤等并发症发生,手术切口均获得一期愈合。术后患者均获随访6~24个月,平均18个月。随访期间,患者下地行走良好,无假体脱位及假体松动发生。末次随访髋关节Harris评分较术前明显增加,分别为(62.8±7.52)和(90.2±2.64)分;末次随访VAS较术前明显降低,分别为0.00(0.00, 0.00)分和4.00(3.00, 6.00)分,差异均有统计学意义(t=11.913、Z=10.864,P值均<0.05)。术后髋关节Harris评分评定:优10髋,良2髋。
通过对髋关节假体安放位置进行合理设计,采用THA治疗脊髓灰质炎后遗症患者非瘫痪侧DDH可以取得满意的疗效。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊髓灰质炎是由一组亲神经病毒引起的急性高致残率传染病,主要损害脊髓前角细胞,导致运动神经纤维变,使支配的肌肉产生弛缓性瘫痪。从20世纪50年代开始,各国普遍强制接种脊髓灰质炎疫苗后该病的发病率明显下降[1]。但该疾病的患者大多数会存在后遗症,主要表现为患肢内收外展无力、双侧下肢不等长、骨盆向无力侧倾斜、跛行等[2]。正是由于这种下肢神经肌肉系统的异常,加之骨盆倾斜与步态的不协调,脊髓灰质炎后遗症患者的非瘫痪侧下肢常被称之为"顺风腿"。我们在临床工作中发现,这些患者非瘫痪侧股骨头往往部分脱位于髋臼,关节面覆盖明显不足,长时间行走后逐渐出现典型的髋关节发育不良(developmental dysplasia of hip, DDH)症状。对于这些患者来说,全髋关节置换术(total hip arthroplasty, THA)是治疗其非瘫痪侧DDH的有效手段。但是,与普通DDH患者不同,脊髓灰质炎后遗症患者手术后仍不能恢复髋关节正常生物力学状态,如果按照常规位置进行假体安装可能造成术后反复脱位和假体松动[3]。因此,需要对假体置入位置做出合理规划,提高手术成功率与患者满意度。本研究探讨改良THA在脊髓灰质炎后遗症患者治疗中的应用效果,旨在为脊髓灰质炎后遗症非瘫痪侧DDH患者外科治疗提供参考。
纳入标准:(1)脊髓灰质炎后遗症期患者,非瘫痪侧肌力大于3级;(2)DDH合并髋关节炎保守治疗无效者;(3)有强烈的手术意愿,能配合治疗及随访者。排除标准:(1)有DDH影像学依据但临床症状不严重;(2)术前检查存在活动性感染;(3)近6个月内曾患急性心肌梗死、脑血管意外等不适合接受THA者;(4)合并肝、肾及造血系统严重原发性疾病;(5)患有精神疾病不能遵医嘱者。
回顾性分析2015年1月—2018年4月解放军东部战区总医院骨科收治的12例(12髋)脊髓灰质炎后遗症非瘫痪侧DDH患者的临床资料。其中男5例、女7例,年龄35~52岁,平均40.2岁;BMI为(27.8±2.6)kg/m2;CroweⅠ型6髋、CroweⅡ型5髋、Crowe Ⅲ型1髋。患者无化脓性髋关节炎、结核性髋关节炎、糖尿病等其他合并症。术前均常规行髋关节X线和CT检查。
手术由同一组术者完成。患者均采用全身麻醉,取侧卧位后外侧手术入路,切口长15~18 cm。沿大转子剥离臀肌附着组织,松解肌腱和筋膜,包括髂腰肌在小转子的附着点,必要时切除部分挛缩增生的关节囊。暴露股骨头,紧贴小转子上缘行低位股骨颈截骨。如股骨向下移位困难,可离断部分臀大肌在股骨臀肌粗隆的止点。沿增生延长的圆韧带寻找真臼,以髋臼横韧带作为标志确定真臼下缘,必要时借助C臂X线机透视下确认。仔细清除髋臼缘周边滑膜纤维组织,从小号髋臼锉开始,依次打磨髋臼,在打磨过程中磨锉保持前倾15°~20°、与水平面呈40°~45°。如臼底部骨量较多可适当加深,以便髋臼假体获得良好的骨质覆盖。髋臼磨锉完毕后,选择合适髋臼假体安放,使用2~3枚螺钉固定。根据术前影像资料测量的股骨髓腔直径,选择合适的假体试模扩髓;如果对股骨上端软组织进行充分松解后仍然不能复位关节,可逐步切除股骨距,并使用合适的假体试模进行复位尝试,直至满意。复位后假体术中活动范围为屈曲90°,后伸10°,内收20°,外展角度>15°;同时做屈髋屈膝内外旋试验,查看有无髋臼缘骨赘撞击导致脱位。假体安放术毕修复部分短外旋肌,加强缝合关节囊,常规留置负压引流管。
术后24 h常规使用1次抗生素;术后24~48 h拔除引流管。给予下肢血栓治疗仪治疗1周(30分钟/次,2次/天),指导患者进行股四头肌及腓肠肌等长锻炼;口服利伐沙班5周(10 mg/d),预防下肢深静脉血栓形成。术后第1天由主治医师指导患者下地,使用步行器步行,6周后可过渡至完全负重。当患者步行尚可、手术切口无渗出、影像学和检验无明显异常时即可出院。
观察手术时间、术后住院时间、出血量、手术并发症及手术疗效。手术时间以切皮开始至手术切口缝合完成计算;术后住院时间以手术当天至出院当天计算;出血量记录包括术中出血量和术后急性失血量;手术并发症包括术后3个月内出现的血肿形成、感觉缺失、坐骨神经损伤、切口感染、伤口裂开、髋关节不稳等,出现1项视为1例并发症。髋关节疗效评价采用Harris[4]评分,包括4项,总分100分,即疼痛44分、功能47分、畸形4分和运动范围5分,90~100分为优、80~89分为良、70~79分为可、60~69分为差。比较术前及术后末次随访时Harris评分及疼痛VAS。
应用SPSS 22.0统计学软件进行数据分析。服从近似正态分布的计量资料用 ±s表示,采用配对t检验;不服从正态分布的用M(P25, P75)表示,采用Wilcoxon符号秩检验。以P<0.05为差异有统计学意义。
±s表示,采用配对t检验;不服从正态分布的用M(P25, P75)表示,采用Wilcoxon符号秩检验。以P<0.05为差异有统计学意义。
12例患者均顺利完成手术,术中未出现严重并发症。
手术时间51~91(64.9±11.0)min,术中出血量203~347(282.7±44.4)mL,术后急性失血量353~485(414.2±51.6)mL。术后住院时间4~9 d,中位数为5.58(5,6)。本组1例患者属于Crowe Ⅲ型DDH患者,股骨头脱位程度较高,假体复位过程困难,因此术中又采取低位股骨颈截骨术,再次扩髓后复位,增加了手术时间,术后该患者留院观察时间较长,未出现各类并发症。
患者术后均获随访6~24个月,平均18个月。术后3个月时,所有患者髋关节疼痛均较术前改善,髋关节活动度良好。末次随访时患者基本能从事一般的工作生活。随访期间,患者下地行走良好,无假体脱位及假体松动发生。末次随访与术前比较,Harris髋关节评分显著增加、疼痛VAS显著降低,差异均有统计学意义(P值均<0.05)。髋关节疗效评价按照Harris评分评定:优10髋,良2髋。见表1。典型病例见图1、图2。

12例脊髓灰质炎后遗症患者非瘫痪侧手术前和术后末次随访Harris髋关节评分及VAS的比较
12例脊髓灰质炎后遗症患者非瘫痪侧手术前和术后末次随访Harris髋关节评分及VAS的比较
| 观察时间 | Harris评分(分, ±s) ±s) | VAS[分,M(P25, P75)] |
|---|---|---|
| 术前 | 62.8±7.52 | 4.00(3.00,6.00) |
| 末次随访 | 90.2±2.64 | 0.00(0.00,1.00) |
| 统计值 | t=11.913 | Z=10.864 |
| P值 | <0.01 | <0.01 |
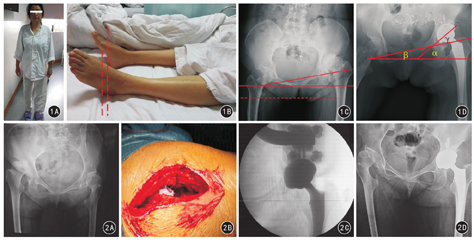

对于瘫痪侧的髋关节是否能够进行THA,国内外学者普遍持谨慎的态度[5]。有文献报道,脑卒中后遗症和脊髓灰质炎后遗症患者存在髋部无力和肌力失衡,THA术后假体脱位的发生率较高[6]。这类患者一旦出现术后脱位则处理十分棘手,多数需要再次翻修甚至更换限制性假体[7]。本组脊髓灰质炎患者置换的髋关节均为非瘫痪侧,肌力均大于3级,虽合并不同程度的髋臼发育不良,但通过THA术中重建髋臼正常的解剖中心,提高了外展肌力量,从而最大限度地恢复髋关节的正常生理功能,减少术后关节的不稳定性。
DDH患者临床表现多样,其股骨头常脱位于髋臼,股骨前倾角异常伴股骨近端髓腔畸形改变,晚期可继发髋关节炎[8]。脊髓灰质炎后遗症非瘫痪侧DDH患者也处于相对髋臼覆盖不足的状态,与先天性DDH十分相似,但其发病机制却不尽相同[9]。一方面,脊髓灰质炎患者髋关节外展肌在麻痹侧较弱、而非瘫痪侧的髋部屈肌和内收肌相对较强,这可能会引起非瘫痪侧股骨头半脱位并长期处于髋臼覆盖不良状态,间接导致髋关节骨性关节炎。另一方面,虽然脊髓灰质炎后遗症患者活动强度低于正常人群,但由于瘫痪侧肢体肌力不足且双下肢不等长,患者在站立及行走时,骨盆会向肌力较弱一侧倾斜,导致患侧肌力更差,倾斜更严重,逐渐引发健侧髋臼外展角相对增大、髋关节不稳定,出现明显髋关节发育不良[10]。由此可见,脊髓灰质炎后遗症非瘫痪侧DDH发病有其自身特点,此类手术的首要目的在于减少疼痛和恢复患肢的功能,而非普通DDH有望达到矫正双侧下肢不等长的目的[11]。此外,笔者在临床工作中发现,脊髓灰质炎后遗症非瘫痪侧DDH患者的股骨近端接近正常,很少出现股骨前倾角异常、股骨近端髓腔畸形改变,这可能也与其特殊的发病机制有关。
在DDH的THA手术操作中,患者髋关节解剖结构异常使得髋臼的重建变得极具有挑战性[12]。通常情况下,在THA中髋臼侧假体外展角应设定为40°±5°。然而,脊髓灰质炎后遗症患者骨盆发育畸形,行走时骨盆向瘫痪侧明显倾斜,因此非瘫痪侧安放髋臼假体时要充分考虑患者骨盆倾斜角度。如果术中采用常规外展角度放置髋臼,则患者在行走和站立时髋臼的实际外展角可能远远>40°,增加术后脱位的风险及假体远期松动的概率。本研究中,术中磨锉与水平面的角度为40°~45°,减去术前测量的患者平均骨盆冠状面倾斜角度15.8°±3.5°,即为术后髋臼外展角度。术前计划时将髋臼侧假体的外展角均设定为30°,术后测量髋臼实际外展角为30.5°±2.5°。虽然外展角度小于普通患者,但本组所有患者在术后均未出现撞击、异响、疼痛等现象。相对于外展角的减小,本组在处理髋臼前倾角的时仍常规选择前倾10°~15°,尽可能与原髋臼生理解剖匹配。末次随访时,本组病例Harris评分为(90.2±2.64)分,较术前(62.8±7.52)分有明显增高,优良率达100%。除了考虑髋臼的放置角度外,重度脱位DDH患者的髋臼重建位置的选择也是难点。目前,真臼内重建被大多数学者所认可,主要有以下几种方法:(1)加深内移髋臼旋转中心,应用小臼杯加大假体与骨床的接触面,必要时植骨加盖以提高髋臼覆盖率[13];(2)髋臼内壁截骨内陷法,通过真臼底的环形截骨并内移,增加髋臼包容性,同时尽可能多地保留骨量,维持髋臼结构的完整性[14];(3)采用旋转中心部分上移的方法,既保证了真臼范围内的重建,又降低了假体复位的难度及髋臼杯远期松动的风险[15]。当然,也有学者认为,如果真臼部位骨质条件欠佳,在确保髋臼旋转中心没有过度外移的前提下,也可选择在原假臼区域造臼[16]。但是,由于在假臼处重建人工髋关节的活动中心,生物力学的改变会使髋臼假体松动和脱位的概率增高,因此该术式不作为首选方法[17]。本组12例全部采用了真臼内重建髋臼的方案,必要时部分上移旋转中心,但最大上移不超过1.5 cm;术后随访期间,所有病例无假体脱位和松动,且术侧下肢疼痛VAS较术前明显降低,至末次随访时无需借助支具自由行走。
国内学者研究发现,脊髓灰质炎后遗症非瘫痪侧DDH患者术中安放髋臼假体时会出现髋臼杯外层与宿主骨接触面积过少的情况,建议采用骨长入效果更好的骨小梁金属(trabecular metal,TM)臼杯应对这一问题[18]。目前,临床上使用最多的TM为钽金属,原则上只需要有50%的假体覆盖率即可达到良好的骨长入效果,从而获得假体的长期稳定。然而,本组患者年龄普遍较轻,平均40.2岁,远期存在髋关节二次手术的可能。鉴于TM臼杯在翻修过程中对骨量破坏较大,本组采用的均为普通生物型臼杯。对于术中可能出现髋臼假体的骨质覆盖不足70%或者髋臼假体后方超过1 cm等情况,我们预备的方案是将取下的股骨头修整后在髋臼上缘植骨加盖,增加髋臼假体的稳定性。对于THA后外侧入路术后常见的关节脱位问题,有学者建议采用防脱位高边聚乙烯内衬的方法[19],也有学者提出选择更大号的股骨头可以降低脱位风险[20]。本研究中,在患者髋臼条件许可的前提下尽可能选择32 mm及以上直径的人工股骨头,因为较大直径的股骨头假体可有效减少假体间以及假体与髋臼骨质间的撞击,从而增加术后髋关节安全活动范围。此外,本组手术中均使用普通生物股骨柄,没有采用组配柄或股骨侧截骨的方法,术中失血量较少,平均282.7 mL。患者术后可以早期下床活动,术后住院时间4~9 d,降低了平均住院时间,手术疗效确切。
综上所述,THA治疗脊髓灰质炎后遗症非瘫痪侧DDH的手术较为复杂,应根据患者的具体情况系统评估,进行个体化设计,选择合适的假体安放位置及材料假体。本研究的不足:(1)本研究为回顾性研究,病例仅行常规骨盆正位及髋关节CT检查,没有行负重站立位双下肢全长X线片及CT三维重建检查以便清晰地展示患髋解剖结构的畸形;(2)部分病例术后骨盆X线平片由床边X线设备拍摄,摄片效果不一定能够很直观地反映出髋臼外翻角及前倾角;(3)此类病例发病较为罕见,所以纳入标准的病例数较少,且最长随访时间仅为24个月。今后将扩大样本量,延长随访时间,继续探讨THA治疗脊髓灰质炎后遗症非瘫痪侧DDH的中远期疗效。
所有作者均声明不存在利益冲突



























