
探讨玻璃体腔注射雷珠单抗治疗湿性年龄相关性黄斑变性(wAMD)的临床疗效,及其对患者血浆中微小RNA(miRNA)-126、血管内皮生长因子(VEGF)-A的表达水平的影响。
前瞻性研究。纳入2018年6月—2019年6月蚌埠医学院第一附属医院眼科收治40例(40只眼)wAMD患者为wAMD组,其中男17例、女23例,年龄50~86岁。纳入同期在蚌埠医学院第一附属医院体检中心进行健康体检的中老年人为对照组(40人),其中男18人、女22人,年龄53~81岁。wAMD组患者均接受单次玻璃体腔注射雷珠单抗0.05 mL治疗。采用实时荧光定量PCR(qPCR)法检测对照组和wAMD组治疗前及治疗后1个月血浆miRNA-126相对表达水平,酶联免疫吸附试验检测血浆中VEGF-A水平。(1)比较对照组、wAMD组治疗前miRNA-126及VEGF-A的表达水平。(2)比较wAMD组治疗前、治疗后1个月血浆miRNA-126、VEGF-A表达水平,以及最佳矫正视力(BCVA)、黄斑中央区视网膜厚度(CMT)、脉络膜新生血管(CNV)面积的变化情况。(3)分析wAMD组患者治疗前、治疗后1个月血浆miRNA-126的相对表达量与VEGF-A水平、CMT、CNV面积的相关性。
(1)wAMD组患者的miRNA-126相对表达量(0.86±0.11)低于对照组(1.04±0.10),VEGF-A水平(329.09±17.58)pg/mL高于对照组(295.74±14.80)pg/mL,差异均有统计学意义(t=8.010、9.179,P值均<0.01)。(2)wAMD组治疗后1个月miRNA-126相对表达量(1.47±0.27)较治疗前(0.86±0.11)增加,VEGF-A水平(315.36±15.44)pg/mL较治疗前(329.09±17.58)pg/mL降低,差异均有统计学意义(t=19.410、8.048,P值均<0.01);BCVA(0.45±0.11)较治疗前(0.83±0.16)增加,CMT与CNV面积分别为(296.53±21.52)μm,(0.58±0.18)mm2,较治疗前的(311.88±37.25)μm、(0.70±0.17)mm2均降低,差异均有统计学意义(t=12.667、3.602、4.906,P值均<0.01)。(3)wAMD组患者治疗前及治疗后1个月血浆miRNA-126相对表达水平与VEGF-A、CMT、CNV面积均呈显著负相关(r治疗前=-0.706、-0.723、-0.552,r治疗后1个月=-0.783、-0.709、-0.620, P值均<0.01)。治疗前拟合VEGF-A、CMT、CNV面积与miRNA-126相对表达量之间的线性回归方程分别为:ŶVEGF-A=-112XmiRNA-126+426, ŶCMT=-243XmiRNA-126+522, ŶCNV=-0.84XmiRNA-126+1.42;治疗后线性回归方程分别为:ŶVEGF-A=-45.64XmiRNA-126+382,ŶCMT=-57.53XmiRNA-126+381,ŶCNV=-0.41XmiRNA-126+1.18。
雷珠单抗可通过降低VEGF-A的表达,减少CMT及CNV面积,有效改善BCVA。雷珠单抗在取得临床疗效的同时,可能通过增强miRNA-126基因表达活性而延缓wAMD的进展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
年龄相关性黄斑变性(age-related macular degeneration,AMD)是黄斑区视网膜的慢性老年性疾病,主要包括视杆细胞感受器、视网膜色素上皮细胞、布鲁细胞膜和潜在的脉络膜毛细血管病变等[1,2]。AMD分为两种类型:干性(也叫萎缩型)和湿性(也叫新生血管型)。其中以脉络膜新生血管形成(choroidal neovascularization,CNV)为特征的湿性年龄相关性黄斑变性(wet age-related macular degeneration,wAMD)被认为是严重威胁视力的一类病变[3,4]。有研究发现,脉络膜病理性新生血管生成是wAMD的主要致病机制,并且通过微小RNA(microRNA,miRNA)-126直接靶向调控血管内皮生长因子(vascular endothelial growth factor,VEGF)-A mRNA的3'-非翻译区的序列抑制VEGF-A的表达来调节CNV的形成[5,6]。miRNA在人体血液中稳定表达,并可以用于检测多种疾病,如癌症和糖尿病视网膜病变[7]。近年来研究表明,应用抗VEGF药物通过影响相关miRNAs基因表达活性,可保护人视网膜色素上皮细胞(ARPE-19)免受氧化应激[8]。雷珠单抗作为抗VEGF药物广泛用于wAMD患者,但临床上关于雷珠单抗对wAMD患者血浆中miRNA-126表达活性的影响报道较少。本研究中,通过检测wAMD患者玻璃体腔单次注射雷珠单抗治疗前后血浆中miRNA-126与VEGF-A的表达及BCVA、CMT及CNN面积等临床指标的变化,探讨miRNA-126作为wAMD患者临床治疗的潜在靶点及预后判断指标的可能性。
前瞻性研究。选择2018年6月—2019年6月蚌埠医学院第一附属医院眼科收治wAMD患者作为wAMD组。病例纳入标准:(1)根据临床症状、光学相干断层扫描、眼底血管造影及光学相干断层扫描血管成像(optical coherence tomography angiography,OCTA )等检查确诊为wAMD患者;(2)年龄≥50岁;(3)自愿接受玻璃体腔注射抗VEGF药物治疗。病例排除标准:(1)近3个月诊断为活动性葡萄膜炎或眼部感染者;(2)存在除wAMD以外的任何视网膜病变的患者;(3)既往接受过抗VEGF药物、激光、光动力学疗法等wAMD相关治疗者;(4)合并高血压、糖尿病、癌症及心血管疾病等其它全身系统性疾病者。纳入符合条件的患者40人(40只眼),其中男17人、女23人,年龄50~86岁。患者均签署知情同意书。
选择2018年6月—2019年6月在蚌埠医学院第一附属医院体检中心进行健康体检的中老年人为对照组。纳入标准:(1)年龄≥50岁;(2)肝肾功能、血常规、血液生化常规等各项指标正常;(3)眼底检查无视网膜脉络膜病变;(4)无眼部疾病家族史及眼部感染者;排除标准:(1)新诊断为wAMD者;(2)存在屈光间质明显模糊影响OCTA检查者;(3)合并免疫性、代谢性相关疾病及其他全身基础疾病者。纳入符合条件体检者40人,其中男18人、女22人,年龄53~81岁。健康中老年人均告知研究相关情况并自愿参与。
本研究经蚌埠医学院第一附属医院伦理委员会批准(批文号2018KY06)。
RTVue XR OCTA系统(美国Optovue公司),LightCycler 96荧光定量PCR仪(瑞士Roche公司),Naro drop2000微量核酸定量仪(美国Thermo公司),DYY-11核酸电泳仪(北京六一仪器厂),iMark Microplate Reader酶标仪(美国BIO-RAD公司)。
血清游离RNA试剂盒购于北京康为世纪公司,定量PCR试剂盒购于北京全式金公司,人VEGF定量分析酶联免疫检测试剂盒和亲和素连接的HRP酶购于安徽巧伊生物科技有限公司,雷珠单抗注射液购于瑞士诺华制药公司,左氧氟沙星滴眼液、盐酸奥布卡因滴眼液购于日本参天有限公司,妥布霉素地塞米松滴眼液购于美国爱尔康有限公司。
wAMD组患者于确诊后次日及治疗后1个月清晨采集空腹肘静脉血5 mL,对照组受检者于体检当日采集空腹肘静脉5 mL。采集之血样于4 ℃条件下,离心半径15 mm、3 000 r/min离心15 min,提取分离血浆保存于-80 ℃冰箱中。
wAMD组患者术前连续3 d应用0.488%左氧氟沙星滴眼液点眼,每日4次。注射前用0.4%盐酸奥布卡因滴眼液表面麻醉。用30 G注射针头,在颞下方角膜缘外3.5~4.0 mm处垂直进针,向玻璃体腔缓慢注入雷珠单抗0.05 mL。注射完毕后无菌棉签按压注射口30 s避免返流。嘱患者术眼向下看,术者两示指尖轻触术眼波动感正常,包扎术眼。治疗后连续1周给予0.4%妥布霉素地塞米松眼液滴眼,3次/天,预防治疗后感染。
应用qPCR茎环法检测wAMD组和对照组miRNA-126的表达情况。
取200 μL血浆加入无RNA酶的1.5 mL离心管中,加入600 μL Trizol,震荡30 s充分混匀后,室温下放置5 min,使蛋白核酸复合物完全分离。加入200 μL氯仿,密封后剧烈震荡15 s,室温放置3 min。4 ℃、离心半径15 mm、12 000 r/min离心20 min,取上层无水相转移到无RNA酶的离心管中,加入等体积异丙醇颠倒混匀,室温放置30 min,4 ℃、离心半径15 mm、12 000 r/min离心20 min,弃上清。加入75%乙醇洗涤沉淀后室温晒干,加入50 μL无RNA酶的焦碳酸二乙酯水充分溶解保存于-80 ℃。分光光度计测RNA样品浓度及纯度。wAMD组和对照组血浆提取RNA后,按照反转录试剂盒说明合成cDNA。qPCR反应体系参照定量PCR试剂盒说明。反应条件为预变性94 ℃ 30 s、94 ℃ 5 s、61 ℃ 35 s,共40个循环。引物由合肥知恩生物公司设计并合成,引物序列见表1。

目的基因引物名称、序列和产物长度
目的基因引物名称、序列和产物长度
| 引物名称 | 引物序列 | 产物长度(bp) |
|---|---|---|
| miRNA-126 | 正向引物:5'-AGCAGCTCGTACCGTGAGTA-3' | 68 |
| 反向引物:5'-CAGTGCGTGTCGTGGAGT-3' | ||
| U6 | 正向引物:5'-CTCGCTTCGGCAGCACA-3' | 69 |
| 反向引物:5'-AACGCTTCACGAATTTGCGT-3' |
以U6做内参基因,在荧光定量PCR仪上进行扩增后读取荧光阈值(cyclethreshold,Ct)。按照2-ΔΔCt法计算wAMD组和对照组miRNA-126的相对表达量。
ΔCt= CtmiRNA-126-CtU6
ΔΔCt=ΔCtwAMD组或对照组-ΔCt对照组
按照人VEGF-A定量分析酶联免疫检测试剂盒说明,将wAMD组和对照组血浆与试剂盒中不同浓度标准品加入96孔板中封闭,37 ℃、5% CO2饱和湿度培养箱中孵育2 h。使用洗涤液冲洗、厚吸水纸吸干后,每孔加入人VEGF生物素抗体(1∶2 000)100 μL,37 ℃孵育1 h。再次使用洗涤液冲洗、厚吸水纸吸干。每孔加入亲和素连接的HRP酶(1∶2 000) 100 μL,避光37 ℃孵育20 min。按试剂盒说明每孔加入显色剂100 μL,避光37 ℃孵育20 min。每孔加入终止液50 μL,混匀后即刻使用酶标仪测定波长为450 nm时VEGF-A的光密度(optical density,OD)值。依据不同浓度标准品的OD值,计算wAMD组和对照组样本的VEGF-A水平。
应用国际标准视力表对患者进行BCVA检查,结果以最小分辨角对数(logarithm of minimum resolution angle, logMAR)视力表示。
应用OCTA技术检测黄斑中央区视网膜厚度(centre macular thickness, CMT)及脉络膜新生血管(choroidal neovascularization, CNV)面积。治疗前选择血流成像模式,嘱患者注视设备中自带蓝色视标,扫描范围为黄斑区3 mm×3 mm。扫描方式为水平及垂直方向线性扫描,定位病灶后手动调整分层界限以保留清晰度最高的图片,应用设备自带软件系统进行图像分析,自动计算输出CMT,以μm为单位;CNV面积则需先手绘需要测量的病变区域,然后系统会自动提取范围内的异常血流信号,并自动计算出其面积,以mm2为单位。治疗后1个月选择追踪定位模式扫描,扫描范围和扫描方式同治疗前。检测由经过正规培训的、从事眼底病诊断工作10年以上的2名副主任医师按照标准流程操作,检测结果取平均值。
比较对照组、wAMD组治疗前miRNA-126及VEGF-A的水平。比较wAMD组治疗前、治疗后1个月血浆miRNA-126、VEGF-A水平,以及BCVA、CMT、CNV面积的变化情况。分析wAMD组患者治疗前、治疗后1个月血浆miRNA-126、VEGF-A的水平以及CMT、CNV面积的相关性。
应用SPSS 22.0统计软件进行数据分析。服从正态分布的计量资料以 ±s表示,组间比较采用独立样本t检验,组内治疗前后观察指标的比较采用配对样本t检验。分类资料采用χ2检验。采用直线回归分析wAMD组患者治疗前后血浆miRNA-126相对表达量与VEGF-A水平、CMT、CNV面积的相关性。以P<0.05表示差异具有统计学意义。
±s表示,组间比较采用独立样本t检验,组内治疗前后观察指标的比较采用配对样本t检验。分类资料采用χ2检验。采用直线回归分析wAMD组患者治疗前后血浆miRNA-126相对表达量与VEGF-A水平、CMT、CNV面积的相关性。以P<0.05表示差异具有统计学意义。
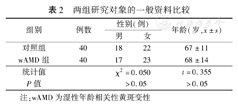
对照组与wAMD组性别、年龄比较,差异均无统计学意义(P值均>0.05)。见表2。
两组研究对象的一般资料比较
两组研究对象的一般资料比较
| 组别 | 例数 | 性别(例) | 年龄(岁, ±s) ±s) | |
|---|---|---|---|---|
| 男 | 女 | |||
| 对照组 | 40 | 18 | 22 | 67±11 |
| wAMD组 | 40 | 17 | 23 | 68±14 |
| 统计值 | χ2=0.050 | t=0.355 | ||
| P值 | >0.05 | >0.05 | ||
注:wAMD为湿性年龄相关性黄斑变性
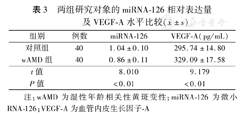
治疗前wAMD组miRNA-126相对表达量明显低于对照组,VEGF-A水平明显高于对照组,差异均有统计学意义(P值均<0.01)。见表3。
两组研究对象的miRNA-126相对表达量及VEGF-A水平比较( ±s)
±s)
两组研究对象的miRNA-126相对表达量及VEGF-A水平比较( ±s)
±s)
| 组别 | 例数 | miRNA-126 | VEGF-A(pg/mL) |
|---|---|---|---|
| 对照组 | 40 | 1.04±0.10 | 295.74±14.80 |
| wAMD组 | 40 | 0.86±0.11 | 329.09±17.58 |
| t值 | 8.010 | 9.179 | |
| P值 | <0.01 | <0.01 |
注:wAMD为湿性年龄相关性黄斑变性;miRNA-126为微小RNA-126;VEGF-A为血管内皮生长因子-A
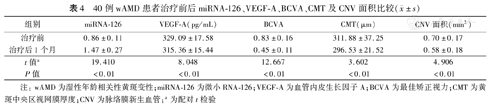
与治疗前比较,wAMD组治疗后miRNA-126相对表达量及BCVA明显增加,VEGF-A及CMT、CNV面积均明显降低,差异均有统计学意义(P值均<0.01)。见表4及图1。
40例wAMD患者治疗前后miRNA-126、VEGF-A、BCVA、CMT及CNV面积比较( ±s)
±s)
40例wAMD患者治疗前后miRNA-126、VEGF-A、BCVA、CMT及CNV面积比较( ±s)
±s)
| 组别 | miRNA-126 | VEGF-A(pg/mL) | BCVA | CMT(μm) | CNV面积(mm2) |
|---|---|---|---|---|---|
| 治疗前 | 0.86±0.11 | 329.09±17.58 | 0.83±0.16 | 311.88±37.25 | 0.70±0.17 |
| 治疗后1个月 | 1.47±0.27 | 315.36±15.44 | 0.45±0.11 | 296.53±21.52 | 0.58±0.18 |
| t值a | 19.410 | 8.048 | 12.667 | 3.602 | 4.906 |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
注:wAMD为湿性年龄相关性黄斑变性;miRNA-126为微小RNA-126;VEGF-A为血管内皮生长因子A;BCVA为最佳矫正视力;CMT为黄斑中央区视网膜厚度;CNV为脉络膜新生血管;a为配对t检验

wAMD患者治疗前及治疗后1个月血浆miRNA-126相对表达水平与VEGF-A、CMT、CNV均呈负相关(P值均<0.01),其中治疗前拟合VEGF-A、CMT、CNV与miRNA-126之间的线性回归方程分别为:ŶVEGF-A=-112XmiRNA-126+426(r=-0.706,95%CI -0.871~-0.476,P<0.01),ŶCMT=-243XmiRNA-126+522(r=-0.723,95%CI -0.882~-0.476,P<0.01),ŶCNV=-0.84XmiRNA-126+1.42(r=-0.552,95%CI -0.848~-0.549,P<0.01);治疗后线性回归方程分别为:ŶVEGF-A=-45.64XmiRNA-126+382(r=-0.783,95%CI -0.888~-0.637,P<0.01),ŶCMT=-57.53XmiRNA-126+381(r=-0.709,95%CI -0.877~-0.469,P<0.01),ŶCNV=-0.41XmiRNA-126+1.18(r=-0.620,95%CI -0.771~-0.422,P<0.01)。结果提示,wAMD患者血浆中miRNA-126表达水平增加会引起VEGF-A、CMT、CNV的减少。见图2、3。
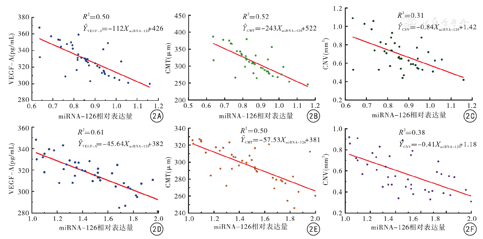

注:miRNA-126为微小RNA-126;VEGF-A为血管内皮生长因子A;CMT为黄斑中央区视网膜厚度;CNV为脉络膜新生血管
VEGF-A为VEGF家族中研究最多的成员之一,有研究显示,在小鼠中,VEGF-A水平升高可导致视网膜色素上皮细胞的早期退行性变化,此病理改变是wAMD的主要病理变化[9]。雷珠单抗作为第二代重组人VEGF单克隆抗体,是抗VEGF药物之一,具有分子量较小并可高效的穿透视网膜的优势[10],能够特异性结合多种活性形式的VEGF-A[11]。在本研究中,应用雷珠单抗治疗wAMD患者,检测治疗前后患者血浆中VEGF-A表达水平;同时利用OCTA技术观察CMT、CNV特征,评估wAMD患者临床治疗后的疗效。OCTA技术能够提供不同层面生理或病理血管的大小、结构、位置的高分辨率三维图像,是一种无创、快速获得视网膜和脉络膜血管图像的新方法,可为wAMD患者的治疗与随访提供指导[12,13]。本研究结果显示,雷珠单抗可通过降低VEGF-A的表达,减少CMT及CNV面积,有效改善BCVA,提示雷珠单抗能够有效阻止血管渗漏和抑制新生血管的形成,减轻黄斑水肿,改善和维持现有视力,临床疗效明显。这与Koike等[10]研究结果一致。
miRNA是一种长度为20~24核苷酸的非编码小分子RNA,它们通过诱导翻译抑制或使目标mRNA裂解,在基因表达的生理和病理过程中发挥至关重要的作用[14,15]。最近研究显示,miRNA-126编码在表皮生长因子样结构域7内含子中,是一种具有内皮细胞特异性表达功能的miRNA,已被证实参与病理性新生血管的形成[16]。研究显示,miRNA-126通常通过抑制VEGF信号的表达,来抑制新生血管的形成,在糖尿病视网膜病变或早产儿视网膜病变等眼部新生血管疾病中,miRNA-126表达水平下降[17]。本研究结果显示,wAMD患者血浆中miRNA-126的表达显著降低,而VEGF-A表达水平显著增高。与既往研究结果一致,说明miRNA-126和VEGF-A可参与wAMD患者新生血管的生成。Desjarlais等[18,19]研究发现,在氧诱导的视网膜病变小鼠的视网膜中miRNA-126水平显著下降,通过在小鼠玻璃体内注射pCMV-miRNA-126与脂质体混合物,可以上调miRNA-126的水平,下调p38和细胞外调节蛋白激酶的活化,并抑制VEGF、胰岛素样生长因子2蛋白的表达,从而起到抑制新生血管形成的作用。Wang等[20]进一步研究发现,miRNA-126在激光诱导的CNV小鼠眼中的表达下降,而提高miRNA-126的表达,可以抑制CNV小鼠模型中VEGF-A、激酶插入结构域受体和出芽相关蛋白-1的表达,进而抑制CNV形成;该研究揭示了miRNA-126的正常表达在CNV形成过程中起关键作用,表明其可能是用于治疗wAMD的靶向替代物。然而,这仅在动物实验中初步证实了miRNA-126是脉络膜新生血管形成的抑制靶点,并没有在临床试验中进一步深入研究。本研究结果显示,wAMD患者应用雷珠单抗治疗后miRNA-126的表达水平较治疗前明显增高;同时,本研究通过miRNA-126与VEGF-A、CMT及CNV的相关性分析表明,miRNA-126可能通过负性调控VEGF-A的表达变化参与wAMD病程的进展。
综上所述,雷珠单抗可通过降低VEGF-A的表达,减少CMT及CNV面积,有效改善BCVA;雷珠单抗可能通过增强miRNA-126基因表达活性而减缓wAMD的发生发展。本研究的局限性在于:(1)样本量少,最终数据可能存在偏倚。(2)本研究仅采用直线回归分析的方法初步探讨其可能的机制,后续需大样本对通路机制进行深入研究,进一步验证本研究结论。(3)本研究缺乏长期随访数据,尚未确定miRNA-126表达水平对wAMD远期预后的影响,我们将进一步加强后期的随访研究,为wAMD疾病的靶向诊治提供新方案。
所有作者均声明不存在利益冲突































