
探讨髂静脉狭窄动物模型的建立方法。
选用实验用白猪12只,采用数字表法随机分为实验组及对照组,每组6只。实验组采用左髂静脉血管外贴附包绕石英管,在左髂静脉于下腔静脉汇入点下方1~2 cm及3~5 cm处结扎髂静脉,然后抽离石英管的方法,建立左髂静脉狭窄动物模型;对照组不行手术。实验组白猪在手术前及术后第30天行血管腔内超声(IVUS)检测左髂静脉汇入下腔静脉处左髂静脉内径,在术后第30天行髂静脉造影检查观察髂静脉通畅情况。在完成检查后处死两组实验动物,取出右髂静脉近心端2.0 cm、左髂静脉起始端至下腔静脉下段"人"字型血管,观察静脉壁病理组织学改变;应用Image-Pro plus图像处理软件测量实验组左髂静脉缩窄处、对照组相应处血管内膜厚度。实验组以左髂静脉直径狭窄率>30%作为模型制备成功的标准。观察并比较实验组手术前后左髂静脉内径的差异,以及两组动物左髂静脉内膜厚度的差异和组织病理学的改变。
实验组动物手术前左髂静脉直径为7.28~8.04(7.53±0.28)mm,术后第30天为3.72~5.02(4.39±0.48)mm,手术前后左髂静脉直径差值为2.32~3.88(3.14±0.57)mm,左髂静脉狭窄率为31.6%~51.1%(41.57%±6.85%),均成功建立了髂静脉狭窄模型;手术前后左髂静脉直径差异有统计学意义(t=13.575,P<0.05)。术后第30天,实验组动物髂静脉造影显示右髂静脉均通畅,左髂静脉可见明显狭窄;静脉壁组织病理学检查显示:对照组未见异常,实验组血管内膜增生狭窄;实验组左髂静脉内膜厚度为(209.82±26.26)μm,大于对照组的(37.67±6.84)μm,差异有统计学意义(t=15.539,P<0.05)。
在实验白猪体内,采用左髂静脉血管外贴附包绕石英管、在左髂静脉于下腔静脉汇入点下方1~2 cm及3~5 cm处结扎髂静脉后抽离石英管的方法,可成功建立髂静脉狭窄动物模型。该方法具有简便、建模效果稳定的优点。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着静脉支架植入技术的发展,髂静脉压迫综合征(iliac vein compression syndrome, IVCS)导致下肢慢性静脉功能不全(chronic venous insufficiency, CVI)的治疗在临床上得到了越来越多的重视。髂静脉支架植入具有较高的长期通畅率、较好的临床效果等优点,使临床表现-病因-解剖-病理生理学(clinical-etiology-anatomy-pathophysiology, CEAP)分级为3~6级的慢性静脉疾病(chronic venous disease,CVD)患者广泛获益[1,2]。有学者指出,动物实验如果没有构建髂静脉压迫的病理环境,就不能创造完整的IVCS病理状态,可能导致实验数据产生偏移[3]。因此,本研究设计了一种模拟人髂静脉狭窄的猪模型,以期为髂静脉狭窄及支架的动物实验研究提供简便、稳定、可靠的建模方法。
选用健康1~2月龄实验用白猪12只,雌雄不限,体质量45~65 kg,由上海甲干生物科技有限公司提供,动物生产许可证:SCXK(沪)2015-0005。采用数字表法将12只实验白猪随机分为实验组及对照组,每组各6只。
实验组行手术建立髂静脉狭窄模型;对照组不行手术,作为正常对照。实验组在手术前行血管腔内超声(intravenous ultrasound,IVUS)(VINNO G50,荷兰,Philips)检测,确定左髂静脉汇入下腔静脉处,测量该处左髂静脉血管前后壁间距为左髂静脉内径。
实验组白猪手术前禁食4 h,禁饮2 h。采用静吸复合麻醉。实验白猪取仰卧位,固定于手术床。常规备皮、手术区消毒及铺无菌手术单;在下腹部第一至第三乳头之间取纵行正中切口10 cm,逐层进腹,显露游离腹主动脉、下腔静脉下段及左髂动静脉(图1A)。用4号慕丝线在左髂静脉汇入下腔静脉处贴血管壁绕一周,血管钳夹持作标记后退出;以游标卡尺(精确度0.02 mm)测量慕丝线标记长度,重复测量3次,结果取平均值,即左髂静脉周长。根据左髂静脉周长计算出左髂静脉直径以及髂静脉狭窄率50%时的静脉直径。依据髂静脉狭窄率50%时静脉直径选择相同直径的长度为4 cm的无菌石英管,从左髂静脉汇入下腔静脉处贴附于左髂静脉血管壁外侧,将血管压扁完全包裹石英管,分别距离左髂静脉汇入下腔静脉处1~2 cm及3~5 cm处,用4-0可吸收线双重缠绕石英管并收紧、结扎后(图1B),抽离石英管(图1C)。血管重新充盈后,可吸收线压迫左髂静脉,造成血管狭窄。检查手术创面无明显渗血,逐层关腹。
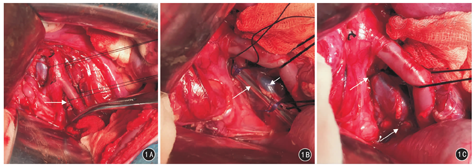

手术后实验组动物经耳缘静脉推注肝素(100 U/kg),肌内注射青霉素钠(480万单位),每天1次,共3 d。术后4 h动物可常规饮食,术后第1、3、5天伤口换药,术后第7天伤口拆线。常规观察动物术后体温、精神活动状态、饮食睡眠活动以及有无创面感染、皮下血肿、胃肠道出血、肢体肿胀等情况,并及时对症处理。
实验组白猪在手术后第30天行IVUS检测,再次测量左髂静脉汇入下腔静脉处左髂静脉内径。依据测量结果评估髂静脉狭窄模型制备结果:与手术前IVUS检测结果比较,左髂静脉狭窄率>30%,提示模型制备成功。
实验组在术后第30天行髂静脉造影检查,观察髂静脉通畅情况。采用静吸复合麻醉。实验组猪仰卧于Innova 3100 DSA血管造影平台(美国GE),四肢固定。在M5彩色多普勒超声(中国迈瑞)引导下行双侧股静脉穿刺,并置入5 F血管穿刺鞘(日本Terumo),连接Angiomat 600高压注射器(美国LLC),行双侧髂静脉血管造影检查。每侧股静脉均注入碘海醇注射液造影剂10 mL,注射速度为4 mL/s。
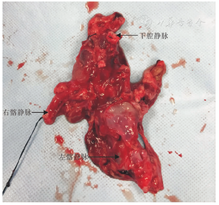
在完成造影检查后静脉推注10%氯化钾处死实验组、对照组白猪,取出右髂静脉近心端2.0 cm、左髂静脉起始端至下腔静脉下段"人"字型血管(图2),用肝素水(12 500 U低分子肝素与500 mL生理盐水配制)轻柔冲洗血管腔道后,10%甲醛固定标本,梯度浓度酒精脱水、浸蜡、包埋切片后,采用HE染色,观察静脉壁病理组织学改变。应用美国Image-Pro plus(Media Cybernetics, Inc.)图像处理软件测量实验组左髂静脉缩窄最明显处、对照组对应部位血管内膜厚度,重复测量3次,结果取平均值。

观察并比较实验组手术前后左髂静脉内径IVUS测量值的差异,以及实验组、对照组术后左髂静脉内膜厚度的差异和组织病理学的改变。
应用SPSS 22.0统计软件进行数据处理和统计分析。服从或近似服从正态分布的计量资料以 ±s表示,组间比较采用独立样本t检验,组内比较采用配对t检验。以P<0.05为差异有统计学意义。
±s表示,组间比较采用独立样本t检验,组内比较采用配对t检验。以P<0.05为差异有统计学意义。
实验组与对照组白猪无一例死亡。实验组白猪无胃肠道出血、肢体肿胀、皮下血肿及创面感染等并发症发生。
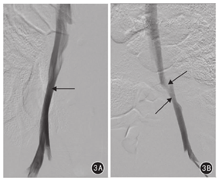
术后第30天实验组行髂静脉造影检查显示:右髂静脉通畅,左髂静脉可见明显狭窄(图3)。

实验组IVUS检测显示:术前左髂静脉内径为7.28~8.04(7.53±0.28)mm,术后第30天为3.72~5.02(4.39±0.48)mm,手术前后左髂静脉内径差值为2.32~3.88(3.14±0.57)mm,左髂静脉内径狭窄率为31.6%~51.1%(41.57%±6.85%),提示均成功建立了髂静脉狭窄模型。手术前后左髂静脉内径差异有统计学意义(t=13.575,P<0.05)。
标本大体观察:对照组动物左髂静脉与周围组织无粘连,富有弹性,血管壁无水肿、增生,内膜表面光滑、平整。实验组左髂静脉与周围组织粘连,质地较脆,手术线基本吸收,缩窄处血管壁水肿、增生,内膜表面光滑、平整。
HE染色:对照组左髂静脉血管壁薄,外膜未见明显增生、水肿,内外膜分界基本清晰,内膜完整,管腔内皮细胞排列整齐,呈单层柱状排列,细胞核染色深,未见明显炎症细胞浸润(图4A)。实验组髂静脉血管壁水肿、增生明显,染色变淡,内外膜分界尚清,管腔内膜表面内皮细胞排列欠整齐,仍为单层,细胞核增大,染色稍淡,内皮细胞下方可见血管平滑肌细胞增殖,其中可见少量淋巴细胞及吞噬细胞;外膜增厚水肿明显,纤维组织增生(图4B)。
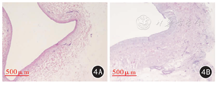

实验组左髂静脉最缩窄处内膜厚度为176.46~250.64(209.82±26.26)μm,明显大于对照组相应部位左髂静脉内膜厚度30.46~46.92(37.67±6.84)μm,差异有统计学意义(t=15.539,P<0.05)。结果提示实验组术后髂静脉内膜增生明显。
髂静脉狭窄解剖上是由于受到髂静脉前面的右髂总动脉及后面的腰椎覆盖及压迫,可导致下肢静脉曲张、肿胀等静脉功能不全表现,甚至深静脉血栓形成[4]。在大多情况下,狭窄闭塞或血栓堵塞后的静脉再通或纠正髂静脉狭窄病变能够使CVD患者症状消失或明显缓解[5,6]。由于静脉外科手术创伤大且远期通畅率低,血管腔内重建,尤其支架植入,已成为髂静脉重建的首要选择[7]。故建立适合的髂静脉狭窄动物模型对于更好地研究髂静脉狭窄疾病及研制新型支架显得尤为重要。
鉴于医学伦理学限制以及犬、猪等解剖生理结构与人类相似的实验基础,建立动物模型成为了探索人类疾病的重要过渡研究。研究显示,CVD发病率随着年龄的增长而增加,平均发病年龄为53.4岁,女性发病率更是高达67.5%[8]。但目前国内外对于静脉疾病动物模型的研究较少,而髂静脉狭窄动物模型的建立研究极少。鲁景元等[9]以小型猪为研究对象,通过使用直径为髂静脉直径1.3倍的球囊直接扩张髂静脉,造成髂静脉损伤从而引发损伤修复,最终导致髂静脉狭窄的方式建立髂静脉狭窄动物模型。笔者认为,这种模型虽然确实实现了髂静脉狭窄,但是与人类因压迫造成髂静脉狭窄的状况不相符。盛华均等[10]以大鼠为研究对象,采用同时捆扎髂动、静脉的方法,模拟人体髂静脉狭窄的生理状态;虽然实验效果较好,但造成了髂动脉狭窄的状况,无疑难以模拟人体单纯髂静脉狭窄的病理状态。笔者在前人研究的基础上,在本研究中以白猪为研究对象,并对制造髂静脉狭窄模型的方式进行了改进,采用血管外贴附包绕石英管,捆扎髂静脉后抽离石英管的方法,成功建立了髂静脉狭窄模型,具有一定的创新性,同时实验结果表明了此方法的有效性。
《中国深静脉血栓形成诊疗指南(第三版)》[11]推荐,当髂静脉狭窄超过50%时,需要球囊扩张或支架植入处理。欧洲心血管和介入放射协会将髂静脉支架植入的实践指导标准适当放宽,推荐当狭窄率超过30%、有侧枝血管即可进行临床干预[12]。本研究结果显示,实验组白猪均成功建立髂静脉狭窄模型,髂静脉狭窄率为41.57%±6.85%,基本符合临床髂静脉狭窄介入治疗的标准,可以为临床髂静脉狭窄的相关研究,提供可靠的动物实验基础。
本研究中实验建模稳定、可靠,笔者总结建立髂静脉狭窄动物模型的优势如下。(1)实验动物:在本次建模中,IVUS测量实验白猪的髂静脉内径为(7.53±0.28)mm,与人体髂静脉直径接近[13]。根据手术中观察及造影检查情况显示,实验白猪的血管解剖特点与人体相似。此外,猪主动脉末端明显膨大,延伸为包括双侧髂总动脉在内的4~6根分支动脉,部分个体腹主动脉末端整体骑跨在左髂静脉上,部分个体右髂动脉及至少一个分支动脉骑跨,自然状态下左髂静脉就明显受压。以上结果提示,以白猪为研究对象,建立的髂静脉狭窄动物模型,从病因学角度,更接近人体髂静脉狭窄的状态,可作为建立髂静脉狭窄模型的实验动物。(2)手术入路:采取腹膜外入路减少了对实验白猪的损伤,减少了腹腔内感染及腹内脏器粘连的机率,操作时尽量减少了对血管及周围组织的损伤及刺激,最大限度地保持局部结构的完整性。(3)手术部位:手术建模时在距离左髂静脉汇入下腔静脉处远端1~2 cm及3~5 cm处结扎静脉,保证了狭窄的有效性。(4)手术材料:手术所用缩窄线为可吸收线,可在短期内完全吸收,副反应小。病理检查结果显示,实验组血管外周虽然有明显血管壁水肿,间质组织增生,炎症细胞浸润,但内膜完整;而且造影检查并未出现靶血管闭塞、血栓及狭窄处血管严重变形,所有这些都提示模型更加接近疾病的自然病理状态。因此,该方法建立的髂静脉狭窄动物模型可为髂静脉狭窄的发病机制、生理病理研究及新型髂静脉支架的动物研究提供可靠的实验基础。
本研究中建立髂静脉狭窄模型的方式也存在不足之处:髂静脉狭窄实际上是动脉搏动与椎体前后慢性压迫导致的损伤,而本研究中的造模方法是急性、相对锐性损伤,难以准确模仿髂静脉慢性受压过程,腔内无法形成纤维带或隔膜;此外,我们未能评估实验组与对照组术前内膜厚度基线资料是否存在潜在差异。在下一步工作中,我们将进一步完善实验方法,使得模型能够更贴近髂静脉狭窄血流动力学变化以及进一步增强数据的说服力。
所有作者均声明不存在利益冲突



























