
探讨经剑突下入路胸腔镜胸腺切除的解剖基础与临床效果分析。
回顾性分析2018年6月—2019年12月蚌埠医学院第一附属医院胸外科收治的33例经剑突下入路胸腔镜胸腺切除患者的临床资料。其中,男15例、女18例,年龄(53.94±13.37)岁。患者术前均诊断为胸腺肿物。术后病理诊断:胸腺瘤12例、胸腺癌1例、畸胎瘤3例、胸腺增生1例、胸腺囊肿16例。观察手术路径的安全性及术野显露情况;记录术后引流量及引流管放置时间、术后住院时间,术后24 h进行疼痛视觉模拟评分(VAS),观察术后并发症发生情况。
本组患者均顺利完成胸腔镜胸腺完整切除术,无中转开放手术。其中合并有肺楔形切除2例,合并心包部分切除2例。剑突下入路手术路径安全,暴露良好,术中胸腺周围的解剖结构显示清晰,能完整显示左右两侧心包膈神经、上腔静脉、前方胸骨、后方心包及左侧无名静脉、上方甲状腺下极等胸腺毗邻结构。术后引流量(429.24±308.34)mL;引流时间(3.61±1.56)d;住院时间(5.88±3.43)d;术后24 h疼痛VAS评分为(1.82±0.68)分。围术期无死亡病例,1例重症肌无力患者术后症状加重,经机械通气、药物等治疗后痊愈;1例患者术后出现低钠血症,补钠后痊愈。
经剑突下入路胸腔镜胸腺切除的解剖路径暴露良好,具有较好的手术安全性和临床效果,更好地体现了微创理念。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胸腺肿物是来源于胸腺区的病变,包括胸腺瘤、胸腺癌、胸腺畸胎瘤、胸腺脂肪瘤、胸腺囊肿等,其治疗方式以全胸腺扩大切除为主。胸骨正中劈开为胸腺开放切除的经典路径,具有安全和切除彻底的优点,缺点是创伤大、切口不美观等。20世纪90年代以来,随着胸腔镜设备、器械及技术的快速发展,左胸路径或者右胸路径的胸腔镜胸腺切除术逐步成熟并广泛应用,手术方式包括经右侧或左侧胸腔、右侧胸腔+左侧胸腔、右侧胸腔+颈部、左侧胸腔+颈部等[1,2,3,4],与胸骨正中劈开路径相比,具有镜下视野好、创伤小、恢复快、切口美观等优点[5,6]。但左、右胸路径的胸腔镜胸腺切除术有各自的优劣势:如经左胸的手术能够清晰显露左侧心包膈神经及胸腺左下极,但很难显示对侧心包膈神经及胸腺右下极,尤其对于肥胖和矮小患者手术野的显露更为困难;经右胸的手术可以较好地显露右侧心包膈神经、右侧胸腺下极、左无名静脉等结构,但较难显示对侧心包膈神经、左上和下极[7]。综合两种路径的优缺点,我们采用经剑突下入路胸腔镜手术治疗了33例胸腺肿物患者,取得较好的效果,目前国内仅少数医院开展此项技术。本文通过探讨该入路的解剖基础和临床效果,为经剑突下入路胸腔镜胸腺切除术的临床应用提供理论依据。
纳入标准:(1)术前诊断为胸腺肿物;(2)胸部CT平扫+增强扫描影像资料完整,经影像学评估无明显外侵或仅心包、肺部局部较轻侵犯;(3)术前心电图、肺功能等常规检查无明显手术禁忌证。排除标准:(1)术前影像学检查显示,肿物与左无名静脉、上腔静脉等大血管及重要脏器界限不清,胸腔镜手术难以切除或风险大者;(2)术前明确诊断为恶性肿瘤并已接受放疗,或肿瘤术后复发者;(3)病情不稳定的重症肌无力患者。
回顾性研究。纳入2018年6月—2019年12月蚌埠医学院第一附属医院胸外科33例经剑突下入路胸腔镜胸腺切除患者的临床资料,其中男15例、女18例,年龄(53.94±13.37)岁;患者术前均诊断为胸腺肿物。术后病理诊断:胸腺瘤12例、胸腺癌1例、畸胎瘤3例、胸腺增生1例、胸腺囊肿16例。无明显临床症状10例(体检发现),胸闷、胸痛16例,眼睑下垂5例,吞咽困难1例,咳嗽1例。具有重症肌无力症状者围术期应用溴吡斯的明治疗。1例胸腺瘤患者新辅助化疗后血小板减少,术前予以调整。本研究获蚌埠医学院第一附属医院伦理委员会批准(批准文号:2017155),患者术前均签署知情同意书。
采用静吸复合麻醉,单腔插管。患者取头低脚高、仰卧剪刀形体位,双腿分开约60°。主刀站于患者两下肢间,助手站于患者右侧。于剑突下做长约1 cm纵形切口作为观察孔,放置胸腔镜。左、右锁骨中线与肋缘交界处各做一约0.5 cm切口作为操作孔,分别放置左、右侧Trocar,左侧Trocar放置抓钳,右侧Trocar放置超声刀。经剑突下Trocar充入CO2,压力为8 cmH2O。术中密切观察呼气末CO2分压。用超声刀扩大分离胸骨后组织至左、右侧胸膜处,分别予以切开,紧贴胸骨后向上切开纵隔胸膜至双侧胸廓内静脉。沿心包表面及双侧膈神经自下而上切除胸腺及脂肪组织,右上方游离至右侧胸廓内静脉汇入右无名静脉或上腔静脉处,左上方游离至左侧胸廓内静脉汇入左无名静脉处;仔细分离左无名静脉与上腔静脉的交界处,沿右侧胸廓内静脉内侧继续向上分离右侧胸腺上极,抓钳调整牵拉胸腺上极方向,完整切除左右两侧胸腺上极,同时注意避免超声刀工作面对气管的热损伤。向下牵拉胸腺,小心分离胸腺静脉回流左无名静脉处,胸腺静脉近心端用血管夹处理,远心端超声刀离断,裸化左无名静脉。根据有无肺部或者心包侵犯,进行扩大肺楔形切除或心包部分切除(图1)。将完整切除的标本放置于右侧胸顶位置,标本袋经剑突下Trocar下方放入至右侧胸顶附近,标本装袋取出。如标本过大,可根据需要扩大剑突下切口。术毕,切口及纵膈内彻底止血,放置引流管,排除残留CO2,关闭切口。
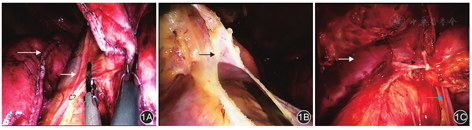

术后常规补液,根据具体情况选择治疗方案。对围术期重症肌无力患者,继续口服溴吡斯的明,并根据肌无力控制及恢复情况,调整药物用量。术后引流液颜色较淡,24 h总量100 mL左右拔除引流管,观察无异常后出院。
记录并分析此手术中的解剖结构显露情况及显露范围路径;记录术后引流量及引流时间、术后住院时间、术后24 h进行疼痛VAS评分,观察术后并发症发生情况。术后1个月复查胸部CT或胸部正位X线片、血常规及生化常规等检查,观察有无胸腔积液、肺不张、感染、贫血及肝肾功能异常等情况。
采用SPSS 23.0统计软件进行数据处理,服从正态分布的计量资料以 ±s表示。
±s表示。
所有患者手术顺利,无中转开放手术,术中无重要脏器损伤等情况。胸腺完整切除率100%。手术中胸腺周围的解剖结构暴露良好,能完整地显示胸腺的毗邻结构,清晰显露左、右两侧心包膈神经及上腔静脉、前方胸骨、后方心包及左侧无名静脉、上方甲状腺下极。其中合并肺楔形切除、合并心包部分切除各2例。
本组患者术后引流量为10~1 370(429.24±308.34)mL,术后引流管放置时间(3.61±1.56)d,术后住院时间(5.88±3.43)d,术后24 h疼痛VAS评分为(1.82±0.68)分。
围术期无死亡病例。1例术前合并重症肌无力患者术后症状加重,采用机械通气、溴吡斯的明、免疫球蛋白等药物治疗后痊愈;1例患者术后出现低钠血症,补钠后痊愈。所有患者伤口愈合良好,均未发生脂肪液化或感染、肺部感染、呼吸衰竭等并发症。术后1个月复查均未见胸腔积液、肺不张、感染、贫血及肝肾功能异常等情况,重症肌无力患者均控制满意。
开展经剑突下入路胸腔镜胸腺切除术,需要临床解剖学基础的支持[8,9,10,11]。胸腺形似蝴蝶,大多上尖下宽,左、右两叶不对称,表面被覆包膜;位于胸骨后前上纵隔,其后方与心包、升主动脉及其分支、左无名静脉、气管等毗邻;上缘从第一肋间延伸至甲状腺下缘,上极由甲状腺韧带与甲状腺相连,下极最低达膈肌,两侧达左、右心包膈神经。胸腺的特定临床解剖范围,在剑突下入路胸腔镜的视野及操作范围内均可以到达。胸腺本身具有包膜,组织间隙在CO2充气状态下更加疏松,无论钝性或锐性分离操作均比较简单,且渗血较少。由于胸腺动脉发自甲状腺下动脉和胸廓内动脉,较为细小,因此,在游离胸腺过程中不必刻意分离动脉,可使用超声刀安全离断。胸腺静脉的变异较大,以单支常见,可汇入左无名静脉、甲状腺下静脉或上腔静脉,其中单支汇入左无名静脉多见,大多走行于胸腺后方;由于胸腺静脉壁薄且稍粗,在手术中,直接使用超声刀离断出血风险较大,因此,我们在胸腺静脉近心端用血管夹处理,远心端超声刀离断,可保证安全。
手术适应证:(1)早期开展此项术式,尽量选择直径较小的胸腺瘤、良性前纵隔肿物或部分侵犯较轻的胸腺癌等[12];随着手术技能的提高,在保证手术安全和切除彻底的前提下,可以适当增加较复杂的病例,如合并心包部分切除、左无名静脉切除等[13,14,15]。(2)对于部分复发、转移以及肿瘤外侵严重但辅助化疗后获得可手术机会的病例,也可能获得彻底切除[16]。本组1例新辅助化疗后患者胸腺完整切除。手术禁忌证:(1)胸腺恶性肿瘤,且心脏、大血管等严重侵犯;(2)巨大肿瘤;(3)心肺功能及其他脏器功能较差等不能耐受手术的患者。
本组患者均完整切除胸腺,且术中顺利,无脏器及血管的损伤,患者术后引流时间及住院时间较短,与文献报道的一致[17,18]。本组患者术后并发症的发生率为6%(2/33),其中1例重症肌无力患者术后症状加重,考虑与手术创伤、麻醉等综合因素有关,经治疗后稳定;1例低钠血症考虑与术后进食较少引起。黄鑫等[19]报道了38例经剑突下入路治疗前纵隔肿瘤,术后出现重症肌无力1例,经呼吸机治疗1周后好转,其余无明显并发症发生;本组患者术后并发症发生率与该报道类似,发生率较低且可控。文献报道,术前合并重症肌无力、围术期焦虑、手术时间长、肺部感染等均可以诱发术后重症肌无力的发生,临床中难以完全避免,与手术入路关系较小[20,21]。
剑突下入路的主要优点:(1)安全可靠。该入路可以充分暴露胸腺的周围脏器和血管等,避免视野不清造成的误伤;同时,由于手术区域及患者体位与传统正中胸骨劈开手术相似,如术中出现大出血或切除困难时,可随时中转胸正中切口开放手术。(2)临床效果可靠。剑突下入路较容易达到胸腺的上下左右边界区域,不仅可以完整切除胸腺,还能有效地裸化血管、神经边缘及切除脂肪。(3)微创及美观。切口位于剑突下及两侧肋缘,且长度短,美容效果好。全程微创,保持了胸廓的稳定性,减少出血及切口愈合不良,术后并发症的发生率低,也避免了经侧胸手术后的肋间神经疼痛。(4)经济。术中使用高值耗材少(仅使用超声刀),住院时间短,住院花费相对较低。
主要缺点及应对措施:(1)术中使用吸引器时会造成术腔CO2压力降低或消失,在渗血较多时,单纯使用纱条压迫效果欠佳,对术野造成一定影响。因此,手术过程中尽量减少或者避免出血,可改善手术的视野。(2)手术空间密闭,超声刀使用过程中产生的烟雾较多影响操作,可适当排气处理,保持画面清晰。(3)由于操作空间相对狭小,需要随时调整器械与镜头的位置,避免相互碰撞。(4)对于瘦长体型的患者,两侧肋弓的夹角较小,腔镜孔及操作孔位置过于靠近,影响操作,此时不能完全按照解剖标记选择切口,应根据需要微调。
综上所述,经剑突下入路胸腔镜胸腺切除术的解剖路径暴露良好,具有较好的手术安全性和临床效果,更好地体现了微创理念,但其远期疗效尚需进一步随访观察。本研究纳入例数偏少,复杂手术开展不多,有待进一步扩大样本量后总结更多经验。
所有作者均声明不存在利益冲突



























