
探讨纳米碳示踪技术在腹腔镜结直肠癌根治术中的临床应用价值。
回顾性队列研究。纳入2016年1月—2018年12月南京医科大学第一附属医院结直肠外科接受腹腔镜结直肠癌根治术的1 343例患者的临床资料,其中男870例、女473例,年龄17~89岁、中位年龄63岁。根据术前是否接受肠镜下纳米碳混悬液病变定位,分为定位组(85例)和非定位组(1 258例)。观察指标:(1)两组患者倾向评分匹配情况及匹配后临床资料比较;(2)术中观察定位组病变部位染色情况;(3)比较匹配后两组患者淋巴结检出数及阳性淋巴结数,并进行单因素、多因素分析;(4)观察随访期间患者肿瘤复发转移情况、3年无瘤生存率。
(1)定位组和非定位组各73例患者匹配成功。匹配后两组患者性别、年龄、体质量指数(BMI)、肿瘤大体病理类型、最大直径、T分期、组织学分级、神经侵犯等基线资料比较,差异均无统计学意义(P值均>0.05)。(2)定位组85例术中均清晰可见肿瘤原发灶部位黑染,均定位准确。(3)定位组淋巴结检出数中位数18(15,24)枚,非定位组为16(14,19)枚,差异有统计学意义(Z=-2.909, P<0.05);两组的阳性淋巴结检出数分别为0(0,1)枚和0(0,0)枚,差异无统计学意义(Z=-1.045, P>0.05)。单因素、多因素分析显示,肿瘤部位、纳米碳定位是结直肠癌术后淋巴结检出数的独立影响因素(P值均<0.05)。(4)146例患者中,142例术后随访3.2~47.0个月,中位随访时间25.0个月。72例定位组患者和70例非定位组患者的3年无瘤生存率分别为83.4%和91.7%,差异无统计学意义(P>0.05)。
术前肠镜下注射纳米碳可协助腹腔镜手术中准确定位结直肠癌病变所在位置。纳米碳作为淋巴结示踪剂,可以明显增加手术标本的淋巴结检出数目;但其是否能够提高阳性淋巴结检出数、是否能够改善患者的远期生存率,则有待进一步探究。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是最常见的消化系统恶性肿瘤之一,在我国恶性肿瘤的发病率中居第三位(28.20/10万),病死率居第五位(13.61/10万)[1]。随着结直肠癌高危人群筛查的普及和肠镜等检查手段的广泛开展,早期、体积较小的结直肠癌诊断率逐渐得到提高,同时其内镜下切除疗效确切。对于内镜下非治愈性切除、体积较小、多原发、术后复发等结直肠癌的外科根治手术,准确定位病变是手术成功的前提,倘若定位错误将导致病变遗漏、切缘不足、肠段切除过多等不良结局[2,3]。结直肠癌定位方法较多,包括结肠气钡双重造影、CT、肠镜等。据文献报道,肠镜的定位错误发生率达11%~31.2%[4,5]。肠镜下注射染色剂进行定位可以提高定位准确率,通过肠壁浆膜面的染色使得病变的位置在腹腔镜手术探查中一目了然,在临床上已经得到普遍认可和应用[6,7]。传统用于内镜下染色标记的染料有亚甲蓝、印度墨水等。亚甲蓝颗粒直径小、弥散性强,易造成术野污染且在组织中滞留时间较短,而印度墨水易引起局部组织炎性反应[7,8],这些缺点限制了传统染色剂在临床上的应用。新型染色剂纳米碳克服了上述缺点,具有组织相容性好、定位准确率高、染色明显且持久、示踪淋巴结等优势,已在甲状腺、乳腺、胃肠肿瘤的外科手术中得到广泛运用[6,9,10]。纳米碳在结直肠癌的外科手术治疗中具有重要作用,除了病变的定位,同时可以提高手术切除标本的淋巴结检出数。至于纳米碳是否能够提高阳性淋巴结检出数,甚至影响患者的预后,目前尚无定论。本研究采用倾向性评分匹配法和回顾性队列研究方法,通过观察纳米碳的定位效果、对淋巴结检出数以及患者预后的影响,探讨纳米碳在腹腔镜结直肠癌根治术中的临床应用价值。
纳入标准:(1)病理诊断为结直肠原发性腺癌,无远处转移及原发病灶不可切除因素;(2)由同一手术治疗组完成的择期手术;(3)行腹腔镜下结直肠癌根治术(D3淋巴结清扫),其中包括早期结直肠癌非治愈性内镜切除术后追加根治术。排除标准:(1)既往肠癌病史,合并其他恶性肿瘤病史;(2)术前行辅助放化疗;(3)肿瘤直接侵犯其他组织器官。
采用回顾性队列研究方法。纳入2016年1月—2018年12月南京医科大学第一附属医院1 343例行腹腔镜结直肠癌根治术患者的临床资料,其中男870例、女473例,年龄17~89岁、中位年龄63岁。右半结肠癌324例,左半结肠癌339例,直肠癌680例。根据术前是否采用肠镜下纳米碳混悬液病变定位,分为定位组85例和非定位组1 258例。
本研究符合《赫尔辛基宣言》的要求。患者及家属均签署手术知情同意书。
定位指征:(1)影像学无法准确定位的病变;(2)非治愈性内镜切除后追加结直肠癌根治术的病变。
定位方法:术前1~2 d行机械性肠道准备,电子结肠镜下采用"三明治"法于肿瘤下缘或两侧选2~3点注射。内镜用注射针穿刺黏膜下层,注射少量生理盐水抬举黏膜;随后原部位注射1∶4纳米碳混悬注射液(50 mg/mL,卡纳琳,重庆莱美药业有限公司)生理盐水稀释液2~3 mL;再次注射1 mL生理盐水[11]。
所有患者行气管插管全身麻醉。根据肿瘤部位决定手术方式,按照完整结肠系膜切除术(complete mesocolic excision, CME)或全直肠系膜切除术(total mesorectal excision, TME)的方法进行腹腔镜结直肠癌根治(D3淋巴结清扫)。直视下锐性分离结直肠脏壁层筋膜间隙,将病灶肠段连同系膜以及系膜根部淋巴与脂肪组织完整切除,清扫肠旁、中间、中央淋巴结。
(1)倾向评分匹配情况及匹配后两组患者临床病理资料,包括性别、年龄、BMI、肿瘤部位、肿瘤大体病理类型、最大直径、T分期、组织学分级、脉管侵犯、神经侵犯、癌结节等;(2)腹腔镜手术中,观察定位组患者病变部位纳米碳示踪着色情况;(3)比较匹配后两组淋巴结检出数及阳性淋巴结检出数,并进行单因素、多因素分析淋巴结检出数的影响因素;(4)随访和生存情况:肿瘤复发、转移情况,以及3年无瘤生存率。
采用电话和门诊复诊相结合的方式对患者进行随访,术后2年内每3~6个月随访1次,2年后每1年随访1次。随访内容包括采集病史、体检,检测癌胚抗原、糖类抗原19-9,每6~12个月进行胸腹盆腔增强CT检查,每1~3年复查肠镜。随访终点为发现肿瘤复发、转移或患者死亡。
应用SPSS 23.0统计学软件进行数据匹配及分析。倾向性评分匹配选用最近邻匹配法进行1∶1匹配,匹配容差0.02。计量资料进行正态性分布检验,偏态分布数据采用M(P25, P75)表示,组间比较采用Mann-WhitneyU、Kruskal-WallisH检验。分类和等级资料以绝对数或百分比表示,组间比较采用χ2检验和Mann-WhitneyU秩和检验。将单因素分析筛选出的潜在影响因素作为自变量(P<0.1),淋巴结检出数作为因变量进行Poisson回归多因素分析。采用Kaplan-Meier法计算生存时间和生存率,并绘制生存曲线。采用Log-rank检验进行生存情况分析。失访患者作为删失值纳入生存分析。以P<0.05为差异有统计学意义。
定位组85例患者术前均顺利完成肠镜下纳米碳染色定位,无出血、穿孔等并发症发生,术中均清晰可见肿瘤原发病变部位黑染,定位准确。其中30例为内镜切除后追加手术患者,55例为影像学无法准确定位患者。
匹配前,定位组与非定位组患者的年龄、BMI、肿瘤部位、肿瘤大体病理类型、最大直径、T分期、组织学分级、神经侵犯等比较,差异均有统计学意义(P值均<0.05)。倾向评分匹配后,定位组与非定位组分别匹配73例患者,两组基线资料比较差异均无统计学意义(P值均>0.05),见表1。
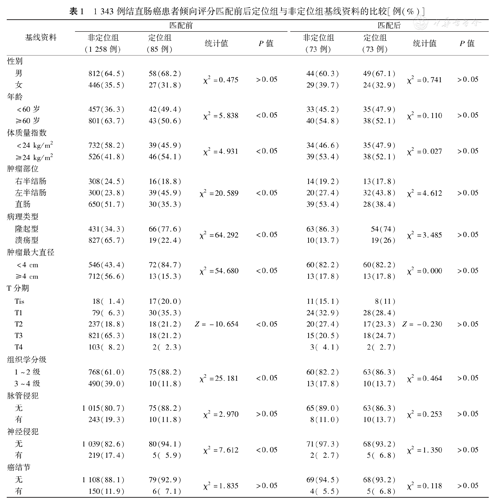
1 343例结直肠癌患者倾向评分匹配前后定位组与非定位组基线资料的比较[例(%)]
1 343例结直肠癌患者倾向评分匹配前后定位组与非定位组基线资料的比较[例(%)]
| 基线资料 | 匹配前 | 匹配后 | |||||||
|---|---|---|---|---|---|---|---|---|---|
| 非定位组(1 258例) | 定位组(85例) | 统计值 | P值 | 非定位组(73例) | 定位组(73例) | 统计值 | P值 | ||
| 男 | 812(64.5) | 58(68.2) | χ2=0.475 | >0.05 | 44(60.3) | 49(67.1) | χ2=0.741 | >0.05 | |
| 女 | 446(35.5) | 27(31.8) | 29(39.7) | 24(32.9) | |||||
| 年龄 | |||||||||
| <60岁 | 457(36.3) | 42(49.4) | χ2=5.838 | <0.05 | 33(45.2) | 35(47.9) | χ2=0.110 | >0.05 | |
| ≥60岁 | 801(63.7) | 43(50.6) | 40(54.8) | 38(52.1) | |||||
| 体质量指数 | |||||||||
| <24 kg/m2 | 732(58.2) | 39(45.9) | χ2=4.931 | <0.05 | 34(46.6) | 35(47.9) | χ2=0.027 | >0.05 | |
| ≥24 kg/m2 | 526(41.8) | 46(54.1) | 39(53.4) | 38(52.1) | |||||
| 肿瘤部位 | |||||||||
| 右半结肠 | 308(24.5) | 16(18.8) | χ2=20.589 | <0.05 | 14(19.2) | 13(17.8) | χ2=4.612 | >0.05 | |
| 左半结肠 | 300(23.8) | 39(45.9) | 20(27.4) | 32(43.8) | |||||
| 直肠 | 650(51.7) | 30(35.3) | 39(53.4) | 28(38.4) | |||||
| 病理类型 | |||||||||
| 隆起型 | 431(34.3) | 66(77.6) | χ2=64.292 | <0.05 | 63(86.3) | 54(74) | χ2=3.485 | >0.05 | |
| 溃疡型 | 827(65.7) | 19(22.4) | 10(13.7) | 19(26) | |||||
| 肿瘤最大直径 | |||||||||
| <4 cm | 546(43.4) | 72(84.7) | χ2=54.680 | <0.05 | 60(82.2) | 60(82.2) | χ2=0.000 | >0.05 | |
| ≥4 cm | 712(56.6) | 13(15.3) | 13(17.8) | 13(17.8) | |||||
| T分期 | |||||||||
| Tis | 18( 1.4) | 17(20.0) | Z=-10.654 | <0.05 | 11(15.1) | 8(11) | Z=-0.230 | >0.05 | |
| T1 | 79( 6.3) | 30(35.3) | 24(32.9) | 28(28.4) | |||||
| T2 | 237(18.8) | 18(21.2) | 20(27.4) | 17(23.3) | |||||
| T3 | 821(65.3) | 18(21.2) | 15(20.5) | 18(24.7) | |||||
| T4 | 103( 8.2) | 2( 2.3) | 3( 4.1) | 2( 2.7) | |||||
| 组织学分级 | |||||||||
| 1~2级 | 768(61.0) | 75(88.2) | χ2=25.181 | <0.05 | 60(82.2) | 63(86.3) | χ2=0.464 | >0.05 | |
| 3~4级 | 490(39.0) | 10(11.8) | 13(17.8) | 10(13.7) | |||||
| 脉管侵犯 | |||||||||
| 无 | 1 015(80.7) | 75(88.2) | χ2=2.970 | >0.05 | 65(89.0) | 63(86.3) | χ2=0.253 | >0.05 | |
| 有 | 243(19.3) | 10(11.8) | 8(11.0) | 10(13.7) | |||||
| 神经侵犯 | |||||||||
| 无 | 1 039(82.6) | 80(94.1) | χ2=7.612 | <0.05 | 71(97.3) | 68(93.2) | χ2=1.350 | >0.05 | |
| 有 | 219(17.4) | 5( 5.9) | 2( 2.7) | 5( 6.8) | |||||
| 癌结节 | |||||||||
| 无 | 1 108(88.1) | 79(92.9) | χ2=1.835 | >0.05 | 69(94.5) | 68(93.2) | χ2=0.118 | >0.05 | |
| 有 | 150(11.9) | 6( 7.1) | 4( 5.5) | 5( 6.8) | |||||
定位组73例患者,共检出淋巴结1 452枚,中位数为18(15,24)枚;非定位组73例患者,共检出淋巴结1 227枚,中位数为16(14,19)枚。定位组检出淋巴结数多于非定位组,差异有统计学意义(Z=-2.909,P<0.05)。定位组与非定位组阳性淋巴结检出数分别为75枚和45枚,中位检出数分别为0(0,1)枚和0(0,0)枚,差异无统计学意义(Z=-1.045,P>0.05)。
单因素分析显示,146例患者淋巴结检出数在不同性别、年龄、肿瘤部位、肿瘤最大直径、是否接受纳米碳定位患者中的差异均有统计学意义(P值均<0.1)。进一步的多因素分析显示,肿瘤部位、纳米碳定位是影响结直肠癌淋巴结检出数的独立影响因素(P值均<0.05)。见表2、表3。

影响146例结直肠癌腹腔镜根治术患者淋巴结检出数的单因素分析
影响146例结直肠癌腹腔镜根治术患者淋巴结检出数的单因素分析
| 临床因素 | 例数 | 淋巴结数[枚,M(P25,P75)] | 统计值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 93 | 16(14,20) | Z=-2.021 | <0.1 | |
| 女 | 53 | 18(15,24.5) | |||
| 年龄 | |||||
| <60岁 | 68 | 18(15,22) | Z=-1.830 | <0.1 | |
| ≥60岁 | 78 | 16(14,21) | |||
| 体质量指数 | |||||
| <24 kg/m2 | 69 | 18(15,22) | Z=-1.161 | >0.1 | |
| ≥24 kg/m2 | 77 | 16(14,20.5) | |||
| 肿瘤部位 | |||||
| 右半结肠 | 27 | 24(16,31) | H=15.849 | <0.1 | |
| 左半结肠 | 52 | 16.5(13.25,20) | |||
| 直肠 | 67 | 16(14,20) | |||
| 病理类型 | |||||
| 隆起型 | 117 | 17(14,21) | Z=-0.467 | >0.1 | |
| 溃疡型 | 29 | 17(15,22) | |||
| 肿瘤最大直径 | |||||
| <4 cm | 120 | 17(14,21) | Z=-1.705 | <0.1 | |
| ≥4 cm | 26 | 19(15,23.5) | |||
| T分期 | |||||
| Tis | 19 | 15(11,19) | H=5.737 | >0.1 | |
| T1 | 52 | 17(14.25,21.75) | |||
| T2 | 37 | 16(14,20.5) | |||
| T3 | 33 | 18(15.5,23.5) | |||
| T4 | 5 | 19(12.5,26) | |||
| 组织学分级 | |||||
| 1~2级 | 123 | 17(15,21) | Z=-0.210 | >0.1 | |
| 3~4级 | 23 | 18(13,21) | |||
| 脉管侵犯 | |||||
| 无 | 128 | 17(14,21) | Z=-1.363 | >0.1 | |
| 有 | 18 | 19.5(15,26) | |||
| 神经侵犯 | |||||
| 无 | 139 | 17(14,21) | Z=-0.863 | >0.1 | |
| 有 | 7 | 24(10,29) | |||
| 癌结节 | |||||
| 无 | 137 | 17(14.5,21) | Z=-0.424 | >0.1 | |
| 有 | 9 | 15(12,27) | |||
| 纳米碳定位 | |||||
| 无 | 73 | 16(14,19) | Z=-2.909 | <0.1 | |
| 有 | 73 | 18(15,24) | |||
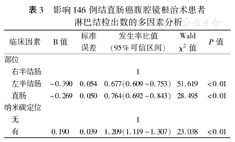
影响146例结直肠癌腹腔镜根治术患者淋巴结检出数的多因素分析
影响146例结直肠癌腹腔镜根治术患者淋巴结检出数的多因素分析
| 临床因素 | B值 | 标准误差 | 发生率比值(95%可信区间) | Wald χ2值 | P值 | |
|---|---|---|---|---|---|---|
| 部位 | ||||||
| 右半结肠 | 1 | |||||
| 左半结肠 | -0.390 | 0.054 | 0.677(0.609~0.753) | 51.619 | <0.01 | |
| 直肠 | -0.269 | 0.050 | 0.764(0.692~0.843) | 28.495 | <0.01 | |
| 纳米碳定位 | ||||||
| 无 | 1 | |||||
| 有 | 0.190 | 0.039 | 1.209(1.119~1.307) | 23.038 | <0.01 | |
对于阳性淋巴结检出数的单因素分析显示,其在肿瘤大体病理类型、T分期、组织学分级、脉管侵犯、神经侵犯、癌结节的差异均有统计学意义(P值均<0.1)。多因素分析显示,T分期、组织学分级、脉管侵犯、癌结节是影响结直肠癌阳性淋巴结检出数的独立影响因素(P<0.05)。见表4、表5。

影响146例结直肠癌患者腹腔镜根治术阳性淋巴结检出数的单因素分析
影响146例结直肠癌患者腹腔镜根治术阳性淋巴结检出数的单因素分析
| 临床因素 | 例数 | 阳性淋巴结数[枚,M(P25,P75)] | 统计值 | P值 | |
|---|---|---|---|---|---|
| 性别 | |||||
| 男 | 93 | 0(0,0) | Z=-0.500 | >0.1 | |
| 女 | 53 | 0(0,0.5) | |||
| 年龄 | |||||
| <60岁 | 68 | 0(0,1) | Z=-1.193 | >0.1 | |
| ≥60岁 | 78 | 0(0,0) | |||
| 体质量指数 | |||||
| <24 kg/m2 | 69 | 0(0,1) | Z=-0.657 | >0.1 | |
| ≥24 kg/m2 | 77 | 0(0,0) | |||
| 肿瘤部位 | |||||
| 右半结肠 | 27 | 0(0,0) | H=0.466 | >0.1 | |
| 左半结肠 | 52 | 0(0,0) | |||
| 直肠 | 67 | 0(0,1) | |||
| 病理类型 | |||||
| 隆起型 | 117 | 0(0,0) | Z=-4.547 | <0.1 | |
| 溃疡型 | 29 | 1(0,3) | |||
| 肿瘤最大直径 | |||||
| <4 cm | 120 | 0(0,0) | Z=-1.396 | >0.1 | |
| ≥4 cm | 26 | 0(0,1) | |||
| T分期 | |||||
| Tis | 19 | 0(0,0) | H=21.908 | <0.1 | |
| T1 | 52 | 0(0,0) | |||
| T2 | 37 | 0(0,0.5) | |||
| T3 | 33 | 0(0,2) | |||
| T4 | 5 | 0(0,3.5) | |||
| 组织学分级 | |||||
| 1~2级 | 123 | 0(0,0) | Z=-3.807 | <0.1 | |
| 3~4级 | 23 | 0(0,4) | |||
| 脉管侵犯 | |||||
| 无 | 128 | 0(0,0) | Z=-5.385 | <0.1 | |
| 有 | 18 | 1.5(0,3.5) | |||
| 神经侵犯 | |||||
| 无 | 139 | 0(0,0) | Z=-4.852 | <0.1 | |
| 有 | 7 | 2(1,5) | |||
| 癌结节 | |||||
| 无 | 137 | 0(0,0) | Z=-6.047 | <0.1 | |
| 有 | 9 | 3(1.5,9.5) | |||
| 纳米碳定位 | |||||
| 无 | 73 | 0(0,0) | Z=-1.045 | >0.1 | |
| 有 | 73 | 0(0,1) | |||

影响146例结直肠癌腹腔镜根治术患者阳性淋巴结检出数的多因素分析
影响146例结直肠癌腹腔镜根治术患者阳性淋巴结检出数的多因素分析
| 临床因素 | B值 | 标准误差 | 发生率比值(95%可信区间) | Waldχ2值 | P值 | |
|---|---|---|---|---|---|---|
| T分期 | ||||||
| Tis | 1 | |||||
| T1 | 26.753 | 4.15 (0~0) | ||||
| T2 | 26.932 | 0.305 | 4.97 (2.73~9.05) | 7 759.950 | <0.01 | |
| T3 | 26.959 | 0.315 | 5.10 (2.75~9.48) | 7 282.251 | <0.01 | |
| T4 | 26.086 | 0.502 | 2.13 (7.97~5.71) | 2 695.397 | <0.01 | |
| 组织学分级 | ||||||
| 1~2级 | 1 | |||||
| 3~4级 | 1.299 | 0.202 | 3.667(2.466~5.453) | 41.207 | <0.01 | |
| 脉管侵犯 | ||||||
| 无 | 1 | |||||
| 有 | 0.886 | 0.241 | 2.426(1.512~3.892) | 13.499 | <0.01 | |
| 癌结节 | ||||||
| 无 | 1 | |||||
| 有 | 1.802 | 0.238 | 6.063(3.798~9.678) | 57.040 | <0.01 | |
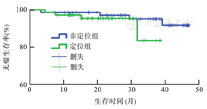
随访截至2019年12月。146例患者中,4例失访,142例患者获得术后随访3.2~47.0个月,中位随访时间25.0个月。72例定位组患者与70例非定位组患者3年无瘤生存率分别为83.4%和91.7%,两组比较,差异无统计学意义(P>0.05)。见图1。

本研究发现,纳米碳定位组85例患者,纳米碳染色标记均定位准确、清晰可见,满足了腹腔镜手术对病变定位的要求。结直肠癌的准确定位是结直肠癌腹腔镜手术的必要前提。非治愈性切除的早期结直肠癌追加外科手术,有助于改善患者的预后[12]。临床上,部分早期结直肠癌患者接受内镜下切除后还需要追加外科手术的情况包括:(1)切除标本侧切缘或基底切缘阳性(距切除切缘不足500 μm);(2)黏膜下层高度浸润病变(黏膜下层浸润1 000 μm以上,恶性息肉3 000 μm以上);(3)脉管侵袭阳性;(4)低分化腺癌、未分化癌;(5)癌瘤出芽分级G2以上[2]。林晨等[6]对35例需要追加外科手术的早期结肠癌患者进行纳米碳定位,发现纳米碳染色定位准确,有助于提高外科手术尤其是腹腔镜手术的安全性和精准性。临床操作中,笔者建议手术前1~2 d进行肠镜下纳米碳染色定位,之后无需再次机械性肠道准备,有利于手术前排除肠腔内过多的气体。定位时,多点注射纳米碳混悬液,跨度至少覆盖2/3肠腔,以避免系膜侧病变染色无法探寻。
本研究进一步采用倾向性评分匹配法探讨纳米碳是否影响结直肠癌淋巴结检出数。倾向评分匹配法近年来在临床统计分析中得到广泛运用,可以有效降低组间混杂效应,均衡组间差异,便于利用非随机分组数据研究试验因素和结局之间的关系,提高研究结果的可信度[13]。本研究结果显示,纳米碳可以提高结直肠癌淋巴结检出数,并且通过多因素分析显示纳米碳是结直肠癌淋巴结检出数的独立影响因素,但对阳性淋巴结检出数的差异无统计学意义。纳米碳作为第三代淋巴结示踪剂,具有高度的淋巴系统趋向性。纳米碳粒径大小较为均匀,平均粒径约150 nm。毛细血管内皮细胞排列致密,间隙为30~50 nm,而毛细淋巴管内皮呈叠瓦状排列,间隙达100~500 nm。组织间液静水压大于毛细淋巴管内压力,纳米碳局部注射后会随着压力差进入淋巴管道;此外,卡纳琳注射到局部后可被巨噬细胞吞噬,随着巨噬细胞游走进入淋巴系统内,从而实现肿瘤区域淋巴结的活体染色[14,15]。杨斌等[15]发现,纳米碳染色后淋巴结染色率为56.8%(412/725枚),纳米碳淋巴示踪可提高淋巴结清扫数,特别是直径<5 mm的淋巴结[4.6%(33/725枚)],显著高于未示踪组[2.0%(10/478枚),P=0.025]。张相春等[16]通过53例腹腔镜结直肠癌根治手术患者的资料分析发现,纳米碳染色组平均淋巴结检出数及微小淋巴结(<5 mm)检出数均明显高于未染色对照组[(16.7±3.2)和(12.6±2.3)枚,P<0.01;(5.3±2.4)和(2.1±1.2)枚,P<0.01)]。在临床实践中,病理医生多通过视触结合的方法寻找淋巴结,纳米碳染色可协助病理医生在脂肪组织中寻找淋巴结,增加淋巴结的检出数,尤其是直径<5 mm的淋巴结,可能有利于提高病理N分期的准确性。赵磊等[17]通过80例腹腔镜直肠癌患者的随机分组研究发现,纳米碳染色定位可提高腹腔镜直肠癌根治术中淋巴结检出数(P<0.05),而对阳性淋巴结检出数无影响(P>0.05);本研究结果与其一致。
本研究的生存分析显示,定位组72例患者与非定位组70例患者3年无瘤生存率分别为83.4%和91.7%,差异无统计学意义(P>0.05),提示增加的淋巴结数目并不预示着预后的改善。目前的研究尚不能明确纳米碳染色是否有助于转移淋巴结的发现。采用非病理学方法发现转移的淋巴结可能有助于指导术中淋巴结的精准清扫。
纳米碳还可以用于结直肠癌前哨淋巴结(sentinel lymph node, SLN)的检测。Yan等[18]对73例T1~T2期结直肠癌患者术前进行肠镜下纳米碳染色,平均检出前哨淋巴结3枚,其对淋巴结转移预测的敏感性和特异性分别为91.67%和100%。然而,目前结直肠癌SLN的检测尚无明确的临床实用价值,选择性淋巴结清扫在结直肠癌的手术治疗中尚存争议。有观点认为,结直肠癌SLN的检测,并不意图缩减手术切除范围,而是在于鉴别转移可能性大的淋巴结,进而提醒病理医生进行更为精确、细致的检查[19]。
综上所述,结直肠癌术前进行肠镜下纳米碳染色,有利于术中准确定位病灶所在,尤其是对于结直肠癌内镜切除后追加手术以及影像学定位不确切的病例。纳米碳有助于示踪淋巴结,可以提高淋巴结检出数,然而对于预后的改善可能缺乏实际意义。本研究的不足之处:第一,本研究系回顾性研究,虽然使用了倾向评分匹配,但匹配病例数较少,仍然存在一定程度的选择偏倚;第二,本研究随访时间较短,未能得出长期生存结果。纳米碳示踪技术的临床应用价值有待大样本、长时间的临床随机对照研究进一步论证。
所有作者均声明不存在利益冲突



























