
探讨老年脑白质病变(WML)与阿尔茨海默病(AD)痴呆的关联。
回顾性研究。纳入2018年8月—2020年7月陆军特色医学中心神经内科981例住院患者的临床和影像学资料。其中男472例、女509例,年龄75~89岁,患者均行头颅MR检查评估有无WML病变,并采用神经心理量表评估有无认知功能障碍。依据临床诊断结果将患者分为认知功能正常组(对照组)743例和AD痴呆组238例,其中,对照组23例、AD组48例患者接受了MR弥散张量成像(DTI)检查。观察指标:比较两组患者的临床特征,并采用logistics回归分析AD痴呆发生危险因素。比较两组患者WML的分布及其分级的差异。分析患者脑部MR-DTI,比较两组部分患者额叶、颞叶、顶叶、枕叶、半卵圆区各向异性分数(FA)值和表观扩散系数(ADC)值差异。
多因素logistics回归分析结果显示,年龄、女性、低教育水平、寡居、高血压、糖尿病、高胆固醇血症、吸烟及中度和重度WML是AD痴呆发生的危险因素(P值均<0.05)。AD痴呆组侧脑室旁WML多于皮质下WML (71.0%与29.0%),皮质下WML多于对照组(29.0%与19.4%),AD痴呆组的侧脑室旁和皮质下的中度、重度WML均多于对照组,差异均有统计学意义(P值均<0.05)。MR-DTI分析显示:两组间额叶和半卵圆区的FA值、ADC值以及顶叶的FA值比较,差异均有统计学意义(P值均<0.05);两组间颞叶和枕叶的FA值、ADC值以及顶叶的ADC值比较,差异均无统计学意义(P值均>0.05)。
中度和重度WML与AD痴呆发生风险有明显的关联;侧脑室旁和皮质下WML与AD痴呆也有关联。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
阿尔茨海默病(Alzheimer's disease, AD)是神经系统退行性疾病,以进行性认知功能损害和行为障碍为特征,是目前影响全球老年人健康的主要公共卫生问题,造成了家庭及社会的严重负担[1]。AD痴呆占所有痴呆患者的60%~70%,至今病因不明,一般认为与遗传、免疫、神经递质和环境等多种因素有关[2]。目前,AD的药物治疗效果不佳,AD痴呆的防治效果并不理想,因此,对AD危险因素的研究具有重要的临床意义。
临床中,我们常遇到脑白质病变(white matter lesions, WML)和AD痴呆同时存在的老年患者案例。WML在60岁以上老年人群中较常见,发生率高达50%,其发生率随着年龄的增长而明显升高[3],主要表现为侧脑室旁区域和皮质下的白质病变,在MR T2WI和MR液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)像中呈斑点状或片状病变[4]。有研究证明,WML与情绪、认知功能和步态等明显相关,不同部位及不同程度的脑白质损害可出现不同的临床表现[5]。自从MR广泛应用以来,使WML的研究得到进一步发展,近年来临床开始使用MR弥散张量成像(diffusion tensor imaging, DTI)技术评估WML的特征[6]。本文通过分析老年人群AD痴呆发生的危险因素,以及患者脑部的MR-DTI与AD痴呆的关系,旨在探讨WML与AD痴呆发生的关联,为AD痴呆的诊断和防治提供理论依据。
纳入标准:(1)年龄≥75岁[7];(2)因认知功能损害,或脑缺血发作,或头昏、头痛住院;(3)均行MR检查;(4)能配合完成神经心理学评估[8]。排除标准:(1)亨廷顿病痴呆、额颞叶痴呆、路易体痴呆;(2)有明确脑卒中、脑外伤及颅内肿瘤病史;(3)有其他可能影响认知功能的神经系统疾病,如颅内感染、中枢神经系统脱髓鞘疾病、一氧化碳中毒等;(4)临床资料不完整。
回顾性研究。纳入2018年8月—2020年7月陆军特色医学中心神经内科981例老年患者的临床资料和影像学资料,其中男472例、女509例,年龄75~89岁。根据神经心理学评估结果分组:743例认知功能正常(对照组),238例AD痴呆(AD痴呆组)。其中,对照组23例、AD组48例患者接受了MR-DTI检查。本研究获得陆军特色医学中心伦理委员会批准[医学研究(2018)60号],均获得患者本人或监护人的知情同意,并签署知情同意书。
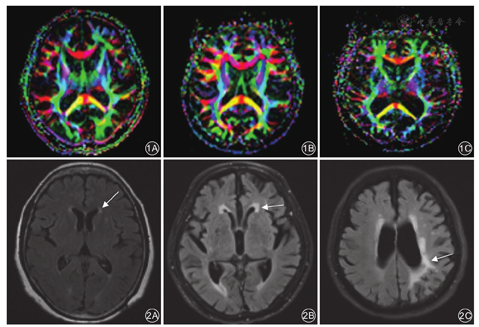
采用德国Siemens MAGNETOM Verio 3.0 T MR扫描仪。所有患者行自旋回波序列头部T1WI、T2WI及FLAIR横断位和T1WI矢状位扫描。T1WI参数:TR 450 ms、TE 15 ms,T2WI参数:TR 4 000 ms、TE 120 ms。根据需要再行各相冠状位扫描,层厚3~6 mm,层间距0.3~0.6 mm。DTI检查的扫描参数:TR 6 000 ms,TE 90 ms,层厚3 mm,层间隔0~1 mm,视野240 mm×240 mm,矩阵128×128,平均激励次数3,b值为0、1 000 ms/mm2,扩散特征是沿着20个非共线方向测量。数据采集完成后,运用荷兰Philips Extended MR工作站R2.6.3.4软件进行分析,重建出各向异性分数(fractional anisotropy, FA)图、表观扩散系数(apparent diffusion coefficont, ADC)图。在FA轴位图不同层面上选择感兴趣区,测量FA值、ADC值。见图1。

比较两组患者的临床特征,包括年龄、性别、受教育程度、寡居、BMI、既往高血压、糖尿病、高胆固醇血症、冠心病、抑郁症、WML、吸烟、饮酒情况,以及简易精神状态量表(mini-mental state examination,MMSE)评分[9]和Barthel指数[10],采用logistics回归分析影响AD痴呆发生的危险因素。比较两组患者WML的分布及其分级的差异。比较两组部分患者额叶、颞叶、顶叶、枕叶、半卵圆区FA值和ADC值差异。
患者的吸烟史分为从不吸烟、过去吸烟和现在吸烟三种状态;饮酒史分为从不饮酒、过去饮酒和现在饮酒三种状态。其中曾经吸烟和现在吸烟两种情况,即曾经或现在处于吸烟状态,吸烟总持续时间≥5年且吸烟量≥10支/天。过去饮酒和现在饮酒是指过去或者现在处于饮酒状态,饮酒频率≥1次/周,且每次饮酒的乙醇含量≥8 g[11]。
WML的诊断及分级:WML通过颅脑MR T2WI和FLAIR像进行诊断,表现为斑点状或片状病变,见图2;按照病变部位分为脑室旁白质WML和皮质下WML。WML的严重程度判定参照修订后的Fazekas VAS[12],共分为4个等级:(1)无WML为0分;(2)轻度为1分,单个病灶直径<10 mm,所有病灶直径总和<20 mm;(3)中度为2分,存在融合的病变,但病变中无桥状连接,单个病灶直径为10~20 mm,所有病灶直径总和≥20 mm;(4)重度为3分,单个或融合性病损≥20 mm。
抑郁症的诊断:抑郁症的评估基于汉密尔顿抑郁量表(Hamilton depression scale, HAMD)评分[13],于患者入院7 d内进行量表调查,由患者本人或者照顾患者的亲属回答。
AD诊断标准:AD的诊断基于美国神经病学-语言障碍-脑卒中-老年性痴呆及相关疾病学会标准[14],血管性痴呆和混合性痴呆的诊断基于Hachinski缺血量表[15],路易体痴呆症的诊断基于第四版路易体痴呆症和管理共识[16],额颞叶痴呆的诊断基于临床诊断指南[17]。
认知功能障碍神经心理学评估方法:(1)采用MMSE评分进行神经心理学评估[9],该量表有10项共30分,得分≥27分(教育年限6年以下≥24分)为认知功能正常;21~26分(教育年限6年以下为21~23分)为轻度认知功能障碍;10~20分为中度认知功能障碍;0~9分为重度认知功能障碍。(2)通过Barthel指数量表[10]评估受试者的日常生活能力,该量表有10项共100分,分数越高代表受试者的独立生活能力越强,61~99分为轻度自理能力障碍,41~60分为中度自理能力障碍,≤40分为重度自理能力障碍。
应用SPSS 26.0软件进行统计分析。符合正态性分布的计量资料以 ±s表示,两组间比较采用t检验;分类资料采用χ2检验。等级资料采用Mann-Whitney U检验。对照组与AD痴呆组为应变量,分别赋值1和2;年龄、性别、受教育程度、寡居、BMI、高血压、糖尿病、高胆固醇血症、冠心病、抑郁症、吸烟、饮酒、WML、MMSE评分和Barthel指数为自变量,其中女性、寡居、高血压、糖尿病、高胆固醇血症、冠心病和抑郁症赋值为1,男性、非寡居、无高血压、无糖尿病、无高胆固醇血症、无冠心病、无抑郁症、不吸烟、不饮酒和无WML赋值为0,曾经吸烟、曾经饮酒和轻度WML赋值为1,现在吸烟、现在饮酒和中度WML赋值为2,重度WML赋值为3。采用非条件多因素logistics回归分析AD痴呆发生的危险因素以及WML严重程度与AD痴呆的关联。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验;分类资料采用χ2检验。等级资料采用Mann-Whitney U检验。对照组与AD痴呆组为应变量,分别赋值1和2;年龄、性别、受教育程度、寡居、BMI、高血压、糖尿病、高胆固醇血症、冠心病、抑郁症、吸烟、饮酒、WML、MMSE评分和Barthel指数为自变量,其中女性、寡居、高血压、糖尿病、高胆固醇血症、冠心病和抑郁症赋值为1,男性、非寡居、无高血压、无糖尿病、无高胆固醇血症、无冠心病、无抑郁症、不吸烟、不饮酒和无WML赋值为0,曾经吸烟、曾经饮酒和轻度WML赋值为1,现在吸烟、现在饮酒和中度WML赋值为2,重度WML赋值为3。采用非条件多因素logistics回归分析AD痴呆发生的危险因素以及WML严重程度与AD痴呆的关联。以P<0.05为差异有统计学意义。
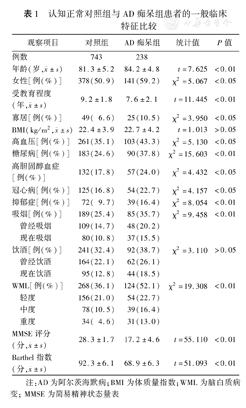
对照组与AD痴呆组患者的BMI及饮酒者占比差异均无统计学意义(P值均>0.05)。与对照组相比,AD痴呆组患者年龄更大,女性更多、受教育程度更低、寡居较多、吸烟更多、抑郁症更多,高血压、糖尿病、高胆固醇血症、冠心病、WML发生率更高,MMSE评分及Barthel指数量表评分更低(P值均<0.05)。见表1。
认知正常对照组与AD痴呆组患者的一般临床特征比较
认知正常对照组与AD痴呆组患者的一般临床特征比较
| 观察项目 | 对照组 | AD痴呆组 | 统计值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 743 | 238 | |||
年龄(岁, ±s) ±s) | 81.3±5.2 | 84.2±4.8 | t=7.625 | <0.01 | |
| 女性[例(%)] | 378(50.9) | 141(59.2) | χ2=5.067 | <0.05 | |
受教育程度(年, ±s) ±s) | 9.2±1.8 | 7.6±2.1 | t=11.445 | <0.01 | |
| 寡居[例(%)] | 49( 6.6) | 25(10.5) | χ2=3.950 | <0.05 | |
BMI(kg/m2, ±s) ±s) | 22.4±3.9 | 22.7±4.2 | t=1.013 | >0.05 | |
| 高血压[例(%)] | 261(35.1) | 103(43.3) | χ2=5.130 | <0.05 | |
| 糖尿病[例(%)] | 183(24.6) | 90(37.8) | χ2=15.603 | <0.01 | |
| 高胆固醇血症[例(%)] | 132(17.8) | 57(24.0) | χ2=4.432 | <0.05 | |
| 冠心病[例(%)] | 125(16.8) | 54(22.7) | χ2=4.157 | <0.05 | |
| 抑郁症[例(%)] | 72( 9.7) | 39(16.4) | χ2=8.054 | <0.01 | |
| 吸烟[例(%)] | 189(25.4) | 85(35.7) | χ2=9.458 | <0.01 | |
| 曾经吸烟 | 109(14.7) | 48(20.2) | |||
| 现在吸烟 | 80(10.8) | 37(15.5) | |||
| 饮酒[例(%)] | 241(32.4) | 92(38.7) | χ2=3.110 | >0.05 | |
| 曾经饮酒 | 164(22.1) | 62(26.1) | |||
| 现在饮酒 | 95(12.8) | 44(18.5) | |||
| WML[例(%)] | 268(36.1) | 124(52.1) | χ2=19.308 | <0.01 | |
| 轻度 | 156(21.0) | 54(22.7) | |||
| 中度 | 78(10.5) | 39(16.4) | |||
| 重度 | 34( 4.6) | 31(13.0) | |||
MMSE评分(分, ±s) ±s) | 28.3±1.7 | 17.2±4.6 | t=55.110 | <0.01 | |
Barthel指数(分, ±s) ±s) | 92.3±6.1 | 68.9±6.3 | t=51.093 | <0.01 | |
注:AD为阿尔茨海默病;BMI为体质量指数;WML为脑白质病变;MMSE为简易精神状态量表
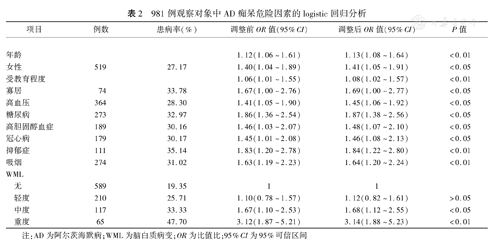
从表1中筛选P值<0.05的自变量纳入多因素回归模型。结果显示,年龄、女性、受教育程度、寡居、高血压、糖尿病、高胆固醇血症、冠心病、抑郁症和吸烟及中度、重度WML均是AD痴呆发生的危险因素。见表2。
981例观察对象中AD痴呆危险因素的logistic回归分析
981例观察对象中AD痴呆危险因素的logistic回归分析
| 项目 | 例数 | 患病率(%) | 调整前OR值(95%CI) | 调整后OR值(95%CI) | P值 | |
|---|---|---|---|---|---|---|
| 年龄 | 1.12(1.06~1.61) | 1.13(1.08~1.64) | <0.01 | |||
| 女性 | 519 | 27.17 | 1.40(1.04~1.89) | 1.41(1.05~1.91) | <0.05 | |
| 受教育程度 | 1.06(1.01~1.55) | 1.08(1.02~1.57) | <0.01 | |||
| 寡居 | 74 | 33.78 | 1.67(1.00~2.76) | 1.69(1.00~2.77) | <0.05 | |
| 高血压 | 364 | 28.30 | 1.41(1.05~1.90) | 1.45(1.06~1.92) | <0.05 | |
| 糖尿病 | 273 | 32.97 | 1.86(1.36~2.54) | 1.87(1.38~2.56) | <0.05 | |
| 高胆固醇血症 | 189 | 30.16 | 1.46(1.03~2.07) | 1.48(1.07~2.10) | <0.05 | |
| 冠心病 | 179 | 30.17 | 1.45(1.01~2.08) | 1.46(1.08~2.13) | <0.05 | |
| 抑郁症 | 111 | 35.14 | 1.83(1.20~2.78) | 1.84(1.22~2.80) | <0.01 | |
| 吸烟 | 274 | 31.02 | 1.63(1.19~2.23) | 1.64(1.20~2.24) | <0.01 | |
| WML | ||||||
| 无 | 589 | 19.35 | 1 | 1 | ||
| 轻度 | 210 | 25.71 | 1.10(0.78~1.57) | 1.12(0.82~1.61) | >0.05 | |
| 中度 | 117 | 33.33 | 1.67(1.10~2.53) | 1.68(1.12~2.55) | <0.05 | |
| 重度 | 65 | 47.70 | 3.12(1.87~5.21) | 3.14(1.88~5.23) | <0.01 | |
注:AD为阿尔茨海默病;WML为脑白质病变;OR为比值比;95%CI为95%可信区间
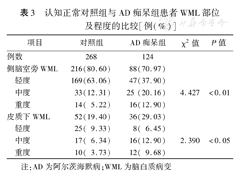
AD痴呆组和对照组患者侧脑室旁和皮质下WML占比比较,差异均有统计学意义(P值均<0.05)。AD痴呆组的侧脑室旁和皮质下的中度、重度WML占比均高于对照组,差异均有统计学意义(P值均<0.05)。见表3。
认知正常对照组与AD痴呆组患者WML部位及程度的比较[例(%)]
认知正常对照组与AD痴呆组患者WML部位及程度的比较[例(%)]
| 项目 | 对照组 | AD痴呆组 | χ2值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 268 | 124 | |||
| 侧脑室旁WML | 216(80.60) | 88(70.97) | |||
| 轻度 | 169(63.06) | 47(37.90) | 4.427 | <0.01 | |
| 中度 | 33(12.31) | 25 (20.16) | |||
| 重度 | 14( 5.22) | 16(12.90) | |||
| 皮质下WML | 52(19.40) | 36(29.03) | |||
| 轻度 | 25( 9.33) | 8( 6.45) | 2.390 | <0.05 | |
| 中度 | 17( 6.34) | 16(12.90) | |||
| 重度 | 10( 3.73) | 12( 9.68) | |||
注:AD为阿尔茨海默病;WML为脑白质病变
对照组和AD痴呆组分别检测了23例和48例不同区域脑组织的FA值和ADC值。DTI分析显示:两组间额叶和半卵圆区的FA值、ADC值以及顶叶的FA值比较,差异均有统计学意义(P值均<0.05);两组间颞叶和枕叶的FA值、ADC值以及顶叶的ADC值比较,差异均无统计学意义(P值均>0.05)。见表4。
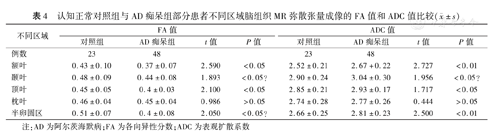
认知正常对照组与AD痴呆组部分患者不同区域脑组织MR弥散张量成像的FA值和ADC值比较( ±s)
±s)
认知正常对照组与AD痴呆组部分患者不同区域脑组织MR弥散张量成像的FA值和ADC值比较( ±s)
±s)
| 不同区域 | FA值 | ADC值 | ||||||
|---|---|---|---|---|---|---|---|---|
| 对照组 | AD痴呆组 | t值 | P值 | 对照组 | AD痴呆组 | t值 | P值 | |
| 例数 | 23 | 48 | 23 | 48 | ||||
| 额叶 | 0.43±0.10 | 0.37±0.07 | 2.590 | <0.05 | 2.52±0.21 | 2.67+0.22 | 2.727 | <0.01 |
| 颞叶 | 0.48±0.09 | 0.44±0.08 | 1.893 | <0.05? | 2.90±0.24 | 3.04±0.30 | 1.956 | <0.05? |
| 顶叶 | 0.45±0.05 | 0.4±0.03 | 2.100 | <0.05 | 2.85±0.21 | 2.93±0.17 | 1.717 | <0.05 |
| 枕叶 | 0.46±0.04 | 0.45±0.04 | 0.986 | >0.05 | 2.74±0.28 | 2.77±0.26 | 0.444 | >0.05 |
| 半卵圆区 | 0.51±0.07 | 0.4±0.08 | 2.050 | <0.05? | 2.66±0.25 | 2.81±0.23 | 2.500 | <0.01 |
注:AD为阿尔茨海默病;FA为各向异性分数;ADC为表观扩散系数
据WHO统计,2015年全球AD患者人数为4 000多万;随着人口老龄化的进展,预计2030年AD痴呆患者将达到7 000多万人,2050年将达到1.3亿人[1]。AD痴呆是一种起病隐匿、进行性发展的神经系统退行性疾病,临床上以记忆障碍、失语、失用、失认、执行功能障碍、视空间技能损害以及人格和行为改变等表现为特征,由于治疗效果不理想,也是世界神经科学和神经病学研究的热点和难点问题[18]。
AD痴呆的病因复杂多样,目前普遍被认可的假说是淀粉样斑块的形成和神经原纤维缠结的结果,导致神经变性和神经元细胞死亡。有研究证明,不论是在男性群体,还是在女性群体中,高血压对他们的认知功能均会产生负面影响,是AD痴呆的独立危险因素[19]。在所有心血管危险因素中,血脂异常与AD痴呆也有关联[20]。糖尿病可以导致内皮功能障碍,加速动脉粥样硬化的发生发展,同时还可引起脑微血管损伤。一项为期12年的队列研究发现,糖尿病或高糖化血红蛋白水平与较低的认知能力相关(P=0.004),糖尿病患者痴呆症的发病率增加[21]。弥漫性的白质脱髓鞘使白质完整性受损,影响了正常的轴突传导,神经通路功能不全,以及海马结构和功能受损,最终诱发认知功能障碍。众所周知的是,大部分患有AD痴呆症的患者也有脑血管病变[22]。一项尸检数据表明,血管病理学常与AD病理学共存,增加了认知障碍的可能性[23]。本研究结果也显示,AD痴呆的发生与年龄、性别、高血压、糖尿病及其他因素有关,是多种危险因素共同作用的结果。
此外,本研究还显示WML与AD痴呆之间的关联性。WML可以导致认知功能损害,以执行功能减退为主,主要表现为记忆障碍、注意力减退、信息处理速度减慢及语言流利度下降等方面。有专家对2 907名无脑卒中史的老年人进行了AD痴呆多基因风险评分与血管病理和认知相关性的研究,发现AD痴呆多基因风险与WML之间关系密切[24]。另有研究发现,控制可改变的WML的危险因素对减少或延缓痴呆症的发病具有特别重要的意义[25]。Ferencz等[26]研究证实,载脂蛋白E(ApoE)的等位基因变异与AD痴呆易感性有关,是AD痴呆的最强风险基因。而最近的一项研究发现,ApoE对认知的影响,部分是由脑血管病理学介导的,在2 907个基因型个体中发现ApoE和ApoE附近的单核苷酸多态性对记忆和整体认知功能的影响可能部分由WML介导[27]。这一发现从侧面佐证了本研究的结论。
我们分析了不同程度WML和不同部位WML与AD痴呆之间的关系,结果显示,AD痴呆组与对照组的中、重度WML差异均有统计学意义,随着WML程度的加重,AD痴呆的发生率越高。这可能是因为髓鞘的完整性被破坏,弥漫性的脑白质脱髓鞘使其完整性遭到破坏,影响了正常的轴突传导,使神经通路功能受损。AD痴呆组患者对照组患者侧脑室旁和皮质下WML占比比较,差异亦均有统计学意义,且AD痴呆组患者侧脑室旁WML高于皮质下WML。然而,WML对认知功能损害的机制尚不完全清楚。白质束约占大脑总体积的一半,贯穿整个大脑,将皮质和皮质下灰质区域整合成功能性神经元群,从而支持人们的认知和情感功能[28]。淀粉样蛋白被认为是皮质损伤的主要原因,其次是tau蛋白的神经毒性[29]。有学者认为,皮质受损是AD发病机制中的下游事件,早期白质损伤会触发适应性反应,产生皮质淀粉样蛋白和tau的沉积,从而引发AD的发生[30]。此假说得到了Lee等[31]研究的支持,作者通过MR影像学研究发现,白质高信号是晚发性AD和显性遗传性AD早期的显著特征。然而,目前对AD的治疗研究并不理想,以脑淀粉样蛋白为靶点的治疗迄今都失败了。因此,在AD患者认知功能障碍发作之前就进行预防和干预就显得尤为重要。
AD早期并不容易被发现,但随着MRI技术的发展,学者们发现DTI作为一种新的、基于MRI的无创技术,可以用于描绘大脑白质的微结构变化[32]。DTI基于对水分子弥散运动成像,可以检测出白质纤维束的方向和完整性[33]。DTI技术中最常用的两个参数为ADC和FA。ADC被用来测量感兴趣区内水分子弥散运动的速度和范围,不具有方向性,反映出细胞膜的完整性。FA代表水分子扩散各向异性,具有方向性,FA值则反映水分子在各个方向运动的限制性。影响FA值的主要因素有髓鞘的完整性、白质纤维束的密度及排列一致性、纤维的平均直径等。FA值越低说明各向异性越差,白质纤维密度降低,排列一致性下降,白质纤维束损害的越严重。ADC值的升高表示自由水含量增高,细胞膜的完整性被破坏。WML的病理改变特征为髓鞘纤维的减少伴随细胞外间隙的增加。有研究表明,DTI与WML的严重程度有关,病变程度越重,FA值越低、ADC值越高,而且FA值的降低和ADC值的升高与认知功能损害之间具有相关性[34]。由此可见DTI可以为中枢神经系统白质的微观结构提供宏观的观察,其与衡量认知功能的改变具有更好的相关性[35]。本研究分析了两组间不同部位FA值与ADC值,发现AD患者额叶、顶叶和半卵圆区的FA值以及额叶和半卵圆区的ADC值与对照组存在差异。近年来,关于DTI对于认知功能评估的研究多集中于上述脑区域[36]。通过DTI技术观察脑小血管病变白质纤维束的损害,可以为认知功能损害提供影像学依据,有助于认知功能损害的早期判断与防治。
本研究的局限性:首先,未对WML影响AD痴呆患者的认知功能亚分层进行进一步研究,如近期记忆和远期记忆、计算力、语言表达能力和抽象思维等。其次,我们选择的研究对象为≥75岁的老年人,研究结果只能反映在这个年龄组WML与AD痴呆的关系。在以后的研究中,我们会纳入更多年龄段的老年人群进行研究。再次,不同程度WML对AD痴呆的影响未做观察,后续需要设计前瞻性研究加以探讨。
综上,WML与AD痴呆的发生密切相关。其中,中度和重度WML与AD痴呆发生具有明显相关性。我们研究的意义在于控制WML,以达到对AD痴呆的防治作用。所以及早发现和有效控制WML可能会对AD痴呆的防治产生积极作用。
所有作者均声明不存在利益冲突



























