
评估弥散峰度成像(DKI)对直肠腺癌尿苷二磷酸葡萄糖醛酸基转移酶1A1(UGT1A1)*28基因突变的预测价值。
回顾性研究。纳入山西省肿瘤医院2016年11月—2020年8月167例直肠腺癌患者的临床资料,其中男98例、女69例,年龄29~89岁、中位年龄为62岁。患者术前均行MR常规序列和DKI序列检查,将DKI图像导入Matlab软件并勾画感兴趣区,计算相应的平均弥散系数(MD)、平均峰度系数(MK)以及表观弥散系数(ADC)。依据患者UGT1A1*28基因多态性检测结果,将其分为野生型组和突变型组,采用独立样本t检验,比较2组患者MD、MK、ADC的差异。将差异有统计学意义的参数作为预测指标,采用受试者操作特征曲线(ROC曲线)以及DeLong检验分析,评价其对直肠腺癌UGT1A1*28基因突变状态的诊断效能。
在167例直肠腺癌患者中,UGT1A1*28野生型(TA6/6)130例(77.8%)、突变型37例,后者中杂合突变型(TA6/7)34例(20.4%)、纯合突变型(TA7/7)3例(1.8%)。野生型患者的ADC与MD值均高于突变型,而MK值低于突变型患者,差异均有统计学意义(P值均<0.01)。根据ROC曲线分析,MD、MK以及ADC值预测UGT1A1*28基因突变的AUC分别为0.747、0.836、0.723,对应的灵敏度和特异度分别是83.8%和57.7%、78.4%和81.5%、75.7%和65.4%。
DKI参数(MD、MK)以及ADC值均可用于直肠腺癌UGT1A1*28基因突变的预测。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是世界范围内肿瘤相关疾病的主要死亡原因之一[1],由于发现较晚,许多患者首诊时已经处于中晚期。伊立替康是结直肠癌等恶性疾病的主要化疗药物,其代谢产物7-乙基-10-羟喜树碱(SN-38)经常会引起消化道反应以及血液学毒性反应,导致化疗过程提前中止。尿苷二磷酸葡萄糖醛酸基转移酶1A1(uridine diphosphate glucuronosyltransferase 1A1,UGT1A1)作为伊立替康代谢产物降解的关键酶,其活性对药物不良反应有着重要影响[2]。研究显示,UGT1A1*28基因突变后影响着UGT1A1酶的活性和基因的表达[3],更容易发生粒细胞减少以及腹泻等严重不良反应。目前,对UGT1A1*28基因状态的评估主要依赖于病理检查,然而由于病理检测的局限性,并不能完全反应肿瘤的整体状态。而且,与有创的病理检查相比,开发一种新的无创的基因检测方法作为补充对指导患者的个体化化疗显得非常重要。弥散峰度成像(diffusion kurtosis imaging,DKI)能够在无创的条件下提供更多生物体微观结构的异质性信息和生物学信息,在直肠癌的临床诊断、肿瘤分化程度的评定、病理及免疫组织化学指标的评估、新辅助放化疗疗效的评价以及基因预测等方面都表现出良好的应用价值[4,5,6,7,8,9],但是,目前尚无DKI对UGT1A1*28基因突变诊断价值这方面的研究报道。因此,本研究的目的是探讨和评估DKI参数以及表观弥散系数(apparent diffusion coeffecient,ADC)对直肠腺癌UGT1A1*28基因突变的预测和诊断价值,以期为直肠腺癌患者临床个体化化疗方案的制定以及提高用药安全性提供依据。
纳入标准:(1)术后经病理检查确诊为直肠腺癌的患者;(2)术前行包括DKI功能成像在内的盆腔MR检查,且检查前未进行过新辅助治疗;(3)行UGT1A1*28基因多态性检测;(4)MR检查时间与手术时间、基因检测时间相差均不超过2周。排除标准:(1)DKI存在严重伪影;(2)MRI上肿瘤显示过小。
回顾性研究。纳入山西省肿瘤医院2016年11月—2020年8月167例直肠腺癌患者的临床资料,其中男98例、女69例,年龄29~89岁、中位年龄为62岁。本研究符合《赫尔辛基宣言》的要求。患者或家属对检查均知情同意。
使用荷兰Philips Achieva Healthcare 3.0 T MR系统。患者检查前均未行肠道准备,接收线圈选择8通道体部相控阵线圈。采用快速自旋回波进行盆腔T2WI压脂扫描,扫描参数:TR 3 000 ms,TE 80 ms,翻转角90°,扫描野18 cm × 18 cm,并行成像加速倍数为2,层厚3 mm。在MRI定位像上,基于肠壁肿物生长方向,分别进行矢状位、斜冠状位和斜轴位扫描,且覆盖肿瘤全部。DKI扫描是在Axial层面上使用单个自旋回波序列进行,具体参数:TR 4 000 ms,TE 80 ms,翻转角90°,并行成像加速倍数为2,层数128,层厚3 mm,无间距,扫描野25 cm × 25 cm。b值分别取0、700、1 400和2 100 s/mm2,并在X、Y、Z 3个正交方向上施加弥散敏感梯度场。DKI总成像时间为231 s。
应用Matlab软件(美国MathWorks公司)对DKI图像进行后处理,在b值为1 400 s/mm2的图像上,选择肿瘤截面最大的层面。参照常规T2WI图像,沿着肿瘤边缘勾出ROI,小心避开坏死及囊变区,计算DKI参数平均弥散系数(mean diffusivity,MD)、平均峰度系数(mean kurtosis,MK)以及ADC值,同时生成对应参数的伪彩图。参数ADC的计算使用了单指数模型。由2位工作5年以上的影像科医师在不知道UGT1A1*28基因检测结果的情况下独立完成,并取两者的平均值进行分析。
采集患者的静脉血,提取并纯化样本DNA。采用聚合酶链反应-连接酶检测反应方法进行基因扩增,上样于ABI Prism 377 DNA测序仪(美国Applied Biosystem公司)分析产物,具体操作方法参见文献[10]。
依据UGT1A1*28检测结果,将患者分为野生型组(TA6/6)与突变型组(TA6/7与TA7/7)。比较2组患者DKI参数MD、MK以及ADC值的差异。以差异有统计学意义的参数作为预测指标,采用ROC曲线比较患者的AUC、灵敏度以及特异度,评价参数MD、MK以及ADC在预测直肠腺癌UGT1A1*28基因突变时中的诊断效能。
应用SPSS 26.0统计软件进行数据分析。服从正态分布的计量资料用 ±s表示,组间比较使用独立样本t检验。采用R 4.0.2软件"genetics"包对样本的群体代表性进行哈-温平衡检验。应用MedCalc 20.0.3软件绘制ROC曲线分别对各参数的诊断效能进行评价。依据Youden指数确定DKI各参数以及ADC值的最佳截断点、灵敏度和特异度,并用DeLong检验比较其各自的AUC,以P < 0.05为差异有统计学意义。2名影像科医生测量结果的一致性分析采用ICC予以评估,以ICC >0.80为一致性较好。
±s表示,组间比较使用独立样本t检验。采用R 4.0.2软件"genetics"包对样本的群体代表性进行哈-温平衡检验。应用MedCalc 20.0.3软件绘制ROC曲线分别对各参数的诊断效能进行评价。依据Youden指数确定DKI各参数以及ADC值的最佳截断点、灵敏度和特异度,并用DeLong检验比较其各自的AUC,以P < 0.05为差异有统计学意义。2名影像科医生测量结果的一致性分析采用ICC予以评估,以ICC >0.80为一致性较好。
2名医师测量的MD、MK值和ADC值的ICC分别为0.91、0.95和0.91,两者的一致性较好。
依据UGT1A1*28基因检测结果,此次纳入的167例患者中,野生型(TA6/6)患者共有130例(77.8%),突变型患者共有37例,其中杂合突变型(TA6/7)34例(20.4%)、纯合突变型(TA7/7)3例(1.8%)。根据哈-温平衡检验结果,UGT1A1*28基因频率分布基本满足遗传平衡(P=0.714),说明此次研究样本具有一定的群体代表性。
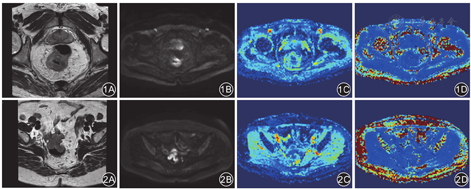
167例直肠腺癌患者中,野生型组(TA6/6)患者的ADC、MD值均明显高于突变型组患者(TA6/7与TA7/7),而MK值明显低于突变型组患者,差异有统计学意义(P值均< 0.01),见表1。典型病例见图1、图2。
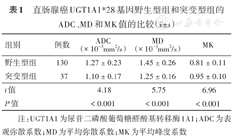
直肠腺癌UGT1A1*28基因野生型组和突变型组的ADC、MD和MK值的比较( ±s)
±s)
直肠腺癌UGT1A1*28基因野生型组和突变型组的ADC、MD和MK值的比较( ±s)
±s)
| 组别 | 例数 | ADC(× 10-3mm2/s) | MD(× 10-3mm2/s) | MK |
|---|---|---|---|---|
| 野生型组 | 130 | 1.27 ± 0.23 | 1.45 ± 0.26 | 0.81 ± 0.11 |
| 突变型组 | 37 | 1.10 ± 0.17 | 1.25 ± 0.16 | 0.95 ± 0.10 |
| t值 | 4.18 | 5.75 | 6.96 | |
| P值 | < 0.001 | < 0.001 | < 0.001 |
注:UGT1A1为尿苷二磷酸葡萄糖醛酸基转移酶1A1;ADC为表观弥散系数;MD为平均弥散系数;MK为平均峰度系数

ROC曲线分析显示,在预测直肠腺癌UGT1A1*28基因突变方面,MK值效能最佳,其AUC为0.836,明显高于MD与ADC,差异有统计学意义(Z=2.42、2.77,P=0.016、0.006),而MD和ADC预测效能相仿,差异无统计学意义(Z=0.83,P=0.406),其中MD值灵敏度最高(83.8%),MK值预测AUC和特异度较高。见表2、图3。
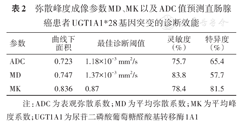
弥散峰度成像参数MD、MK以及ADC值预测直肠腺癌患者UGT1A1*28基因突变的诊断效能
弥散峰度成像参数MD、MK以及ADC值预测直肠腺癌患者UGT1A1*28基因突变的诊断效能
| 参数 | 曲线下面积 | 最佳诊断阈值 | 灵敏度(%) | 特异度(%) |
|---|---|---|---|---|
| ADC | 0.723 | 1.18×10-3 mm2/s | 75.7 | 65.4 |
| MD | 0.747 | 1.37×10-3 mm2/s | 83.8 | 57.7 |
| MK | 0.836 | 0.87 | 78.4 | 81.5 |
注:ADC为表观弥散系数;MD为平均弥散系数;MK为平均峰度系数;UGT1A1为尿苷二磷酸葡萄糖醛酸基转移酶1A1
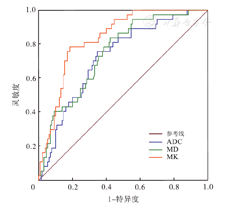

注:ADC为表观弥散系数;MD为平均弥散系数;MK为平均峰度系数
本次研究纳入的167例直肠腺癌患者中,UGT1A1*28基因型TA6/6、TA6/7以及TA7/7的患者所占比例分别为77.8%、20.4%、1.8%,等位基因突变频率为12%,低于白色人种的33.4%和非洲人种的40.4%[11],与学者们对亚洲人群的研究结果相近[12,13]。既往有研究发现,UGT1A1*28基因突变型患者相对于野生型患者,发生中性粒细胞减少和腹泻的风险性更高[14,15]。因此,进行基因检测就显得十分必要,而常规的基因检测手段存在着有创和肿瘤内基因异质性等缺点,因此采用一种无创性的影像学检查方法对UGT1A1*28基因突变进行预测就显得非常重要。近年来,DKI作为弥散加权成像以及弥散张量成像等功能成像技术的延伸,能够精准地反映组织细胞内微结构以及复杂程度,尤其在对脑胶质瘤、软组织肉瘤、大肠癌等肿瘤关键基因的分析当中,表现出良好的诊断价值[16,17,18,19]。
在本研究中,我们发现野生组患者的DKI定量参数MK明显小于突变型患者(P < 0.01)。MK作为DKI模型的定量参数,能够精确地反映出组织微环境的不均匀性和复杂性[17],笔者分析在UGT1A1*28突变组中,肿瘤组织微结构的复杂性(如肿瘤组织的间质成分、瘤细胞数量和膜结构的复杂性)可能与UGT2A1*28野生组存在差异。以往研究显示,MD、ADC值与肿瘤细胞的密集程度呈负相关,野生型组患者的MD值及ADC值均高于突变型组(P < 0.01)[20]。因此,UGT1A1作为组织细胞的保护性因素,突变之后会导致有害物质的聚集而引起肿瘤细胞的恶性增殖[21],使肿瘤组织中肿瘤细胞的排列更紧密,导致水分子产生相应程度的弥散受限。
我们在研究中发现,DKI定量参数MD、MK以及ADC值对UGT1A1*28基因突变的判断中表现出中等程度的预测价值,其中MK较MD、ADC值有更高的AUC(0.836),在预测基因突变方面有着更大的预测效能,其对应的特异度为81.5%,而MD值则有更高的灵敏度(83.8%)。分析原因如下:MK作为DKI序列最关键的参数,MK值的增加可能与突变型患者肿瘤组织中细胞数量增加、腺体所占比例升高、异形细胞成分增加等原因有关,表现为更高的弥散峰度[18],这与组织结构复杂的特点相适应。在预测基因突变方面,MK值明显优于MD,与Xu等[16]的研究结果类似。同时,本研究结果显示,在预测UGT1A1*28基因突变方面,MD值的诊断能力与ADC相比并无明显优势。笔者推测,出现这种结果可能由ADC的计算方法不同所致,本研究中ADC值所采用的是单指数模型,可能会受到毛细血管灌注、细胞数量增多等因素的影响,这个结果与部分学者的研究一致[18,22]。
综上所述,DKI参数MD、MK与ADC在预测直肠腺癌UGT1A1*28基因突变时均表现出一定价值,这些参数能够在一定程度上反映肿瘤组织的微观特性,有望成为直肠腺癌潜在的影像学标记物,并为指导伊利替康的用药提供一定的参考。本研究也存在着不足:(1)样本纳入存在一定的偏倚。UGT1A1*28基因频率分布在不同人种之间有着较大差异,本组均为国内人群,基因突变频率明显低于白种人和非洲人[11];本研究为回顾性研究,部分接受过新辅助治疗的患者未被纳入。(2)人工勾画ROI可能会对结果造成影响。(3)未对UGT1A1*6基因多态性进行探讨。在今后的研究中,我们将会联合多个MR功能成像序列对UGT1A1*28、UGT1A1*6的2个基因位点进行深入的探讨。
所有作者声明不存在利益冲突



























