
探讨腹腔镜辅助经肛全直肠系膜切除术(Lap-TaTME)在低位直肠癌保肛根治手术中的安全性、近期临床疗效。
回顾性队列研究。纳入2019年4月—2020年8月蚌埠医学院第一附属医院胃肠外科85例行低位直肠癌根治术患者的临床资料,其中男52例、女33例,年龄40~74岁。患者按照手术方式不同分为Lap-TaTME组31例和腹腔镜辅助全直肠系膜切除术组(Lap-TME组)54例。观察指标:比较2组患者的基线资料、围手术期指标、病理学指标、保肛率及手术中转率、术后30 d内并发症发生率、术后肛门功能Wexner评分以及术后复发、转移情况。
(1)基线资料比较:2组患者的性别、年龄、体质量指数、糖尿病史、高血压病史、吸烟史、肿瘤分期等差异均无统计学意义(P值均>0.05)。(2)围手术期指标:Lap-TaTME组的手术时间长于Lap-TME组,术后住院时间和首次排气时间均短于Lap-TME组,差异均有统计学意义(t=2.19、3.26、4.43,P值均<0.05);2组患者术中出血量、预防性造口差异均无统计学意义(P值均>0.05)。(3)病理学指标:2组患者的肿瘤直径、下切缘距肛缘的距离、清扫淋巴结数目、肿瘤下切缘阳性、环周切缘阳性、分化程度比较差异均无统计学意义(P值均>0.05);(4)2组患者保肛率、手术中转率差异均无统计学意义(P值均>0.05)。(5)术后30 d内并发症发生率Lap-TaTME组为12.90%(4/31),Lap-TME组为11.11%(6/54),差异无统计学意义(χ2=7.92,P=0.244)。(6)肛门功能Wexner评分:术前1周和术后12个月的肛门功能Wexner评分,2组差异均无统计学意义(P值均>0.05);术后3个月、6个月时Lap-TaTME组均优于Lap-TME组,分别为(8.6±2.1)与(10.0±2.1)分、(6.4±1.4)与(7.8±1.9)分,差异均有统计学意义(t=2.77,P=0.007;t=3.55,P<0.001)。(7)复发、转移情况:患者均获随访12~16个月,期间Lap-TME组1例局部复发,无远处转移,Lap-TaTME组均未发生局部复发及转移。
Lap-TaTME在低位直肠癌保肛根治术中安全可行,患者术后恢复快,短期临床疗效明确。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
直肠癌是消化系统常见的实体肿瘤之一,其中以距肛管齿状线5 cm以内的低位直肠癌居多,占70%以上[1,2]。直肠癌一经诊断,手术是目前患者有望获得根治的唯一方法。然而,肿瘤距离肛门的位置是决定能否行保肛根治术的重要因素之一,即便是1 cm的距离差距都可能影响患者是否能保留肛门[3,4]。近年来,由于生活方式和饮食习惯的改变、环境污染等因素的影响,我国直肠癌的发病年龄呈现年轻化趋势,年轻患者对于保留肛门的心理和社会需求更为强烈[5,6],提高低位直肠癌的保肛率已然成为结直肠外科亟待攻克的难题。基于腹腔镜技术及微创理念发展而来的经肛全直肠系膜切除术(transanal total mesorectal excision,TaTME)为低位直肠癌患者实现保肛带来了新的希望[7,8],但部分学者对TaTME术式的安全性及临床疗效存在争论[9,10]。本研究通过分析85例低位直肠癌保肛根治术患者的临床资料,探讨腹腔镜辅助TaTME(laparoscopy assisted transanal total mesorectal excision,Lap-TaTME)术式的安全性及近期临床疗效,为提高低位直肠癌根治术患者的保肛率提供参考。
纳入标准:(1)组织病理学明确诊断直肠癌;(2)年龄18~80岁;(3)依据盆腔平扫、增强MRI,测量患者肿瘤下缘距离肛缘≤5 cm;(4)肿瘤能达到根治性手术切除。排除标准:(1)合并其他组织起源的恶性肿瘤;(2)合并肠梗阻等急诊手术的患者;(3)术前控便能力差等;(4)合并精神性疾病;(5)临床资料缺失。
回顾性队列研究。纳入2019年4月—2020年8月蚌埠医学院第一附属医院85例手术治疗的低位直肠癌患者。其中男52例、女33例,年龄40~74岁。患者按手术方式不同分为2组,行腹腔镜辅助全直肠系膜切除术(laparoscopy assisted total mesorectal excision,Lap-TME)54例为Lap-TME组,含术中冷冻快速病理学检测肿瘤下切缘为阳性,改为腹腔镜辅助腹会阴联合直肠癌根治术者;行Lap-TaTME的患者31例为Lap-TaTME组。手术操作均由同一团队完成。术前肿瘤分期为Ⅲ期的患者,术前均予新辅助化疗(采用奥沙利铂+亚叶酸钙+氟尿嘧啶化疗方案)。
本研究符合《赫尔辛基宣言》的要求。患者及其亲属均签署知情同意书。
采用常规腹腔镜辅助TME手术5孔法操作。离断肠系膜下动脉或直肠上动脉,解剖游离乙状结肠及直肠系膜。腹腔镜下按照TME的操作原则,游离直肠系膜至肛提肌裂孔位置;直肠指检法或电子结肠镜法定位下切缘;腔内闭合直肠,下腹部正中做一长约5 cm切口。取出标本,置入吻合器钉钻,由肛门插入直径相当的管型吻合器,与钉钻连接并收紧,完成肠管的端端吻合。
手术过程分为经腹操作和经肛门操作。(1)经腹操作:采用常规腹腔镜辅助TME手术5孔法,步骤同Lap-TME操作。游离直肠系膜至骶岬水平,直肠前方游离至腹膜反折;游离后直肠周围放置纱布条,便于吸收周围渗液。(2)经肛门操作:①会阴消毒,碘伏冲洗肠腔,充分扩肛后置入改良渐进式肛门单孔装置,建立操作平台和手术器械。②距肿瘤下缘的预定切缘近侧荷包缝合,关闭肠腔,以隔离肿瘤,建立直肠腔内的操作空间。③在荷包缝合的远端环形切开直肠壁全层,进入盆底。④循盆筋膜脏层与壁层间的神圣平面自下向上游离直肠系膜,随着手术层面切开并顺时针方向旋转改良肛门单孔装置,进一步暴露操作空间,直到与腹部操作平面会合,完成全直肠系膜的切除。肿瘤移除及消化道重建:充分扩肛后,经肛门拖出肿瘤,离断近端的乙状结肠并移除肿瘤。若使用圆形吻合器完成消化道重建,则将钉钻置入乙状结肠断端并完成荷包缝合,将钉砧经肛门还纳入盆腔。⑤经肛行肠壁全层荷包缝合,关闭直肠残端。⑥经肛置入圆形吻合器的中心杆部分,与钉砧部分连接,在腹腔镜辅助下完成肠管的端端吻合(图1)。对于超低位及部分低位直肠癌患者,可在直视下完成结肠-直肠或结肠-肛管的手工吻合。腹腔镜下冲冼并放置盆腔引流管。视患者肛门功能以及吻合口的安全性,选择是否行回肠造口。
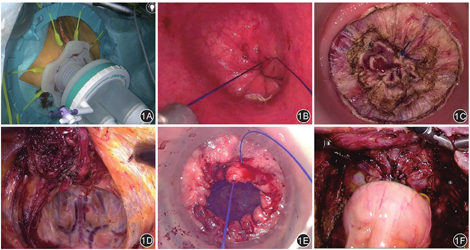

患者术后采用门诊复查、电话等多种途径进行随访,随访至2021年8月,随访内容主要包括肿瘤是否复发、肛门控便能力等。观察指标:(1)比较2组患者的基线资料;(2)比较术中出血量、手术时间、有无预防性造口、首次排气时间、术后住院时间等围手术期指标;(3)比较肿瘤直径(为术后病理学的测量结果)、肿瘤下切缘距肛缘的距离、清扫淋巴结数目、肿瘤下切缘阳性、环周切缘阳性、分化程度等病理学资料;(4)观察术后30 d内吻合口漏、吻合口出血等并发症发生情况;(5)比较患者保肛率、手术中转率;(6)比较2组患者术前及术后3、6、12个月的肛门功能Wexner评分[11];(7)比较2组患者术后复发转移情况。
应用SPSS 23.0软件进行数据统计分析。服从正态分布的计量资料以 ±s表示,组间比较采用t检验;分类资料比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;分类资料比较采用χ2检验或Fisher确切概率法。以P<0.05为差异有统计学意义。
Lap-TaTME组和Lap-TME组患者的性别、年龄、BMI、糖尿病、高血压、吸烟史、肿瘤分期等基线资料差异均无统计学意义(P值均>0.05)。见表1。
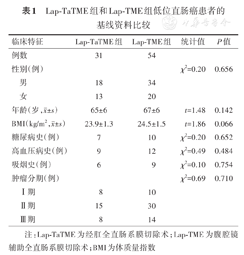
Lap-TaTME组和Lap-TME组低位直肠癌患者的基线资料比较
Lap-TaTME组和Lap-TME组低位直肠癌患者的基线资料比较
| 临床特征 | Lap-TaTME组 | Lap-TME组 | 统计值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 31 | 54 | |||
| 性别(例) | χ2=0.20 | 0.656 | |||
| 男 | 18 | 34 | |||
| 女 | 13 | 20 | |||
年龄(岁, ±s) ±s) | 65±6 | 67±6 | t=1.48 | 0.142 | |
BMI(kg/m2, ±s) ±s) | 23.9±1.3 | 24.5±1.5 | t=1.86 | 0.066 | |
| 糖尿病史(例) | 7 | 10 | χ2=0.20 | 0.652 | |
| 高血压病史(例) | 9 | 12 | χ2=0.49 | 0.484 | |
| 吸烟史(例) | 6 | 9 | χ2=0.10 | 0.754 | |
| 肿瘤分期(例) | χ2=0.69 | 0.710 | |||
| Ⅰ期 | 8 | 10 | |||
| Ⅱ期 | 15 | 30 | |||
| Ⅲ期 | 8 | 14 | |||
注:Lap-TaTME为经肛全直肠系膜切除术;Lap-TME为腹腔镜辅助全直肠系膜切除术;BMI为体质量指数
Lap-TaTME组和Lap-TME组患者在术中出血量、预防性造口差异均无统计学意义(P值均>0.05);而Lap-TaTME组手术时间稍长于Lap-TME组,在术后住院时间和首次排气时间均显著少于Lap-TME组,差异均有统计学意义(P值均<0.05)。见表2。
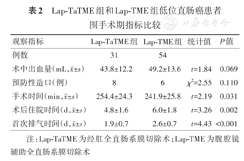
Lap-TaTME组和Lap-TME组低位直肠癌患者围手术期指标比较
Lap-TaTME组和Lap-TME组低位直肠癌患者围手术期指标比较
| 观察指标 | Lap-TaTME组 | Lap-TME组 | 统计值 | P值 |
|---|---|---|---|---|
| 例数 | 31 | 54 | ||
术中出血量(mL, ±s) ±s) | 43.8±12.2 | 49.2±13.6 | t=1.84 | 0.069 |
| 预防性造口(例) | 8 | 6 | χ2=2.55 | 0.110 |
手术时间(min, ±s) ±s) | 254.4±24.3 | 241.9±25.8 | t=2.19 | 0.031 |
术后住院时间(d, ±s) ±s) | 4.8±1.6 | 6.0±1.8 | t=3.26 | 0.002 |
首次排气时间(d, ±s) ±s) | 1.9±0.7 | 2.6±0.7 | t=4.43 | <0.001 |
注:Lap-TaTME为经肛全直肠系膜切除术;Lap-TME为腹腔镜辅助全直肠系膜切除术
Lap-TaTME组和Lap-TME组患者的肿瘤直径、下切缘距肛缘的距离、清扫淋巴结数目、肿瘤下切缘阳性、环周切缘阳性、分化程度等指标差异均无统计学意义(P值均>0.05)。见表3。
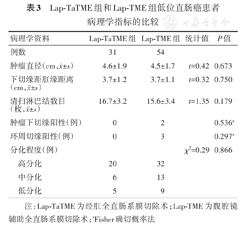
Lap-TaTME组和Lap-TME组低位直肠癌患者病理学指标的比较
Lap-TaTME组和Lap-TME组低位直肠癌患者病理学指标的比较
| 病理学资料 | Lap-TaTME组 | Lap-TME组 | 统计值 | P值 | |
|---|---|---|---|---|---|
| 例数 | 31 | 54 | |||
肿瘤直径(cm, ±s) ±s) | 4.6±1.9 | 4.5±1.7 | t=0.42 | 0.673 | |
下切缘距肛缘距离(cm, ±s) ±s) | 3.7±1.2 | 3.7±1.1 | t=0.32 | 0.750 | |
清扫淋巴结数目(枚, ±s) ±s) | 16.7±3.2 | 15.6±3.4 | t=1.35 | 0.179 | |
| 肿瘤下切缘阳性(例) | 0 | 2 | 0.536a | ||
| 环周切缘阳性(例) | 0 | 3 | 0.297a | ||
| 分化程度(例) | χ2=0.29 | 0.866 | |||
| 高分化 | 20 | 32 | |||
| 中分化 | 6 | 13 | |||
| 低分化 | 5 | 9 | |||
注:Lap-TaTME为经肛全直肠系膜切除术;Lap-TME为腹腔镜辅助全直肠系膜切除术;aFisher确切概率法
术后30 d内,Lap-TaTME组发生2例尿潴留、1例肠梗阻、1例腹腔脓肿,并发症发生率为12.90%(4/31);Lap-TME组发生2例吻合口漏、1例吻合口出血、1例吻合口狭窄、1例肠梗阻、1例伤口感染,并发症发生率为11.11%(6/54)。两组并发症发生率差异无统计学意义(χ2=7.92,P=0.244)。
Lap-TME组有2例患者因肿瘤下切缘阳性中转手术方式为腹腔镜辅助腹会阴联合直肠癌根治术者,而未能保留肛门,保肛率96.3%(52/54)、中转率为3.7%(2/54);Lap-TaTME组患者无一例中转手术方式,均成功的保留肛门。2组患者保肛率、中转率差异均无统计学意义(P值均=0.531)。
2组患者术前的肛门功能Wexner评分差异无统计学意义(P=0.637);术后3个月、6个月Wexner评分Lap-TaTME组均优于Lap-TME组,差异均有统计学意义(P值均<0.01),术后12个月Wexner评分比较差异无统计学意义(P=0.397)。见表4。
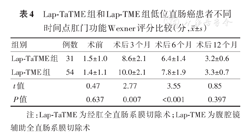
Lap-TaTME组和Lap-TME组低位直肠癌患者不同时间点肛门功能Wexner评分比较(分, ±s)
±s)
Lap-TaTME组和Lap-TME组低位直肠癌患者不同时间点肛门功能Wexner评分比较(分, ±s)
±s)
| 组别 | 例数 | 术前 | 术后3个月 | 术后6个月术 | 后12个月 |
|---|---|---|---|---|---|
| Lap-TaTME组 | 31 | 1.5±1.0 | 8.6±2.1 | 6.4±1.4 | 3.2±0.6 |
| Lap-TME组 | 54 | 1.4±1.1 | 10.0±2.1 | 7.8±1.9 | 3.3±0.7 |
| t值 | 0.47 | 2.77 | 3.55 | 0.85 | |
| P值 | 0.637 | 0.007 | <0.001 | 0.397 |
注:Lap-TaTME为经肛全直肠系膜切除术;Lap-TME为腹腔镜辅助全直肠系膜切除术
患者均获12~16个月的随访,中位随访时间13个月。随访期间,Lap-TaTME组无局部复发,无远处转移;Lap-TME组发生1例局部复发,无远处转移。
随着微创外科的理念深入人心以及腹腔镜技术的不断普及,腹腔镜辅助直肠癌根治术受到更多患者和医生的青睐[8],在此基础上发展起来的TME术式已然成为结直肠外科公认的标准直肠癌根治术式[12,13]。传统Lap-TME直肠癌根治术主要操作途径经腹腔游离至盆腔、直肠,但对于骨盆相对狭窄的男性、肥胖、前列腺肥大及低位巨大肿瘤患者而言,其术野暴露和操作均较为困难[8,14]。此外,根治和保肛是低位直肠癌外科治疗中的主要矛盾。Lap-TaTME作为一种全新的外科手术术式,能够有效解决低位直肠癌的游离困难以及根治与保肛的矛盾。
本研究的结果显示,Lap-TaTME组患者的术后住院时间、首次排气时间等指标均优于Lap-TME组,且差异有统计学意义。这可能由于Lap-TaTME切除的肿瘤组织经自然腔道取出,避免做腹部切口,减少腹部的创伤和疼痛,加速了恢复。2组患者的病理学指标(肿瘤直径、下切缘距肛缘的距离、清扫淋巴结数目、肿瘤下切缘阳性、环周切缘阳性、分化程度)比较差异亦无统计学意义,说明Lap-TaTME术式和Lap-TME术式在低位直肠癌保肛根治术中能获得同样的肿瘤学安全性[14]。术后30 d内并发症发生率比较显示,Lap-TaTME组与Lap-TME组差异无统计学意义,分别为12.90%(4/31)和11.11%(6/54),与学者罗双灵等[15]的研究结果一致,进而说明Lap-TaTME治疗低位直肠癌安全可行。国内最新研究显示:TaTME术后并发症主要与吻合口相关,而早期吻合口漏在国内发生率为7.0%~7.6%,未行预防性造口及未使用吻合器是早期吻合口漏的独立危险因素[16,17];国外一项基于1 594例TaTME的数据统计显示,总吻合口漏发生率为9.8%,其发生的高危因素为肥胖、吸烟、糖尿病等[18]。本研究中Lap-TaTME组未发生吻合口漏,结合本中心的临床经验,笔者认为,吻合口漏可能与直肠残端的尾侧间隙游离不够有关,而并不是术式的局限性。
本研究结果中,Lap-TME组中有2例患者因肿瘤下切缘阳性中转手术方式,未能保留住肛门,Lap-TaTME组患者均成功保留肛门,但2种术式患者的保肛率、手术中转率差异均无统计学意义。Lap-TaTME保肛的优点在于先在肿瘤下切缘1~2 cm进行荷包缝合,得以保证肿瘤下切缘的阴性,再由下向上进行游离,使得低位直肠癌患者有机会保留肛门;本研究中2组患者的保肛率无统计学意义,可能与本中心样本量少有关。另外,本研究结果还显示,Lap-TaTME组患者在术后3个月、6个月的肛门Wexner评分明显低于Lap-TME组,提示Lap-TaTME在早期肛门功能恢复优于Lap-TME,与磨鹏诗等[19]的报道一致。笔者分析,这可能与Lap-TaTME术中对盆丛神经及括约肌神经损伤较少有关;而2组患者在术后12个月的Wexner评分差异无统计学意义,可能与术后肛门功能逐渐训练恢复有关。Lap-TME组发生1例患者局部复发且无远处转移,Lap-TaTME组均未发现局部复发及远处转移,进一步显示Lap-TaTME在低位直肠癌保肛根治术是安全的。
笔者总结了本团队在行Lap-TaTME术式中的经验:(1)经肛操作中,荷包缝合要精准结扎。若未结扎好,手术过程中可能造成种植转移,而增加局部复发风险;同时操作空间的密闭性降低,不利于直肠系膜的游离。(2)经腹部操作中,若向下游离直肠系膜时遇到困难,可以尝试经肛部分多向上延展。
综上,与传统Lap-TME术式相比,Lap-TaTME低位直肠癌保肛根治术安全、可行,短期临床疗效确定。本研究的不足之处:(1)缺乏远期临床疗效的结果;(2)研究样本数量少且为单中心研究,可能出现结果偏倚等问题。
所有作者声明不存在利益冲突































