
总结小儿左冠状动脉异常起源于肺动脉(ALCAPA)的外科矫治方法及效果。
回顾性研究。纳入2015年2月—2020年10月泰达国际心血管病医院9例接受外科手术治疗的小儿ALCAPA患者的临床资料。男2例、女7例,年龄0.2~12.3岁(中位年龄1.7岁),体质量5.7~44.3 kg(中位体质量11.6 kg)。患者采取个体化手术策略(肺动脉内隧道技术、主动脉壁和带蒂肺动脉壁缝合、带蒂直接移载、左主干开口成形术)恢复双源冠状动脉供血,其中4例同期行二尖瓣成形术。观察指标:监测患儿左心室射血分数(LVEF)和二尖瓣反流程度,并比较其在术前、术后早期、末次随访时的变化。
全组患儿均手术顺利,无死亡。2例重症婴儿术后延迟关胸6 d和9 d。9例患儿出院后获随访1个月~4.5年,均未出现心绞痛或心力衰竭症状。患儿术后早期与术前LVEF分别为62.1%(39.0%,63.5%)和59.0%(40.0%,64.5%),差异无统计学意义(Z=14.00,P=1.000);末次随访LVEF为64.0%(60.5%,67.5%),较术后早期改善,差异有统计学意义(Z=26.50,P=0.034)。术后早期二尖瓣反流与术前、末次随访比较,差异均无统计学意义(Z=1.13、1.41,P=0.257、0.157)。
对于小儿ALCAPA采用个性化外科矫治手术可以获得满意的近中期效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
左冠状动脉异常起源于肺动脉(anomalous origin of the left coronary artery from the pulmonary artery,ALCAPA)是一种罕见的先天性心脏畸形,与活产儿比例约为1∶300 000,占所有先天性心脏病的0.25%~0.5%[1]。1933年,Edward Bland、Paul Dudley White和Joseph Garland最先描述了这种疾病,所以ALCAPA又被称为“Bland-White-Garland综合征”。ALCAPA主要特征是左心室的心肌缺血导致左心功能不全,临床上常因“不明原因”的左心室扩大和心力衰竭而进一步检查确诊。根据ALCAPA不同时期的表现和潜在的病理生理特征,分为婴儿型和成人型。新生儿期常无症状,生后的肺动脉高压维持了左冠状动脉(left coronary artery,LCA)的正向血流,左心室缺血不明显;6~8周后,随着肺动脉压力下降,LCA血流呈逆向“窃血”改变,心肌缺血进行性加重,出现左心室扩大,患儿可有一系列心力衰竭症状,85%~90%的患儿在1岁以前死亡,10%~15%的患儿由于有效的左右冠状动脉侧支形成而使左心室供血得到代偿,这部分患儿症状常不明显并可存活至成年。然而,这些患儿成年后仍面临心律失常、胸痛、心力衰竭及猝死的结局[2]。ALCAPA一经诊断即须手术治疗,手术时间窗多在婴幼儿期,术式多样,选择手术方法需考虑冠状动脉起源位置和患者的年龄等因素。症状出现早的婴儿左心功能受累常比较严重,围手术期处理具有一定挑战性,术后心脏功能恢复需要较长时间[3, 4]。ALCAPA常合并不同程度二尖瓣反流,对其处理方法的选择也存在一定的争论[5]。本研究回顾分析了一组小儿ALCAPA病例的术前诊断、手术方法、围术期处理及随访结果,探讨并总结小儿ALCAPA的外科矫治方法及效果。
纳入标准:年龄≤14岁接受外科手术治疗的ALCAPA患儿,合并或不合并其他心脏畸形。排除标准:随访资料缺失患儿。
回顾性研究。纳入2015年2月—2020年10月天津市泰达国际心血管病医院心外科9例ALCAPA手术治疗患儿的临床资料。其中男2例、女7例,年龄0.2~12.3岁(中位年龄1.7岁),体质量5.7~44.3 kg(中位体质量11.6 kg)。1例患儿因术前未发现ALCAPA,仅行心脏彩超、胸部X线片和心电图等常规检查;余8例患儿均接受CTA检查。2例患儿术前左心室射血分数(left ventricular ejection fraction,LVEF)<40%,其中1例合并LCA开口狭窄;1例合并房间隔缺损及动脉导管未闭,余8例为单纯性ALCAPA。见表1。术前二尖瓣反流7例,其中重度1例、中度4例、轻度2例;无反流2例。

9例左冠状动脉异常起源于肺动脉患儿的临床资料
9例左冠状动脉异常起源于肺动脉患儿的临床资料
| 病例 | 年龄(岁) | 性别 | 体质量(kg) | 左冠动脉开口 | 术式 | 二尖瓣成形 | 其他畸形 | 延迟关胸 | 随访时间(个月) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 1.3 | 女 | 7.8 | 左中后 | Translocation | 瓣环环缩 | 54 | ||
| 2 | 0.2 | 女 | 5.9 | 左侧后 | Flap-to-flap | 术后6 d | 21 | ||
| 3 | 11.0 | 男 | 44.3 | 左侧后 | Flap-to-flap | 33 | |||
| 4 | 4.2 | 男 | 18.5 | 左侧后 | Ostioplasty | 瓣环环缩 | 28 | ||
| 5 | 12.3 | 女 | 42.1 | 右侧后 | Takeuchi | 人工腱索+瓣环环缩 | 23 | ||
| 6 | 1.7 | 女 | 9.2 | 右侧后 | Translocation | 瓣环环缩 | 11 | ||
| 7 | 0.5 | 女 | 5.7 | 左侧后 | Flap-to-flap | 术后9 d | 5 | ||
| 8 | 3.8 | 女 | 11.9 | 左侧后 | Takeuchi | ASD、PDA | 3 | ||
| 9 | 1.5 | 女 | 11.6 | 左侧后 | Flap-to-flap | 1 |
注:Translocation为带蒂直接移栽技术;Flap‐to‐flap为主动脉壁和带蒂肺动脉壁缝合技术;Ostioplasty为冠状动脉开口成形技术;Takeuchi为肺动脉内隧道技术;ASD为房间隔缺损;PDA为动脉导管未闭
本研究符合《赫尔辛基宣言》要求,患儿家属均充分了解病情并签署知情同意书。
术前不吸氧,对心功能较差的重症患儿的前负荷进行精准管理,诊断后即接受手术治疗。手术在全身麻醉、气管插管、低温体外循环下进行,常规放置食管超声。正中开胸,升主动脉和上下腔静脉插管,升主动脉插管位置尽量靠上,紧邻头臂干开口。需要心内操作者经右心房-房间隔置心内吸引,单纯ALCAPA经右上肺静脉置心内吸引。直肠温度维持在28~32 ℃。体外循环开始后,血管钳阻断主肺动脉远端或分别阻断左右肺动脉以防止冠状动脉窃血加重,升主动脉阻断后以Del Nido停跳液根部灌注进行心肌保护,维持量通过左右冠状动脉口直接灌注及冠状静脉窦逆行灌注作为补充。
根据患儿年龄和LCA在肺动脉内开口的位置等因素选择个体化的手术方法,包括肺动脉内隧道技术(Takeuchi技术)、主动脉壁和带蒂肺动脉壁缝合(Flap-to-flap技术)、带蒂直接移栽(Tanslocation技术)、左主干开口成形术(Ostioplasty技术)。见表1。
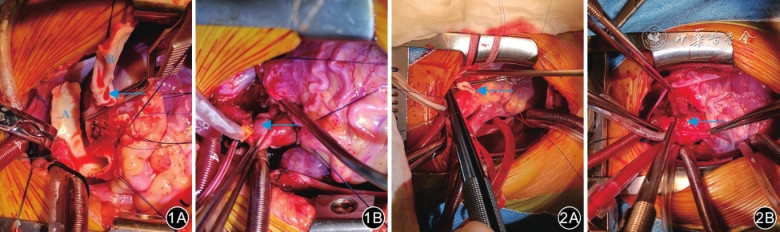
其中,Flap‐to‐flap技术使用最多,具体操作方法如下:在升主动脉前壁窦管交界上2~3 mm做右向左翻的矩形血管片,宽6~8 mm,根据LCA开口位置至主动脉的距离裁定血管片右侧缘位置。带LCA蒂完整剪下其所在的肺动脉窦以及上至肺动脉分叉的主肺动脉壁。以上材料以6-0或7-0聚丙烯线缝合,形成以LCA开口为顶点的圆锥形“新左主干”。以自体心包或牛心包片修补主动脉和主肺动脉剩余的缺损。注意避免冠状动脉的牵拉成角以及重建的主肺动脉对“新左主干”的压迫。
针对左心功能差的重症患儿:术前严密监测生命体征,控制出入量,给予强心利尿支持治疗,慎吸氧;麻醉诱导期注意前负荷及吸入氧浓度的改变对循环的影响,延迟关胸和机械辅助作为体外循环后严重心功能不全的后备措施。术后须对左心功能不全患儿进行针对性治疗。
术后通过门诊和网络随访。患儿术后1年内定期复查心脏超声、胸部X线片及心电图,1年以后无特殊情况每隔1年随访1次。对于近期出院的入组患儿,根据研究需要进行了早期追踪复查,除综合评估患者一般情况外,还评估术后左心室功能恢复情况:重点监测LVEF和二尖瓣反流程度[3],比较患儿术后早期(出院前)及末次随访时LVEF、二尖瓣反流较术前的改善情况。LVEF和二尖瓣反流均通过心脏超声获取。LVEF是左心室收缩功能的量化指标,正常值50%~70%,低于正常下限,说明存在不同程度的左心室收缩功能不全。二尖瓣反流可继发于左心室扩大和功能不全,分为4个等级:0级,无反流;1级,少量反流;2级,中量反流;3级,大量反流。
应用SPSS 17.0统计学软件进行数据分析。偏态分布的计量资料以M(Q1,Q3)表示,采用Wilcoxon检验。手术前后等级资料比较采用Wilcoxon符号秩检验。以P<0.05为差异有统计学意义。
9例患儿中,采用Takeuchi技术2例、Flap-to-flap技术4例(图1)、Translocation技术2例(图2)、Ostioplasty技术1例。1例二尖瓣前叶脱垂并大量反流的患儿行人工腱索植入+瓣环成形术;2例中量反流和1例少量反流的患儿行瓣环成形术;2例中量、1例少量及2例无反流患儿未处理二尖瓣。全组病例无死亡,术后未使用机械辅助循环。2例患儿(病例2、7)术后分别延迟6 d、9 d关胸。1例婴儿(病例7)在麻醉诱导期间出现了急性循环障碍而施行紧急开胸体外循环。9例患儿术后6~32 d出院,出院后获随访1.4年(1个月~4.5年)。所有患儿未出现心绞痛或心力衰竭症状。见表1。

术后早期心功能评估中,3例术前LVEF低的心力衰竭患儿(病例2、6和7)术后LVEF仍处于低水平,余6例术前心功能基本正常患儿术后LVEF均维持正常水平。末次随访,8例患儿LVEF正常,1例(病例7)术后5个月(心功能恢复期)LVEF为45%;3例术前心力衰竭患儿(病例2、6和7)的LVEF均进一步改善。
9例患儿的LVEF术后早期为62.1%(39.0%,63.5%),与术前59.0%(40.0%,64.5%)比较差异无统计学意义(Z=14.00,P=1.000),与末次随访64.0%(60.5%,67.5%)比较,差异有统计学意义(Z=26.50,P=0.034)。
术后早期二尖瓣反流中量3例、少量3例、无反流3例,较术前改善;末次随访二尖瓣反流有进一步好转,少量6例、无反流3例。术前与术后早期、末次随访比较,差异均无统计学意义(Z=1.13、1.41,P=0.257、0.157),见表2。
9例左冠状动脉异常起源于肺动脉患儿手术前及术后不同时间二尖瓣反流程度比较(例)
9例左冠状动脉异常起源于肺动脉患儿手术前及术后不同时间二尖瓣反流程度比较(例)
| 观察时间 | 0级 | 1级 | 2级 | 3级 |
|---|---|---|---|---|
| 术前 | 2 | 2 | 4 | 1 |
| 术后早期 | 3 | 3 | 3 | 0 |
| 末次随访 | 3 | 6 | 0 | 0 |
ALCAPA是一种罕见的先天性心脏畸形,在我院同期手术的3 671例先心病手术患者中,ALCAPA占0.25%(9/3 671),与文献报道相符[1]。由于其自然预后较差,我们均采取了一经确诊即积极手术治疗的策略。
ALCAPA的手术治疗方法较多。早期的术式采用单纯结扎LCA阻断冠状动脉窃血,但因手术死亡率高和远期效果不良已被弃用。目前公认的手术原则是重新建立双冠状动脉供血,常用的方法包括Takeuchi、Translocation、Flap-to-flap、肺动脉壁管道法等。Takeuchi是一种安全简便的方法,但可能导致肺动脉瓣上狭窄,更适合年龄较大的儿童和成人[6]。Translocation技术局限于左冠状动脉开口靠近主动脉一侧者,开口位置偏肺动脉左侧则可因冠状动脉的张力过高影响左心血供。
本组9例患儿中,4例采用了我们最常使用的Flap-to-flap技术。此技术被用于LCA开口远离主动脉而不能使用Translocation技术的患者[7]。与Takeuchi技术不同的是,新建冠状动脉在肺动脉主干外,一定程度上减少了对肺动脉瓣的影响[8]。相对单纯用肺动脉壁材料的重建法[9],Flap-to-flap技术纳入的血管壁材料更多,术者可以更自如地构建管道的形状,形成近端直径更大的“新左主干”,减少血栓形成的风险。值得注意的是,文献对Flap-to-flap技术的描述多以主动脉片作为后壁,肺动脉片作为前壁的管道[10, 11]。我们在实际操作中发现:LCA开口多在窦管交界的肺动脉窦内,带蒂的肺动脉片呈局部凸起的不规则形态,主动脉血管片水平较肺动脉偏上。以上原因使得主肺动脉片前后拼接规整难以实现。在实践中,我们倾向将两者缝合形成以LCA开口为顶点、向主动脉方向直径逐渐增宽的长圆锥形“新左主干”。这样做的原因在于:(1)剪裁的血管片材料适合缝合形成类似的形态;(2)理论上,锥形结构使血流在远端逐渐加速,可能避免血栓形成;(3)近端较粗的结构避免了肺动脉压迫导致的冠状动脉缺血。
ALCAPA患者常因为心脏扩大、缺血性心脏功能减退和瓣下装置器质性病变引起二尖瓣关闭不全。学者们对二尖瓣处理方法的选择存在一定的学术争议。有研究显示,二尖瓣处理与手术年龄相关:在一组34例小儿ALCAPA的研究中,仅5例接受同期二尖瓣成形术,12.5%的婴儿和50%的大龄患儿随访中仍存在中-重度二尖瓣反流;作者认为,相对于婴儿,大龄患儿的二尖瓣反流处理应更加积极,对于ALCAPA合并中-重度及重度二尖瓣反流的患者,同期行二尖瓣成形术有助于二尖瓣功能的早期恢复[12]。也有学者认为,选择性处理二尖瓣更应针对反流性质:一项基于20年随访的研究显示,多数二尖瓣反流(即使中大量)为功能性病变,术后随心脏恢复而改善,不须术中处理,但二尖瓣器质性改变则须积极进行同期矫正[13];近期的一项研究提示,尽管冠状动脉移植改善了ALCAPA患儿术后二尖瓣反流,但对于中度以上的二尖瓣反流应该同期处理[5]。
我们支持针对二尖瓣反流的性质及程度采取个体化的策略。对合并中度以上二尖瓣反流的ALCAPA患儿采取积极的成形术治疗,有助于早期心脏功能的恢复;对瓣环扩大引起的中度反流的患儿,早期更多选择了保守的二尖瓣成形策略并取得了好的效果(病例1、4、5、6);后期对同类患儿采取了不处理二尖瓣策略,术后短期随访二尖瓣反流程度也改善到轻度及以下;大龄患儿的二尖瓣反流更容易由功能性变化为器质性而需要积极处理。本组1例12岁的患儿(病例5)二尖瓣前叶有明显脱垂,我们选择了人工腱索+瓣环成形的方法,取得了满意的疗效。
一些患儿由于冠状动脉侧支形成差等原因,在婴儿早期即出现了严重左心心力衰竭表现而需要较紧急干预。此类危重患儿是对手术和围手术期管理能力的挑战。波士顿儿童医院的婴儿病例中,26.9%(7/26)因术后不能脱离体外循环而应用左心室辅助装置,7例中5例存活[14]。多伦多病童医院的67例中位年龄7.7个月的ALCAPA手术患儿,其中5例重症患儿因术后脱离体外循环困难接受了体外膜肺氧合治疗后4例存活,47例冠状动脉移植的患者中7例(15%)延迟关胸[4]。
术前即存在左心功能不全的婴儿属于危重症。由于左心功能处于边缘状态,术前对前负荷的管理要更加精细,不必要的吸氧可使肺血管阻力下降,加重肺动脉窃血而加剧病情[14]。笔者分析,麻醉诱导期间急性循环障碍可能由2个因素引起:一是前负荷的降低,使边缘状态的左心室排血减少;二是一过性血氧含量的升高,使肺动脉压力下降进而诱发左冠状动脉窃血增加。术后早期,心脏功能尚未恢复,需要延迟关胸甚至机械辅助循环等,帮助患儿安全度过围手术期。在本组病例中,2例患儿的LVEF低,术前均存在较明显的左心功能不全表现,其中1例在麻醉诱导期间出现了急性循环障碍而施行紧急开胸体外循环;2例患儿均在术后延迟关胸,待循环平稳后行二期床旁关胸,均未使用机械辅助循环,术后恢复满意。
经过手术矫治,实现左右冠状动脉双源供血后,ALCAPA患儿的左心室大小和功能在一段时间后,多可以恢复到正常水平。波士顿儿童医院对13例双源供血矫治的1岁以下ALCAPA患儿进行了以超声心动图测值为依据的系统随访,术后左心室功能恢复正常平均需要2~7个月,其中术前左心功能不全的患儿,术后心功能恢复最早从1周开始,直至术后2年仍可见心脏功能继续改善[3]。多伦多病童医院的研究结果相似:左心室舒张末期内径和LVEF在1年以内恢复正常,二尖瓣反流在1年后恢复,提示了左心室恢复的机制不仅是心肌缺血的改善,而且有心脏重构的因素[4]。一组135例ALCAPA患儿术后随访研究显示,LVEF恢复正常的平均时间在术后6个月[6]。
与此类似,本组的2例患儿(病例2、7)术后左心室功能随时间逐步改善,其中1例术后4个月已基本达正常水平,另1例近期患儿术后5个月LVEF为45%,考虑仍处于恢复过程,时间窗与文献报道相符[4, 5]。此外,1例1.7岁患儿(病例6)存在左主干开口狭窄(未处理),冠状动脉直接移栽术后LVEF由术前的42%降为出院前的25%,患儿LVEF由术后3个月开始恢复,至术后11个月LVEF已达69%。
婴幼儿ALCAPA的左心室表现为整体性运动减低,而非节段性功能不良,其机制源于冠状动脉供血不足而引起的“心肌冬眠”。心脏手术后,一部分心肌受损导致“心肌顿抑”[3],在冬眠心肌尚未恢复以及新发心肌顿抑的重叠影响下,心功能可在术后早期跌入低谷,需要不同程度的辅助。ALCAPA患儿的恢复规律说明,心脏供血恢复正常后心肌可以在一段时间内完全恢复正常;此外,心肌细胞增殖是另一个可能的机制[3]。远期心脏功能恢复不良很大程度上源于手术解剖重建欠佳导致心肌正常供血未完全恢复。
总之,对小儿ALCAPA采取个体化手术策略恢复双源冠状动脉供血可以取得满意的近中期效果。重症婴儿患者需要精细的围手术期管理,左心功能及二尖瓣反流可在一段恢复期达到满意水平。本研究的不足:单中心研究,病例数较少,随访时间有限,患儿从手术至出院时间差异较大,故指标的统一性稍差。多中心、大样本量以及长时间的随访是今后的工作方向。
所有作者声明不存在利益冲突



























