
已经被证实幽门螺杆菌感染与慢性胃炎、消化性胃溃疡、胃黏膜组织相关性淋巴瘤(MALT)等胃肠道疾病密切相关。疾病发生的不同程度不仅和宿主的个体差异及生活环境密切相关外,还与病毒易感致病基因有着密切的联系,近年来随着胃癌的高发病率和病死率,研究胃癌病因及发病机制成为热点,而幽门螺杆菌毒力基因与胃癌发病的关系也逐渐被重视。

本刊刊出的文章除特别声明外,不代表主办单位和本刊编委会的观点。本刊如有印刷质量问题,请与本刊编辑部联系调换。
作者参考近年对幽门螺杆菌毒力基因与胃癌发病关系的研究,结合有关数据综合分析,以进一步了解幽门螺杆菌毒力基因与胃癌发病的关系,为幽门螺杆菌感染的防治及其导致的胃癌精确治疗提供科学依据。
胃癌的发展是多步骤的过程,需要对癌基因和抑癌基因的表达进行定性和定量的改变,持续数10年。期间cagA阳性幽门螺杆菌感染后,胃上皮细胞不断暴露于细菌中的CagA。CagA结合和解除SHP-2及其他细胞内信号分子的酪氨酸磷酸化依赖和独立的方式,产生解除对细胞生长和运动管制信号。CagA还破坏细胞与细胞的连接,破坏正常的上皮结构。在干扰细胞功能的各种CagA活性中,CagA解除对SHP-2的调控在胃癌发生中具有潜在的重要意义。因为PTPN11编码人SHP-2基因已在人类恶性肿瘤中得到证实[1]。大多数患者在第3外显子和第8外显子上携带错位突变,分别编码N-SH2结构域和PTPase结构域的片段。35%的散发性青少年粒细胞白血病、5% ~ 10%的儿童骨髓增生异常综合征、7%的B细胞急性淋巴细胞白血病、5%的急性髓细胞白血病和神经母细胞瘤等实体肿瘤中均存在SHP-2突变。SHP-2的分子模拟表明,这种突变削弱了自身抑制作用,从而激活SHP-2磷酸酶的活性。因此,CagA解除对SHP-2的管制,在功能上模拟了与人类恶性肿瘤相关的SHP-2的功能增益突变。
最近在多种人类恶性肿瘤中发现了CagA与SHP-2酪氨酸磷酸酶的功能增益突变[2]。CagA-SHP-2相互作用完全依赖于CagA酪氨酸磷酸化。通过复合物的形成,SHP-2被催化激活,并诱导细胞活力增强的形态转变。CagA酪氨酸磷酸化位点的结构多样性解释了单个CagA结合和激活SHP-2的差异活性。CagA对SHP-2和其他细胞内信号分子的解除调控可能使细胞在胃癌发生过程中积累多种遗传和表观遗传变化。此外,个体CagA干扰细胞功能的差异表明,携带CagA活性较高的Hp菌株比CagA活性较低的菌株具有更强的毒力,且与胃癌的关系更为密切。
幽门螺杆菌分为CagA阳性菌株和CagA阴性菌株,CagA阳性幽门螺杆菌感染与胃癌的发生密切相关,CagA通过IV型分泌系统直接从细菌注入胃上皮细胞。在Src家族激酶进行膜定位和酪氨酸磷酸化后,CagA作为支架适配器与许多宿主蛋白相互作用,通过CagA磷酸化依赖和磷酸化无关的方式调节细胞生长、细胞运动和细胞极性。CagA阴性幽门螺杆菌无致病性或致病性较弱,不参与胃癌的发生。CagA阳性幽门螺杆菌分为携带东亚CagA和携带西方CagA[3]。毒力幽门螺杆菌携带西方CagA少部分是EPIYA-C的数量决定的。与EPIYA-C较少的CagA患者相比,携带EPIYA-C的CagA毒力更强,与重度萎缩性胃炎和胃癌的关系更密切。幽门螺杆菌携带东亚CagA的菌株在生物学上比大多数(如果不是全部)西方类型的菌株都更活跃。幽门螺杆菌以及感染这类病毒的个人幽门螺杆菌患胃癌的风险最高。
VacA是一种分泌型孔形毒素[4],是幽门螺杆菌感染的主要致病因子。几乎所有的毒株都存在VacA[5],但只有某些类型的毒株具有致病性。虽然VacA及其基因型被认为是幽门螺杆菌相关疾病或疾病的标志,但VacA及其基因型的病理生理机制仍存在争议。虽然几乎所有从人类分离出的菌株都有VacA基因,但是诱导细胞空泡化的能力因菌株而异[6]。以前空泡化细胞毒素的表型是根据VacA转录或通过VacA分泌的效率[7]决定。然而随后的研究表明表型受基因变异的影响。
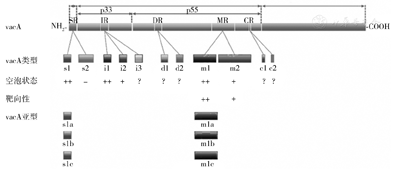
VacA基因的3个序列多样性区域与空泡活动密切相关,并与临床结果密切相关的包括s区、m区和i区[8]。s区和m区是2个主要的多态区,已被证实为幽门螺杆菌毒力和发展为严重疾病的重要部位[9]。第一个多态区S区包括2个信号肽,是传递成熟毒力88kDa-VacA毒素和p33氨基酸末端残基的装置的一部分,p33是VacA的一个高度疏水结构域。m区编码部分羧基端p55亚基,在介导VacA与宿主细胞的结合中起重要作用[10]。i区是第3个多态行列式,位于p33的羧基末端,位于s区和m区之间[11]。i区似乎与s和m区相互作用,并被描述为VacA毒性的决定因素。此外,i区被认为比s或m区域更能预测疾病的严重程度[12]。根据这些区域内的氨基酸序列差异,为每个区域描述了2个或多个主要变异体:信号区的s1和s2;中间区域的i1、i2和i3;中间区域的m1和m2。此外,s1和m1基因型还进一步分为3种亚型:s1a、s1b、s1c和m1A、m1B、m1c[13]。
VacA序列多样性与空泡活动密切相关,幽门螺杆菌临床结果定位于信号区(SR)、p33区的中间区(IR)、p55区的d区(DR)、中间区(MR)和c区(CR)。这些区域的不同类型与空泡形成、特异性和临床结果的差异有关。S1、M1、I1型被归为完全活跃的VacA,与GC的发生风险比S2、m2或i2高。与s1型相比,s2型VacA在大多数情况下缺乏可检测到的空泡活性。离体实验。与M1/i1型相比,m2/i2型活性要低,而且几乎无毒。i3的功能仍未确定。d区被认为与VacA和宿主胃细胞的结合和空泡活动有关,然而,尚缺乏令人信服的证据。c区的功能仍然是一个谜,然而,C1基因型与胃癌的风险密切相关。S1和M1基因型进一步分为S1a、S1b、S1c和M1A、M1B、M1c 3个亚型(图1)。

1998年Peek等根据Hp与胃上皮细胞黏附可能诱导毒力相关基因表达这一假说,通过比较黏附和未黏附于人胃上皮细胞的Hp溃疡株和胃炎株的mRNA转录,发现了一种新的Hp基因iceA[14]。iceA与胃上皮细胞接触的转录上调后被发现[15]。iceA有2种基因型,iceA1和iceA2,而且只有iceA1RNA通过体外黏附诱导。幽门螺杆菌iceA1与限制性内切酶有很强的同源性NLAIIIR内酰胺酶[16],并在体内携带幽门螺杆菌iceA1。iceA1基因型和溃疡型不是普遍存在的[17],因此可能与个体因素有关,iceA2与已知的蛋白质没有显著的同源性,其结构揭示了重复蛋白质的模式。最近,遗传组织和序列的异质性iceA2已经被研究[18],iceA2在无症状型胃炎和非溃疡型消化不良患者的菌株更为普遍。
生物芯片技术的不断发展,使幽门螺杆菌基因多态性逐渐被人们认识,显示出基因多态性的差异,为基因和人类共同进化提供了证据。幽门螺杆菌诱导宿主细胞反应的基因表达谱,为幽门螺杆菌致病机制的研究提供了一个新的思路,一系列新的幽门螺杆菌致病基因也逐渐被发掘出来,它们与十二指肠溃疡和胃癌的相关性,显示它们有可能成为新的分子流行病学标志。
hrgA基因与cj1602基因同源,全长594bp[19],但功能未知。从JP26中提取的引物hrgAf序列,结果表明hrgA和HPYIIIR在所有测试菌株中相互排斥。通过PCR技术确认了hrgA位于HPYIIIM的上游。在西方国家hrgA+流行率高于亚洲株。hrgA+胃癌患者的菌株流行率高于非胃癌患者[20],并且hrgA阳性菌株在与AGS人类胃癌上皮细胞共同培养时能够诱导IL-8的分泌。hrgA可能是与亚洲胃癌相关的菌株的标志。
baba基因与Lewis b(Leb)相关抗原的相互作用是幽门螺杆菌中黏附素受体相互作用的最佳特征。预测了多种调控Baba表达的机制,包括转录水平和翻译水平。嵌合蛋白(baba/B或babb/A嵌合体)的形成在翻译调控中起着特别重要的作用。嵌合的babb/A蛋白具有与Leb结合的潜力[21],但由于链错配,蛋白质的产量会发生阶段性变化。baba基因最初是从CCUG17875株中克隆出来的。CCUG 17875含有1个沉默的baba1基因和一个表达的babA2基因。这2个基因的序列差异仅在于baba1信号肽序列中存在一个10bp的缺失,从而消除了它的翻译起始密码子。而baba1型缺失仅见于CCUG17875株。一些研究通过免疫印迹评估baba状态,并证实在西方菌株中baba阳性状态与严重的临床结果密切相关。baba阳性状态也与其他毒力因子的存在有关。一小类菌株产生低水平的baba蛋白,缺乏Leb结合活性。与表现出Leb结合活性的baba阳性菌株相比,这些菌株更有可能引起黏膜炎症的增加和严重的临床结果。其作用机制尚不清楚,在幽门螺杆菌与胃黏膜的相互作用中,复杂的baba受体网络是如何相互作用的,还需要进一步的研究。
十二指肠溃疡促进基因dupA是一种毒力因子,在2005年人们第1次发现dupA毒力因子[22],它位于大鼠的可塑性区,与十二指肠溃疡的发展和降低胃癌的风险密切相关,dupA从西方国家分离出的菌株相对较高。胃炎患者中dupA全球流行率约45%,在不同民族之间差异很大(31%在亚洲,64%在西方国家)[23]。dupA组成的Pr或"可塑性区",具有较高的等位基因多样性。Lu等[24]描述幽门螺杆菌dupA阴性菌株可增加十二指肠溃疡的风险,但减少发生胃溃疡的机会。dupA有2个主要基因型(长型和短型)[25]。没有移码突变的dupA称之为完整的长型,dupA短型与胃癌高度相关[26]。目前数据表明只有完整的长类型dupA可以产生dupA蛋白,作为真正的毒力因子,在十二指肠溃疡等严重胃十二指肠疾病的发生发展中具有重要作用。
由于胃癌的高发病率和病死率,导致世界各地都在研究其病因与发病机制,而幽门螺杆菌基因的多态性与胃癌发病的关系引起许多学者的重视。目前世界各地开展了大量关于幽门螺杆菌基因多态性与胃癌发生的研究,然而没有一个毒力基因或亚型被证实是胃癌发生的明确的危险因素。对于幽门螺杆菌毒力基因与胃癌发病的关系世界各地的研究结果各不相同,依然存在着许多争议,关于这些高危致癌基因的发病机制需要进一步的研究和探索。幽门螺杆菌作为胃癌的I类致癌因子,其致癌机理是一个多因素、多阶段、多基因变异参与的综合过程,不仅要考虑个体差异及生活环境的差异外,还应考虑各地区幽门螺杆菌的感染率和各基因的发病率。






























