
通过分析卵巢勃勒纳瘤(Brenner瘤)的影像表现,剖析误诊因素,旨在提高Brenner瘤的术前影像诊断准确率。
搜集2013年1月至2021年4月经手术病理证实的45例卵巢Brenner瘤,回顾性分析其临床及影像资料,并鉴别其良恶性。
45例卵巢Brenner瘤中,1例(2.2%)为恶性病变,2例(4.4%)为交界性病变,42例(93.3%)为良性病变。良性病变中,8例合并卵巢其他病变;42例良性病变共45个病灶,其中36个呈完全实性、9个呈囊实性;良性肿瘤实质区CT平扫均呈等或稍高密度,T1WI、T2WI均呈等或低信号;在CT及MRI增强中分别有15个及26个病灶实质呈轻度强化,仅有1个病灶行CT增强后呈明显强化;12个良性Brenner瘤在CT上可见多发无定形钙化;9个囊实性的良性Brenner瘤的囊变均呈外生型。2个交界性及1个恶性Brenner瘤均呈囊实性,囊变均呈中央型,肿瘤实质增强呈中度至明显强化。45例共48个病灶,其中3个行两次影像检查,故术前共进行51次影像诊断,仅2次正确诊断为Brenner瘤,另49次影像报告为误诊或未明确诊断。
良性Brenner瘤可呈实性、囊实性,实质部分增强扫描呈轻度强化,内部可见无定形钙化;囊实性良性Brenner瘤的囊性成分呈外生型为主。交界性及恶性Brenner瘤以囊实性为主,其实质成分增强扫描呈中度至明显强化,囊变多位于病灶中心。不同分级卵巢Brenner瘤有一定特征影像表现,有助于术前精确诊断。

本刊刊出的文章除特别声明外,不代表主办单位和本刊编委会的观点。本刊如有印刷质量问题,请与本刊编辑部联系调换。
卵巢勃勒纳瘤(Brenner瘤)是一种起源于卵巢表面上皮的肿瘤,约占卵巢肿瘤的1%[1],因其病理组织与正常尿路移行上皮细胞极为相似,又称为移行细胞肿瘤。目前临床治疗方式首选手术。卵巢Brenner瘤病理分为三型:良性、交界性、恶性。其中99%为良性病变,交界性及恶性仅占极少数[2]。本研究中,我们旨在分析45例卵巢Brenner瘤的临床及影像表现,剖析其误诊因素,以期提高其术前诊断率。
搜集2013年1月至2021年4月本院经手术病理证实的45例卵巢Brenner瘤患者,回顾性分析其临床及影像资料,并鉴别其良恶性。患者年龄25 ~84岁,平均(53±12)岁。纳入标准:(1)手术病理证实为Brenner瘤;(2)影像图像质量佳,病灶清晰。
采用GE Bright Speed Pro 16排螺旋CT进行扫描,扫描范围自脐平面至盆底会阴部。参数:管电压120 kV,管电流130 mAs,层厚5 mm,层间距5 mm,螺距1.0。CT增强对比剂碘海醇(扬子江药业集团有限公司生产),用量以1.5 ml/kg体质量,注射流率4 ml/s,经肘静脉注射,延迟30、90 s分别为动脉期、静脉期。
采用GE Signa Excite 1.5 T或GE Signal HDxt 1.5 T超导型MR扫描仪,体部相控阵线圈。T2WI序列:TR 6667.0 ms,TE 100.0 ms;TIWI序列:TR 180.0 ms,TE 4.5 ms。扩散加权成像(diffusion-weighted imaging,DWI)序列:TR 6000.0 ms,TE 77.0 ms,b值800 s/mm2。动态增强扫描采用肝脏加速容积采集(liver acceleration volume acquisition,LAVA)序列:矩阵320×224,TR 4.7 ms,TE 2.3 ms,反转角12°,屏气时间17~ 22 s,层厚4~ 5 mm。以0.2 ml/kg体质量,流率2.0~2.5 ml/s经肘静脉高压注射对比剂钆喷酸葡甲胺,注射30、60、90 s及2 min时行多期扫描。
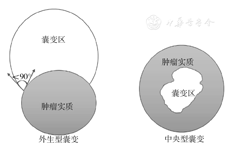
由2名影像科医师非盲法进行图像分析,包括:病灶部位、病灶最大径平均值、实性及囊实性、囊性成分位置及分隔、钙化、CT值、MRI信号及强化程度、腹水情况。当意见不统一时经讨论确定结果。卵巢Brenner瘤囊变位置:外生型为囊变位于实质成分外,囊壁与实性部分接触面呈锐角;中央型为囊变位于病灶中心,见图1。

患者中,绝经22例,绝经时间0.5~ 26.0年。临床表现:月经周期紊乱6例,经量增多2例,不规则阴道出血4例,腹痛、腹胀4例,尿频、尿急4例,体检发现25例。实验室检查:1例糖类抗原125 (carbohydrate antigen 125,CA125 )、CA199及癌胚抗原(carcinoembryonic antigen,CEA)3种肿瘤标志物呈明显升高,病理检查为良性Brenner瘤合并卵巢黏液腺癌;3例分别出现CA125、CA199或CEA中单一肿瘤标志物轻度升高,病理检查为良性Brenner瘤;其他未见明显异常。
45例中,1例(2.2%)为恶性病变,呈单侧卵巢病灶;2例(4.4%)为交界性病变,均发生于单侧卵巢;42例(93.4%)为良性病变,其中3例呈双侧卵巢病变,共45个病灶。42例良性患者中,8例(19.0%)合并卵巢其他病变,合并病变均为单发。合并病变中4例卵巢浆液性或黏液性囊腺瘤、2例乳头状囊腺纤维瘤、1例黏液性囊腺癌、1例卵泡膜细胞瘤,1例卵泡膜细胞瘤起源于Brenner瘤的对侧卵巢、余7例合并的卵巢病变均起源于Brenner瘤同侧卵巢。13例良性Brenner瘤、1例交界性及1例恶性均伴少量腹水。
良性Brenner瘤共42例,累计45个病灶,包括36个(80.0%)完全实性病灶及9个(20.0%)囊实性病灶。此45个病灶平均直径[本研究中病灶平均直径指病灶横径、前后径和(或)纵径的平均值]范围为0.6~ 13.6 cm,平均(3.2±2.7)cm. 45个病灶中14个仅接受CT检查,28个仅接受MRI检查,3个接受CT及MRI检查(包括2个完全实性和1个囊实性病灶)。
1个良性病灶行CT平扫检查,16个行CT平扫+增强检查。13个呈完全实性,4个呈囊实性。17个病灶实性成分于CT平扫均呈等、稍高密度,平扫CT值40.8~ 77.0 HU,平均CT值(56.6±12.7)HU。12个(70.5%)病灶实性成分内可见多发无定形钙化(图2)。增强CT扫描显示1个病灶实性成分呈明显强化,15个病灶实性成分呈轻度强化(图3),CT值强化幅度为7.9~ 39.8 HU,均值(17.3±9.0)HU。4个囊实性病灶的囊性成分均呈偏侧性、外生型(图4)。
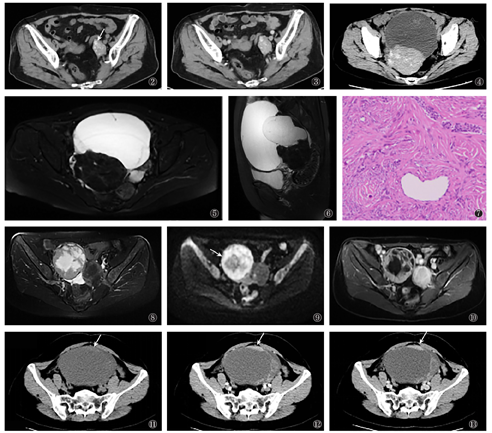

本研究中,2例交界性Brenner瘤均行MR平扫及增强;1例恶性Brenner瘤行CT平扫及增强。这3例均为单侧病灶,且均呈囊实性,囊变呈中央型,囊内分隔厚薄不均,肿瘤实质均位于病灶边缘,呈不规则状、结节状。2个交界性病变平均直径分别为7.3 cm、12.4 cm,肿瘤实质T2WI及DWI均呈稍高信号,增强扫描均呈中度强化(图8,图9,图10)。1个恶性病变平均直径为13.2 cm,肿瘤实质CT平扫呈等密度,增强扫描呈明显强化,强化幅度为49.8 HU(图11,图12,图13)。这3例病灶均未见钙化。
术前影像误诊资料:在术前影像检查中,45例患者累计48个Brenner瘤灶,其中3个行2次影像检查,故累计行51次CT或MRI影像诊断,仅2次术前影像正确诊断为Brenner瘤,49次影像误诊均为其他病变,尤其是良性Brenner瘤中完全实性与囊实性2种表现所误诊的疾病类型分布有所不同。完全实性的良性Brenner瘤中被误诊为浆膜下或阔韧带肌瘤4次,畸胎瘤2次,纤维瘤卵泡膜瘤16次,未给予明确诊断15次;囊实性的良性Brenner瘤被误诊为纤维瘤1次,囊腺瘤或癌2次,未明确诊断6次。交界性Brenner瘤术前影像1次误诊为囊腺瘤,1次误诊为颗粒细胞瘤。1例恶性Brenner瘤误诊为囊腺癌。
卵巢Brenner瘤发病机制尚未明确。有学者认为其起源于卵巢表面生发上皮,亦因其肿瘤细胞形态与输卵管浆膜下的瓦耳塔德细胞巢相似,被认为其可能起源于输卵管上皮[3]。卵巢Brenner瘤病理组织学表现为由类似泌尿系移行细胞的上皮细胞巢以及梭形细胞或纤维结缔组织组成[4]。第四版WHO分类中Brenner瘤分为良性、交界性或不典型增生性、恶性[5]。卵巢Brenner瘤可发生于任何年龄,以40~ 50岁女性多见,良性病变发病年龄通常较交界性及恶性病变患者小5~ 10岁[6]。卵巢Brenner瘤通常无特异性症状,部分患者于体检时发现,可发生腹痛、腹胀、尿频、尿急等非特异性症状[2],其月经紊乱及经血异常可能与肿瘤组织影响激素合成或分泌有关;实验室检查无明显特异性。本组42例良性Brenner瘤患者中8例合并其他卵巢病变,其中4例为浆液性或黏液腺囊腺瘤、1例为黏液腺癌,这与文献报道23%~30%的Brenner瘤可合并其他卵巢肿瘤,以浆液性或黏液性肿瘤为主结果相符[7]。本组中,1例良性Brenner患者肿瘤标志物明显升高,可能与该患者合并卵巢黏液腺癌相关,3例良性Brenner患者肿瘤标志物异常,与瘤体是否直接相关还不清楚。
典型的良性Brenner瘤影像多表现为单侧、完全、实性肿块[6],肿块实质部分有丰富的纤维组织,T2WI通常呈等低信号,CT平扫呈稍高密度,增强后多呈轻度延迟强化[6],本组12个病灶呈多发无定形钙化,与研究结果钙化情况可作为诊断Brenner瘤的重要征象相符[6]。目前,有关良性Brenner瘤呈囊实性肿块的研究较少[6,7]。良性囊实性Brenner瘤的实质密度、信号与典型Brenner瘤类似,区别在于前者实性部分多位于病灶边缘、偏侧性,其囊性结构可呈单囊、多囊;本研究中,9个囊实性病灶囊性部分均呈外生型生长,提示外生型囊性病变可能是良性Brenner瘤的典型征象。交界性及恶性Brenner瘤病灶多较良性病变体积大,以囊实性多见。本组2例交界性及1例恶性Brenner瘤均呈囊实性,且囊变多位于病灶中央,这可能与肿瘤生长速度较快,病灶体积较大,中心液化坏死形成有关;其实性成分明显强化,可能与肿瘤恶性程度增加,肿瘤血供随之增加有关。
卵巢Brenner瘤影像表现有一定特征性,但在临床上误诊率仍较高,可能与本病发病率较低,放射科医师经验少,鉴别诊断较困难有关。
实性Brenner瘤鉴别诊断:(1)纤维卵泡膜细胞瘤:本病好发于中老年群体,内部含大量纤维成分,与实性Brenner瘤影像表现相似。本组36个完全实性的良性病灶中,9个(25.0%)病灶内可见无定型钙化,与文献报道的Brenner瘤钙化通常以多发、无定形性纤维类瘤多见结果相符[6],提示钙化可作鉴别征象。(2)浆膜下或阔韧带肌瘤:该部位肌瘤多与子宫呈宽基底,增强后明显强化,动脉期可见子宫动脉供血[6];Brenner瘤与子宫呈锐角,通常为轻度渐进性强化为主。(3)畸胎瘤:多见于育龄期妇女,以囊实性为主,骨组织多位于病灶周边呈条片状,小部分位于"浮球征"中央,内部有脂肪成分[8];而Brenner瘤的钙化以多发、斑点状为主。
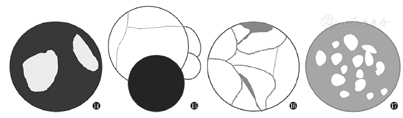
囊实性Brenner瘤的鉴别诊断:(1)纤维卵泡膜细胞瘤:该病多表现为囊实性,通常囊变位于病灶内,呈大片状、不规则状[9](图14),良性囊实性Brenner瘤囊变多为外生型(图15);但前者与中央囊变坏死的交界性及恶性Brenner瘤鉴别困难。且前者肿瘤实性部分与Brenner瘤表现相似,易被误诊。(2)囊腺肿瘤:该病为卵巢常见肿瘤,可发生于附件区。卵巢囊腺瘤多呈囊实性,囊变可呈单房或多房,囊内分隔随肿瘤恶性程度增加可厚薄不均,囊腺瘤或囊腺癌实性成分多呈结节状附于囊内壁,即壁结节,囊变呈多房状,内分隔厚薄不均匀(图16),实质区域T2WI呈稍高信号,增强后可见明显强化,恶变时多伴大量腹水、腹膜腔内网膜广泛种植性转移等[9];Brenner瘤较少出现上述征象。(3)颗粒细胞瘤:本病多呈囊实性,内部多发囊变,且伴雌激素升高,实质区域T2WI信号稍高,增强后呈中度至明显强化,囊变多呈"蜂窝状"征象(图17)[10]。

综上,卵巢Brenner瘤好发于中老年女性,单侧多见;典型良性病灶呈实性,内部可见无定形钙化,T1WI及T2WI呈等低信号,增强后呈轻度延迟强化;良性囊实性病灶以外生型为重要特征;交界性及恶性病灶囊变多位于病灶中心,分隔不均匀,T2WI及DWI信号升高,增强后呈中度至明显强化,以期为临床诊断卵巢Brenner瘤提供影像依据。本研究为回顾性研究,样本量较少,今后须要大样本量的研究以证实本组结果。






























