
物理消融术是肝癌局部治疗的一类治疗方式,能够有效破坏肿瘤组织,减小肿瘤负荷或根除肿瘤。越来越多的研究证实了免疫调节效应在肝癌的局部或全身治疗中的效果。免疫治疗的理论基础是增强机体抗肿瘤免疫;然而,在中晚期肝癌的治疗中取得进展的同时,也遭遇了单药有效率低和耐药性等瓶颈。在此基础上,探索物理消融与免疫疗法协同治疗的研究取得了明显的进展,故就物理消融与免疫疗法联合应用在肝癌治疗领域的进展予以综述。

本刊刊出的文章除特别声明外,不代表主办单位和本刊编委会的观点。本刊如有印刷质量问题,请与本刊编辑部联系调换。
肝癌是全球最常见的恶性肿瘤之一,也是癌症相关病死率的第3大原因[1]。在我国,近年来随着卫生事业的发展和医疗技术水平的提高,肝癌的患病率有所下降[2],但每年仍有大量新增病例,给医疗系统和社会经济发展带来沉重负担[3]。肝细胞癌(hepatocellular carcinoma,HCC)是成年人最常见的原发性肝癌[4]。肝癌的治疗策略包括肝切除术、肝移植术、肝动脉化疗栓塞术(transarterial chemoembolization,TACE)、消融治疗、放射治疗、系统治疗以及综合治疗等。根据《原发性肝癌诊疗指南(2022版)》[5]中指出,肝切除术治疗主要适用于肝脏储备功能良好的中国肝癌分期(China liver cancer staging,CNLC)的Ⅰ~Ⅱa期患者,部分不能耐受手术的患者则可尝试消融治疗;而中晚期肝癌患者则应考虑TACE、免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)和抗血管生成药物等综合治疗方式。
消融治疗包括射频消融(radiofrequency ablation,RFA)、微波消融(microwave ablation,MWA)、冷冻消融(cryoablation,CRA)、激光消融、高强度超声聚焦消融(high-intensity focused ultrasound ablation,HIFU)、不可逆电穿孔(irreversible electroporation,IRE)等技术,具有效率高、创伤小、恢复快等优点[6, 7]。各种消融方式通过对肿瘤病灶的破坏,发挥对肿瘤的直接治疗作用或为降低肿瘤分期争取手术机会。近年来,越来越多的研究表明消融治疗在直接杀伤肿瘤的同时,还具有远隔效应(abscopal effect),这种效应与消融诱导的全身性抗肿瘤免疫反应有关。例如,研究发现,乳腺癌患者在接受MWA治疗后,血液中CD4+T细胞水平升高[8]。消融治疗可能通过杀伤肿瘤细胞,释放肿瘤抗原,增加抗原提呈和树突状细胞(dendritic cell,DC)的成熟,从而介导了系统性免疫增强[9, 10]。尽管这种免疫增强可能不足以避免肿瘤复发,但也给消融治疗与免疫增强剂(例如ICIs)的联合应用提供了途径。临床研究显示,单一的消融治疗存在术后局部复发率和疾病进展率偏高等问题[11],例如在MWA的治疗中,由于潜在的肝硬化和肿瘤微转移,在肿瘤最大径>3 cm的患者中,超过60%在发病3年内发生了远处复发[12]。
探索局部与全身联合治疗的策略包括消融治疗与免疫治疗的联合等。在一些临床研究中,已经证明了联合治疗比单独消融治疗效果好[13, 14],更多涉及各种消融方式与免疫疗法的不同联合策略的Ⅰ期和Ⅱ期临床研究正在开展中,以期获得令人满意的结果,给肝癌的综合治疗带来更多选择[15]。笔者就肝癌治疗中采用物理消融与免疫疗法联合应用的效果进展进行综述。
细胞凋亡(apoptosis)和坏死(necrosis)是细胞死亡的其中两种方式。不论对于哪种消融技术,这两种细胞死亡方式在病灶中都同时存在;消融中心位置更容易发生细胞坏死,而围绕中心的外周则更可能发生凋亡。就坏死过程而言,最初会诱导先天免疫反应,涉及巨噬细胞和粒细胞募集以及细胞因子的产生,但最终会刺激获得性免疫反应,从而导致T细胞活化。这一过程的简要步骤:坏死引起的组织损伤导致抗原释放,这些抗原被抗原呈递细胞吸收,其主要是巨噬细胞或DC;它们通过使用主要组织相容性复合物分子,将抗原呈递给T细胞;T细胞激活亦需要DC上的共刺激信号;坏死还会释放“危险信号”。Matzinger[16]提出的危险理论指出,机体不仅可以辨别自我和非自我,还可以确定是否存在危险。在没有这些信号的情况下,抗原识别会导致免疫下调或耐受。相反,凋亡不会释放危险信号,因为凋亡细胞的吞噬作用会阻止细胞内容物的释放。故消融导致的治疗区域中,坏死/凋亡的比值对于产生的是免疫激活还是免疫抑制具有重要影响[17],其他影响因素还可能包括肿瘤类型、细胞因子等。
RFA对免疫系统的调节和影响得到了许多学者的关注。除了对消融病灶的直接破坏,RFA还通过复杂的机制影响全身系统性抗肿瘤免疫应答。靶病灶被消融破坏后释放出具有免疫原性的肿瘤相关抗原(tumor-associated antigen,TAA)和热休克蛋白(heat shock protein,HSP)等,促进DC的浸润和成熟,增加抗原提呈,并刺激T细胞活化,从而促进机体抗肿瘤免疫。HSP作为一种肿瘤相关肽的伴侣蛋白,在肿瘤细胞中高表达,当其在体内被大量释放时也构成了免疫系统的有效警报信号,并可以导致抗肿瘤T细胞免疫的激活[18]。经RFA治疗后1 d血清中可检测到HSP-70[19],血清中HSP-70水平的升高可能构成对患者有利的生物标志物。此外,许多研究显示,RFA治疗后DC浸润增加,表现为CD8+T细胞浸润的增多,这将增加对肿瘤细胞的特异性杀伤,增强特异性抗肿瘤免疫反应[20]。除了对免疫刺激T细胞的激活,RFA诱导的免疫调节效应还表现在对免疫抑制细胞的调节作用。调节性T细胞(regulatory T-cells,Treg)是抑制肿瘤免疫的主要效应细胞之一。有研究表明,外周血或肿瘤内Treg的数量增多与肝癌患者的低存活率有关[21]。射频辅助肝癌切除术后,循环Treg的数量降低,导致CD8+或CD4+增加,进一步证明了RFA诱导的抗肿瘤免疫作用[22]。
CRA通过低温使细胞发生凋亡或坏死来达到肿瘤病灶消除的目的。相对于热消融,CRA能够使受损肿瘤细胞内的抗原物质等被更好的保存下来,进而启动机体肿瘤特异性免疫反应的激活[23, 24, 25]。CRA可诱导增强炎症反应和提高抗肿瘤免疫,例如白细胞介素(interleukin,IL)-6、IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)以及凝血系统指标等水平升高[23,26]。亦有研究显示,CRA可上调乙型肝炎病毒相关性HCC患者的循环程序性死亡配体-1(programmed death ligang-1,PD-L1)/PD-1,而这与预后不良有关[27, 28]。以上研究证明,有必要联合应用ICIs与CRA,以改善疗效;也显示两者联合治疗的巨大潜力。
动物研究显示,MWA治疗后外周血IL-6、IL-1β等炎症因子水平以及HSP-70水平显著低于RFA和CRA[26,29]。与RFA相比,MWA由于局部温度较高,使其可能更容易出现邻近组织器官的损伤[30];然而,由于其温度上升快,热效应更明显,消融范围更广泛,亦可能更有利于减少微卫星病变的残余和复发[31, 32]。此外,研究显示经MWA治疗后的肝癌患者,与治疗前相比,MWA治疗1个月后的外周血CD3+、CD4+数量和IL-12水平显著升高,而IL-4、IL-10显著降低,说明MWA可以缓解肿瘤引起的免疫功能抑制,促进辅助性T细胞(helper T cell,Th)Th2/Th1的偏离,从而改善肝癌患者的肿瘤免疫抑制状态[33]。越来越多的临床研究证据证实MWA在HCC患者的免疫相关效应[34]。
免疫检查点是表达于细胞表面的一类分子,通过配体与受体的结合抑制免疫激活,调控过度的免疫反应,其在肿瘤微环境中呈过度表达。ICIs则是目前最有前途的肝癌系统治疗药物,其中主要是PD-1/PD-L1和细胞毒T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)抑制剂。
目前已开发出的靶向抑制PD-1的抗体有纳武利尤单抗(nivolumab,百时美施贵宝,美国)、帕博丽珠单抗(pembrolizumab,默沙东,美国)、特瑞普利单抗(toripalimab,君实,中国)、卡瑞利珠单抗(camrelizumab,恒瑞,中国)、信迪利单抗(sintilimab,信达,中国)和替雷利珠单抗(tislelizumab,百济神州,中国)等,靶向抑制PD-L1抗体药物包括阿替丽珠单抗(atezolizumab,罗氏,美国)、阿维鲁单抗(avelumab,默克,德国)、度伐鲁单抗(duvalumab,阿斯利康,英国)和恩沃利单抗(envafolimab,康宁杰瑞,中国)等。然而,由于单药具有治疗效率不高、容易耐药等局限性[35, 36],人们越来越关注联合用药方案的选择。其中既包括ICIs间的联合,也包括ICIs与其他疗法的联合。目前,最令人瞩目的结果来自IMbrave150试验,阿替丽珠单抗(PD-L1抗体)和贝伐珠单抗(血管内皮生长因子抗体)联合应用治疗不可切除的HCC患者,其中位总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)显著长于索拉非尼组(中位OS分别是19.2、13.4个月,P<0.001;中位PFS分别是6.9、4.3个月,P<0.001),病死风险也降低34%;并且在中国亚组患者研究中也显示出了明显的临床获益[37, 38]。此外,ORIENT32全国多中心研究结果显示,信迪利单抗(PD-1抗体)联合贝伐珠单抗类似物组中位PFS 4.6个月显著长于索拉非尼组的2.8个月(P<0.0001),病死风险下降43%,且安全性可较好[39]。这些都代表着不可切除HCC的一线治疗方面的重要进展。
CTLA-4抗体药物包括替西木单抗(tremlimumab,阿斯利康,英国)和伊匹单抗(ipilimumab,百时美施贵宝,美国)。Sangro等[40]在一项临床试验中评估了替西木单抗治疗肝硬化(Child-Pugh A级和B级)和丙型肝炎HCC患者的可行性,根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),静脉注射替西木单抗后,17例患者中,3例(17.6%)部分缓解,中位OS是8.2个月。Kelley等[41]在另一项1~2期临床研究中,观察替西木单抗联合度伐鲁单抗治疗不可切除HCC患者的安全性以及疗效,结果显示联合组的客观缓解率24.0%(95%CI:14.9%~35.3%),中位OS是18.7个月(95%CI:10.8~27.3个月),并且联合方案具有良好的耐受性。
大量研究表明,热消融或冷消融技术都可以不同程度上诱导免疫调节,但可能不足以预防患者肿瘤复发。然而,物理消融与免疫疗法相结合的优点不容忽视,不仅有利于抗肿瘤免疫反应的增强,而且可有效降低消融后的复发率,故笔者总结了部分目前联合疗法治疗肝癌的临床研究(表1)。
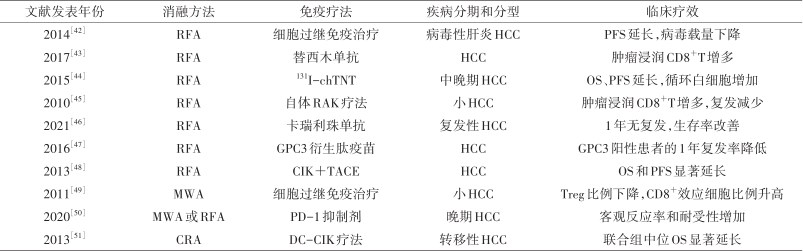
物理消融联合免疫疗法治疗肝癌临床研究的文献
物理消融联合免疫疗法治疗肝癌临床研究的文献
| 文献发表年份 | 消融方法 | 免疫疗法 | 疾病分期和分型 | 临床疗效 |
|---|---|---|---|---|
| 2014[42] | RFA | 细胞过继免疫治疗 | 病毒性肝炎HCC | PFS延长,病毒载量下降 |
| 2017[43] | RFA | 替西木单抗 | HCC | 肿瘤浸润CD8+T增多 |
| 2015[44] | RFA | 131I-chTNT | 中晚期HCC | OS、PFS延长,循环白细胞增加 |
| 2010[45] | RFA | 自体RAK疗法 | 小HCC | 肿瘤浸润CD8+T增多,复发减少 |
| 2021[46] | RFA | 卡瑞利珠单抗 | 复发性HCC | 1年无复发,生存率改善 |
| 2016[47] | RFA | GPC3衍生肽疫苗 | HCC | GPC3阳性患者的1年复发率降低 |
| 2013[48] | RFA | CIK+TACE | HCC | OS和PFS显著延长 |
| 2011[49] | MWA | 细胞过继免疫治疗 | 小HCC | Treg比例下降,CD8+效应细胞比例升高 |
| 2020[50] | MWA或RFA | PD-1抑制剂 | 晚期HCC | 客观反应率和耐受性增加 |
| 2013[51] | CRA | DC-CIK疗法 | 转移性HCC | 联合组中位OS显著延长 |
注:RFA是射频消融;MWA是微波消融;CRA是冷冻消融;HCC是肝细胞癌;131I-chTNT是131I标记的肿瘤细胞核人鼠嵌合单克隆抗体;RAK是RetroNectin激活的杀伤细胞;GPC3是磷脂酰肌醇蛋白聚糖-3;TACE是经导管动脉栓塞化疗;DC-CIK是树突状细胞-细胞因子诱导的杀伤细胞;PFS是无进展生存期;OS是总生存期;Treg是调节性T细胞
Shi等[52]的研究发现,在结直肠癌肝转移的患者和CT26结肠癌带瘤小鼠中,局部RFA能够增加其原发肿瘤或远处肿瘤的T细胞浸润以及PD-L1表达。此外,在使用RFA治疗小鼠CT26结肠癌皮下肿瘤过程中,消融早期T细胞介导的免疫反应显著增强,然而后期这种免疫反应被肿瘤克服,T细胞(CD8+和CD4+)的功能被抑制,效应T细胞与Treg的比例降低,且PD-L1/PD-1的表达增加。然而,当RFA和PD-1抑制剂联合使用时,T细胞免疫反应显著改善,导致更强的抗肿瘤免疫,并产生了更好的预后[52]。此外,也有研究表明单独RFA不会增加结直肠癌肝转移患者肝内未消融的病灶和结肠癌小鼠远处病灶的肿瘤浸润淋巴细胞数量,并且无法避免复发[53];然而,当联合局部粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony factor,GM-CSF)和卡介苗与全身抗PD-1注射治疗后,显示对小鼠远处肿瘤生长的显著抑制作用,能够增加肿瘤局部T细胞浸润,并减少髓源抑制性细胞的浸润[53]。
尽管样本量有限,但仍有一些临床研究初步显示了RFA联合免疫治疗肝癌的安全性和有效性。在一项晚期HCC患者的非比较临床试验中,替西木单抗和RFA的联合治疗增加了肿瘤内CD8+T细胞的浸润数量[43]。在另一项中晚期HCC患者的比较研究中,探究了单克隆抗体(131I-chTNT)和RFA联合治疗的效果,结果显示,接受联合治疗的患者中位OS明显长于单纯RFA组(P=0.052),且白细胞数显著增加[44];表明在中晚期HCC患者中,131I-chTNT联合RFA治疗比单独RFA治疗HCC更有效。Cui等[42]将62例接受根治性RFA治疗的HCC患者分为两组:单独RFA组(32例)和RFA+细胞免疫治疗(cellular immunotherapy,CIT)组(30例),结果显示RFA+CIT组的PFS高于RFA组,且RFA+CIT组6个疗程的生存预后好于3个疗程,其中3例未接受抗病毒治疗的患者中,2例丙型肝炎病毒载量降低,但单独RFA组增加。充分表明序贯CIT联合RFA治疗HCC患者的有效性和安全性,显示了对于HCC患者RFA后预防复发的意义。
目前,关于CRA和免疫联合疗法在肝癌治疗中的临床研究较少。Duffy等[43]的研究中,HCC患者接受CRA联合替西木单抗治疗6周后的肿瘤活检提示CD8+T细胞明显增加,显示出临床获益。
此外,一项旨在评价CRA联合同种异体自然杀伤(natural killer,NK)细胞治疗晚期HCC疗效的临床研究结果显示,同种异体NK细胞联合CRA具有协同作用[54],CRA+NK组的中位PFS(9.1个月)明显高于CRA组(7.6个月)(P=0.0107);CRA+NK组的客观缓解率(60.0%)显著高于CRA组(46.1%)(P<0.05);CRA+NK组的疾病控制率(85.7%)显著高于CRA组(69.2%)(P<0.01)。结果显示,联合治疗不仅增强了患者的免疫功能,而且降低了甲胎蛋白(alpha-fetoprotein,AFP)表达,具有良好的临床疗效[54]。类似的疗效获益也在另一项CRA联合DC-细胞因子诱导的NK细胞免疫治疗的研究中被验证[51]。
在小鼠肝癌模型实验中,MWA联合PD-1抑制剂显示出对远处肿瘤的抑制作用,即远隔效应;相较于单独治疗,联合组生存时间显著延长;此外,在外周血中还观察到Th1型细胞因子的升高,脾脏肿瘤抗原特异性T淋巴细胞的数量升高[55];在再攻击试验中,联合组再攻击肿瘤成瘤率降低且成瘤时间延长[55]。在另一项小鼠肝癌模型实验中[56],联合使用MWA、GM-CSF微球和抗CTLA-4,90%的小鼠在同种肿瘤的再攻击试验中显示出显著地生长抑制;双侧荷瘤模型中,联合治疗后50%的小鼠对侧肿瘤被消除。此外,替西木单抗联合MWA治疗难治性胆道癌患者的研究显示,16例患者中,2例(12.5%)得到部分缓解(分别持续8.0个月和18.1个月),5例(31.3%)疾病稳定,其中位PFS和OS分别是3.4个月(95%CI:2.5~5.2)和6.0个月(95%CI:3.8~8.8);外周血免疫细胞亚群分析显示,激活的CD8+T细胞增多[57]。另一项MWA联合细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)治疗HCC的研究显示,在3个疗程的免疫治疗后,MWA+CIK组的外周血T淋巴细胞绝对计数超过单纯MWA组(P<0.05);在MWA治疗前,对照组和联合组患者的外周血淋巴细胞亚群分布差异无统计学意义(P>0.05);在免疫治疗后1~12个月,联合组的某些细胞毒性亚群(CD3+/CD8+、CD8+、CD28+T细胞)比例显著升高,而负调节亚群(CD4+、CD25+T细胞)比例下降(P<0.05);免疫治疗2个疗程后,髓样DC(myeloid DC,MDC)和T淋巴细胞(包括CD3+ CD8+淋巴细胞)的增殖率明显增加(P值均<0.05)[58]。这些免疫亚群的积极变化为未来进一步探索MWA联合免疫疗法的策略提供了新路径。
HIFU是使用超声技术进行局部组织消融的手段,并被纳入治疗实体瘤的非侵入性策略。目前,有关HIFU联合免疫疗法治疗肿瘤协同作用的研究较少。Eranki等[59]发现将HIFU与CTLA-4抗体和PD-L1抗体相结合,可显著增强抗肿瘤反应,将小鼠生存率从0提高至62.5%。然而,单独使用HIFU会引起脾脏和淋巴结NK细胞以及循环IL-2、干扰素-γ和损伤相关分子模式的上调,CD4+Foxp3+、IL-10和血管内皮生长因子-A等免疫调节剂则明显减少。与未治疗组相比,HIFU联合ICIs诱导瘤内CD4+、CD8α+和CD8α+CD11c+细胞及区域淋巴结CD11c+细胞明显增加,循环IL-10减少。此外还发现,与单独使用HIFU或ICIs相比,两者联合使用对双侧肿瘤模型小鼠具有明显远隔效应(生存率61.1%,P<0.001)[59]。
IRE作为一种非热能技术的局部肿瘤疗法,是早期治疗小肝癌的一种有效选择。与热消融技术不同,IRE几乎不受“热沉效应”的影响,并且可以防止邻近热敏结构受损(例如胆管、胆囊和肝包膜等);而细胞外基质很少受到IRE的影响,故保持了肝脏再生和愈合的潜力;因此,对不适应热消融治疗的患者,IRE可以成为一种替代选择[60]。在IRE与免疫联合的探索方面,一项IRE联合同种异体NK细胞治疗不可切除的原发性肝癌安全性和短期疗效的研究中,将40例患者入组并随机分配到IRE组(22例)或IRE-NK组(18例),评估肿瘤生物标志物AFP、糖类抗原19-9、循环肿瘤细胞(circulating tumor cell,CTC)、淋巴细胞数量和功能、生活质量、临床反应、PFS和OS的变化;结果显示IRE-NK组患者的中位PFS和OS显著长于IRE组患者(中位PFS分别是15.1、10.6个月,P=0.018;中位OS分别是23.2、17.9个月,P=0.031)。此外,IRE和NK细胞联合治疗可显著减少循环肿瘤细胞、增强抗肿瘤免疫功能,表明使用IRE和同种异体NK细胞免疫疗法是一个具有前景的联合疗法[61]。
RFA、MWA、CRA、HIFU等消融方式在肝癌所引起的消融相关全身免疫改变得到不同初步证实。在未来,仍需要更多的对比研究,以比较不同消融方式在诱导免疫炎症强度和免疫调节效应特征上的差异,进一步探索最适合与免疫疗法联合应用于肝癌患者的消融方式。
目前,多数研究结论都显示消融和免疫疗法两者联合相对于单独方式在治疗效果上的增益,未来在两者联合策略上的探索应集中考虑两个方向:(1)对于分期较早的肝癌患者,免疫治疗可以助力于消融对病灶的彻底根治,进一步防止肿瘤的残灶复发;(2)对于中晚期肝癌,消融可以减小肿瘤负荷,促进肿瘤环境由“冷”向“热”的转化,提高免疫治疗效率,用以作为联合免疫治疗的综合治疗的一部分。当然,这种结合的模式仍需要进一步研究,从动物研究到大规模的临床试验,明确消融和免疫治疗的最佳应用时间,以期获得能最大程度转化为良好预后的组合策略。



























