比较皮下注射细胞核因子κB受体活化因子配体(RANKL)抑制剂地舒单抗与静脉滴注唑来膦酸,治疗各类型实体瘤骨转移患者的成本-效用。
建立全生命周期的马尔科夫模型。干预组为地舒单抗治疗,对照组为唑来膦酸治疗。基于中国卫生体系视角下,分析医疗成本包括药品费用及给药人工费用、医疗资源利用费用、骨相关事件(SREs)治疗费用、不良反应治疗费用。健康产出采用质量调整生命年(QALYs)、增量成本-效用比(ICUR)和减少SREs发生。数据来源为文献研究及临床专家访谈,按照5%的年贴现率进行贴现,采用单因素敏感性分析和概率敏感性分析验证模型的稳健性。
各癌种加权基础分析结果显示,干预组较对照组可节约成本29 700元,增加0.08 QALYs,ICUR为-371 250元/QALY,SREs事件数减少0.61。前列腺癌、乳腺癌、非小细胞肺癌以及其他实体瘤骨转移患者亚组分析结果与加权平均结果具有一致性。
地舒单抗用于治疗实体瘤骨转移患者较唑来膦酸能够节约医疗成本、增加健康产出,是具有绝对优势的治疗方案。

本刊刊出的文章除特别声明外,不代表主办单位和本刊编委会的观点。本刊如有印刷质量问题,请与本刊编辑部联系调换。
骨转移是恶性肿瘤常见的远处转移之一,常见于乳腺癌、前列腺癌、肺癌等实体瘤患者。骨相关事件(skeletal-related events,SREs)是指在恶性肿瘤骨转移患者中,由于疾病进展带来的一系列骨并发症及治疗的总和,包括病理性骨折、脊髓压迫、骨放疗和骨手术。骨转移患者发生SREs后生存时间可缩短一半[1, 2],且需要多次住院,疾病负担严重[3]。
地舒单抗是首个针对细胞核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)的单克隆抗体[4],可用于治疗实体瘤骨转移。临床研究显示,地舒单抗相比传统药物唑来膦酸能够降低SREs约18%的发生率,并将首次出现SREs的时间延长8.2个月[5, 6, 7]。此外,地舒单抗皮下注射给药,不经肾脏代谢,表现出更好的安全性和依从性。然而,在我国地舒单抗相较唑来膦酸治疗实体瘤骨转移SREs的成本-效用比尚不明确。本研究中从中国卫生体系角度,基于临床数据和专家访谈,通过构建马尔科夫模型,评估地舒单抗对比唑来膦酸治疗实体瘤骨转移患者的成本-效用,以期为临床用药及医保决策提供依据。
本研究以实体瘤骨转移患者为研究对象,包括前列腺癌、乳腺癌、非小细胞肺癌及其他实体瘤(如肾细胞癌、小细胞肺癌)。各癌种的人群分布比例数据依据一项中国的多中心、回顾性流行病学调查[8],当计算单独癌种结果时,对应癌种的权重为100.0%;若计算加权平均结果,则按照前列腺癌8.8%,乳腺癌32.0%,非小细胞肺癌37.9%以及其他实体瘤21.3%的比例进行计算。干预组为地舒单抗治疗,对照组为唑来膦酸治疗。
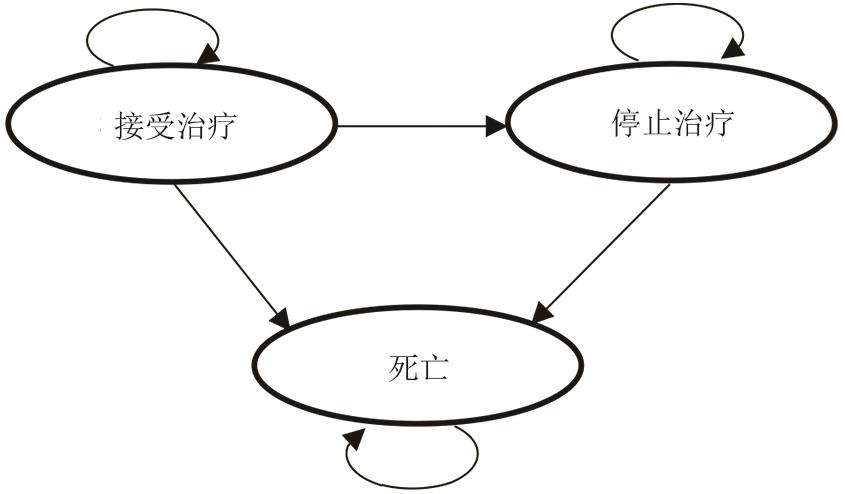
本研究所用的马尔科夫模型根据实体瘤骨转移的特点及自然转归情况进行构建,模型设置了3种状态:接受治疗、停止治疗和死亡状态(图1)。模型周期为4周,患者每经历1个周期后进入下一状态。模型起始状态为“接受治疗”状态,从“接受治疗”状态转换到“停止治疗”状态与两种药品的治疗中止率有关。不同类型实体瘤的模型结构均相同,参数输入值基于特定的肿瘤类型有所不同。模拟时长为患者全部生命周期(15.34年,200个周期),在此之后超过99%的患者过渡到“死亡状态”。模型设定4周为1个周期,并进行半周期矫正。

本研究中,临床数据主要包括SREs发生率、药物治疗不良反应发生率(如颌骨坏死、急性期反应、低钙血症、肾毒性)、治疗中止率和总生存率。
不同癌种接受治疗阶段SREs发生率来自于已发表的临床试验[5, 6, 7],按照每4周1个周期进行折算。由于真实世界中的SREs发生率高于临床试验结果,因此对两组接受治疗阶段的SREs发生率使用真实世界系数进行了校正。对照组接受治疗阶段的SREs发生率,采用校正系数×唑来膦酸临床试验中SREs发生率,校正系数2.01[9];干预组接受治疗阶段的SREs发生率,则采用3个癌种已发表的临床试验中报告的地舒单抗与唑来膦酸在首次和随后发生SREs的比率(rate ratio,RR)进行计算,计算公式为:唑来膦酸接受治疗阶段SREs发生率×RR。
在停止治疗阶段,考虑到患者发生SREs的可能性会增大,需要×停止治疗阶段与接受治疗阶段相比SREs的风险比。由于未检索到停止治疗阶段患者发生SREs的风险与接受治疗阶段的风险比值,本研究采用唑来膦酸与安慰剂(被认为是停止治疗阶段的替代)相比的随机对照临床试验得到的结果作为风险比,即1.75[10, 11, 12]。计算公式为:
对照组停止治疗阶段SREs发生率=唑来膦酸治疗阶段SREs发生率×1.75
干预组停止治疗阶段SREs发生率=地舒单抗治疗阶段SREs发生率×1.75
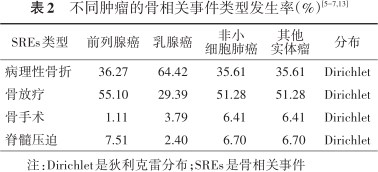
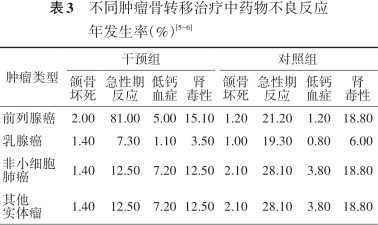
药物不良反应和治疗中止率均来自于临床试验[5, 6, 7]。其中药物不良反应发生率按照临床研究中汇报的药物不良反应发生率×总暴露人年,计算不良反应年发生率,然后按照每4周1个周期进行折算。治疗中止率同样按照每4周1个周期进行折算,对于每个癌种,均采用不包括死亡的所有原因,而中止治疗的患者数除以总人年数。研究仅考虑了对成本和健康结果影响较大的严重不良反应,包括颌骨坏死、急性期反应、低钙血症及肾毒性。由于没有针对非小细胞肺癌的亚组分析,因此假设非小细胞肺癌的SREs分布、治疗中止率、不良反应发生率与其他实体瘤一致(表1, 2, 3)。
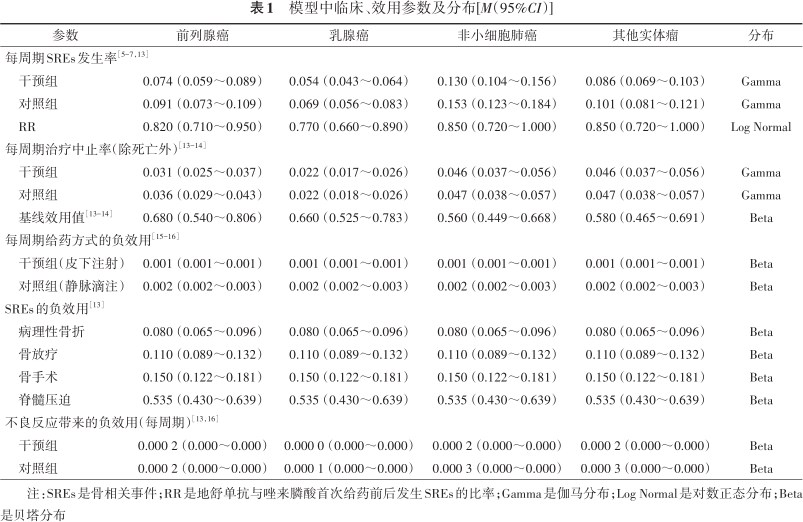
模型中临床、效用参数及分布[M(95%CI)]
模型中临床、效用参数及分布[M(95%CI)]
| 参数 | 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 分布 |
|---|---|---|---|---|---|
| 每周期SREs发生率[5, 6, 7,13] | |||||
| 干预组 | 0.074(0.059~0.089) | 0.054(0.043~0.064) | 0.130(0.104~0.156) | 0.086(0.069~0.103) | Gamma |
| 对照组 | 0.091(0.073~0.109) | 0.069(0.056~0.083) | 0.153(0.123~0.184) | 0.101(0.081~0.121) | Gamma |
| RR | 0.820(0.710~0.950) | 0.770(0.660~0.890) | 0.850(0.720~1.000) | 0.850(0.720~1.000) | Log Normal |
| 每周期治疗中止率(除死亡外)[13, 14] | |||||
| 干预组 | 0.031(0.025~0.037) | 0.022(0.017~0.026) | 0.046(0.037~0.056) | 0.046(0.037~0.056) | Gamma |
| 对照组 | 0.036(0.029~0.043) | 0.022(0.018~0.026) | 0.047(0.038~0.057) | 0.047(0.038~0.057) | Gamma |
| 基线效用值[13, 14] | 0.680(0.540~0.806) | 0.660(0.525~0.783) | 0.560(0.449~0.668) | 0.580(0.465~0.691) | Beta |
| 每周期给药方式的负效用[15, 16] | |||||
| 干预组(皮下注射) | 0.001(0.001~0.001) | 0.001(0.001~0.001) | 0.001(0.001~0.001) | 0.001(0.001~0.001) | Beta |
| 对照组(静脉滴注) | 0.002(0.002~0.003) | 0.002(0.002~0.003) | 0.002(0.002~0.003) | 0.002(0.002~0.003) | Beta |
| SREs的负效用[13] | |||||
| 病理性骨折 | 0.080(0.065~0.096) | 0.080(0.065~0.096) | 0.080(0.065~0.096) | 0.080(0.065~0.096) | Beta |
| 骨放疗 | 0.110(0.089~0.132) | 0.110(0.089~0.132) | 0.110(0.089~0.132) | 0.110(0.089~0.132) | Beta |
| 骨手术 | 0.150(0.122~0.181) | 0.150(0.122~0.181) | 0.150(0.122~0.181) | 0.150(0.122~0.181) | Beta |
| 脊髓压迫 | 0.535(0.430~0.639) | 0.535(0.430~0.639) | 0.535(0.430~0.639) | 0.535(0.430~0.639) | Beta |
| 不良反应带来的负效用(每周期)[13,16] | |||||
| 干预组 | 0.000 2(0.000~0.000) | 0.000 0(0.000~0.000) | 0.000 2(0.000~0.000) | 0.000 2(0.000~0.000) | Beta |
| 对照组 | 0.000 2(0.000~0.000) | 0.000 1(0.000~0.000) | 0.000 3(0.000~0.000) | 0.000 3(0.000~0.000) | Beta |
注:SREs是骨相关事件;RR是地舒单抗与唑来膦酸首次给药前后发生SREs的比率;Gamma是伽马分布;Log Normal是对数正态分布;Beta是贝塔分布
不同瘤种的基线健康效用值、药物治疗不良反应带来的负效用值来自于文献[13, 14],是根据前列腺癌、乳腺癌及其他实体瘤的临床试验中患者的EQ-5D数据进行合并分析的结果。给药方式(静脉滴注和皮下注射)带来的疼痛、SREs带来的负效用值来自于Matza等[15, 16]文献研究结果(表1)。
本研究基本情景中,采用中国卫生体系角度进行分析,故只考虑直接医疗成本,包括药品费用及给药人工费用、医疗资源利用费用、SREs相关治疗费用和严重不良反应相关治疗费用。其中地舒单抗价格来自2020年国家医保谈判后地方挂网价格,唑来膦酸有多个厂家生产,采用不同厂家药品的销售量加权来计算价格,两种药品目前均无患者援助项目。给药人工费用来自于《上海市医疗机构医疗服务项目和价格汇编(2017年版)》[17]。对于医疗资源利用费用、SREs相关治疗费用和严重不良反应相关治疗费用,根据癌症种类不同,通过9名来自北京、上海、广州三级甲等医院的主治及以上级别临床专家、医师调研获得,取专家访谈结果的平均值进行计算。模型中所用的成本数据参数见表4。
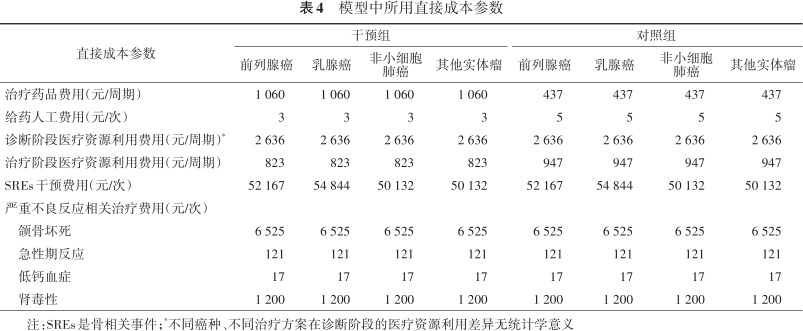
模型中所用直接成本参数
模型中所用直接成本参数
| 直接成本参数 | 干预组 | 对照组 | ||||||
|---|---|---|---|---|---|---|---|---|
| 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | |
| 治疗药品费用(元/周期) | 1 060 | 1 060 | 1 060 | 1 060 | 437 | 437 | 437 | 437 |
| 给药人工费用(元/次) | 3 | 3 | 3 | 3 | 5 | 5 | 5 | 5 |
| 诊断阶段医疗资源利用费用(元/周期)* | 2 636 | 2 636 | 2 636 | 2 636 | 2 636 | 2 636 | 2 636 | 2 636 |
| 治疗阶段医疗资源利用费用(元/周期) | 823 | 823 | 823 | 823 | 947 | 947 | 947 | 947 |
| SREs干预费用(元/次) | 52 167 | 54 844 | 50 132 | 50 132 | 52 167 | 54 844 | 50 132 | 50 132 |
| 严重不良反应相关治疗费用(元/次) | ||||||||
| 颌骨坏死 | 6 525 | 6 525 | 6 525 | 6 525 | 6 525 | 6 525 | 6 525 | 6 525 |
| 急性期反应 | 121 | 121 | 121 | 121 | 121 | 121 | 121 | 121 |
| 低钙血症 | 17 | 17 | 17 | 17 | 17 | 17 | 17 | 17 |
| 肾毒性 | 1 200 | 1 200 | 1 200 | 1 200 | 1 200 | 1 200 | 1 200 | 1 200 |
注:SREs是骨相关事件;*不同癌种、不同治疗方案在诊断阶段的医疗资源利用差异无统计学意义
研究的主要指标包括患者治疗总费用、质量调整生命年(quality-adjusted life years,QALY)、增量成本效用比(incremental cost-utility ratio,ICUR)和避免SREs事件发生数。
ICUR计算公式为:
:干预组治疗方案成本;:对照组治疗方案成本;:干预组治疗方案健康产出;:对照组治疗方案健康产出。
ICUR的结果将与支付意愿(willingness to pay,WTP)阈值进行比较,当ICUR<WTP时,干预组相较对照组成本-效用更佳。本研究WTP阈值为217 314元(2020年中国人均GDP的3倍)。
研究对成本和效用进行了贴现,贴现率为5%。
为评价模型的稳定性,本研究根据参数范围及其分布特征进行单因素敏感性分析(deterministic sensitivity analysis,DSA)和概率性敏感性分析(probabilistic sensitivity analysis,PSA)。成本参数采用Gamma分布,效用参数采用Beta分布。DSA中参数的变化范围为基础值±20%,贴现率设定为0%~8%。PSA中分别使用基本情景假设和参数变化取值运行了1 000次模拟分析,结果以散点图和成本效用可接受曲线表示。
各癌种加权基础分析显示,地舒单抗比唑来膦酸具有绝对的经济优势,可节约成本29 700元,增加0.08 QALYs,ICUR为-371 250元/QALY,可避免的SREs事件数为0.61。前列腺癌、乳腺癌、非小细胞肺癌以及其他实体瘤骨转移患者亚组分析结果与加权平均结果具有一致性(表5)。
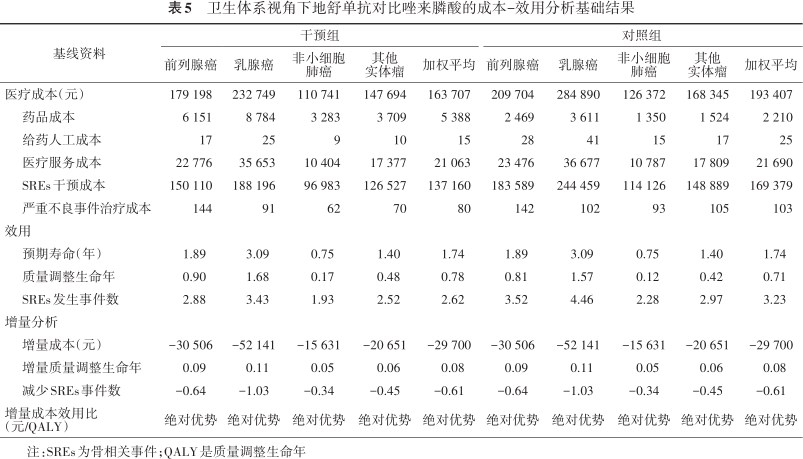
卫生体系视角下地舒单抗对比唑来膦酸的成本-效用分析基础结果
卫生体系视角下地舒单抗对比唑来膦酸的成本-效用分析基础结果
| 基线资料 | 干预组 | 对照组 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 加权平均 | 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 加权平均 | |
| 医疗成本(元) | 179 198 | 232 749 | 110 741 | 147 694 | 163 707 | 209 704 | 284 890 | 126 372 | 168 345 | 193 407 |
| 药品成本 | 6 151 | 8 784 | 3 283 | 3 709 | 5 388 | 2 469 | 3 611 | 1 350 | 1 524 | 2 210 |
| 给药人工成本 | 17 | 25 | 9 | 10 | 15 | 28 | 41 | 15 | 17 | 25 |
| 医疗服务成本 | 22 776 | 35 653 | 10 404 | 17 377 | 21 063 | 23 476 | 36 677 | 10 787 | 17 809 | 21 690 |
| SREs干预成本 | 150 110 | 188 196 | 96 983 | 126 527 | 137 160 | 183 589 | 244 459 | 114 126 | 148 889 | 169 379 |
| 严重不良事件治疗成本 | 144 | 91 | 62 | 70 | 80 | 142 | 102 | 93 | 105 | 103 |
| 效用 | ||||||||||
| 预期寿命(年) | 1.89 | 3.09 | 0.75 | 1.40 | 1.74 | 1.89 | 3.09 | 0.75 | 1.40 | 1.74 |
| 质量调整生命年 | 0.90 | 1.68 | 0.17 | 0.48 | 0.78 | 0.81 | 1.57 | 0.12 | 0.42 | 0.71 |
| SREs发生事件数 | 2.88 | 3.43 | 1.93 | 2.52 | 2.62 | 3.52 | 4.46 | 2.28 | 2.97 | 3.23 |
| 增量分析 | ||||||||||
| 增量成本(元) | -30 506 | -52 141 | -15 631 | -20 651 | -29 700 | -30 506 | -52 141 | -15 631 | -20 651 | -29 700 |
| 增量质量调整生命年 | 0.09 | 0.11 | 0.05 | 0.06 | 0.08 | 0.09 | 0.11 | 0.05 | 0.06 | 0.08 |
| 减少SREs事件数 | -0.64 | -1.03 | -0.34 | -0.45 | -0.61 | -0.64 | -1.03 | -0.34 | -0.45 | -0.61 |
| 增量成本效用比(元/QALY) | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 |
注:SREs为骨相关事件;QALY是质量调整生命年
DSA分析结果支持基础分析结果的稳健性,各参数变动范围内未出现结果的扭转,影响ICUR的主要变量是地舒单抗停止治疗阶段SREs发生率相较治疗阶段SREs发生率的比值(图2)。
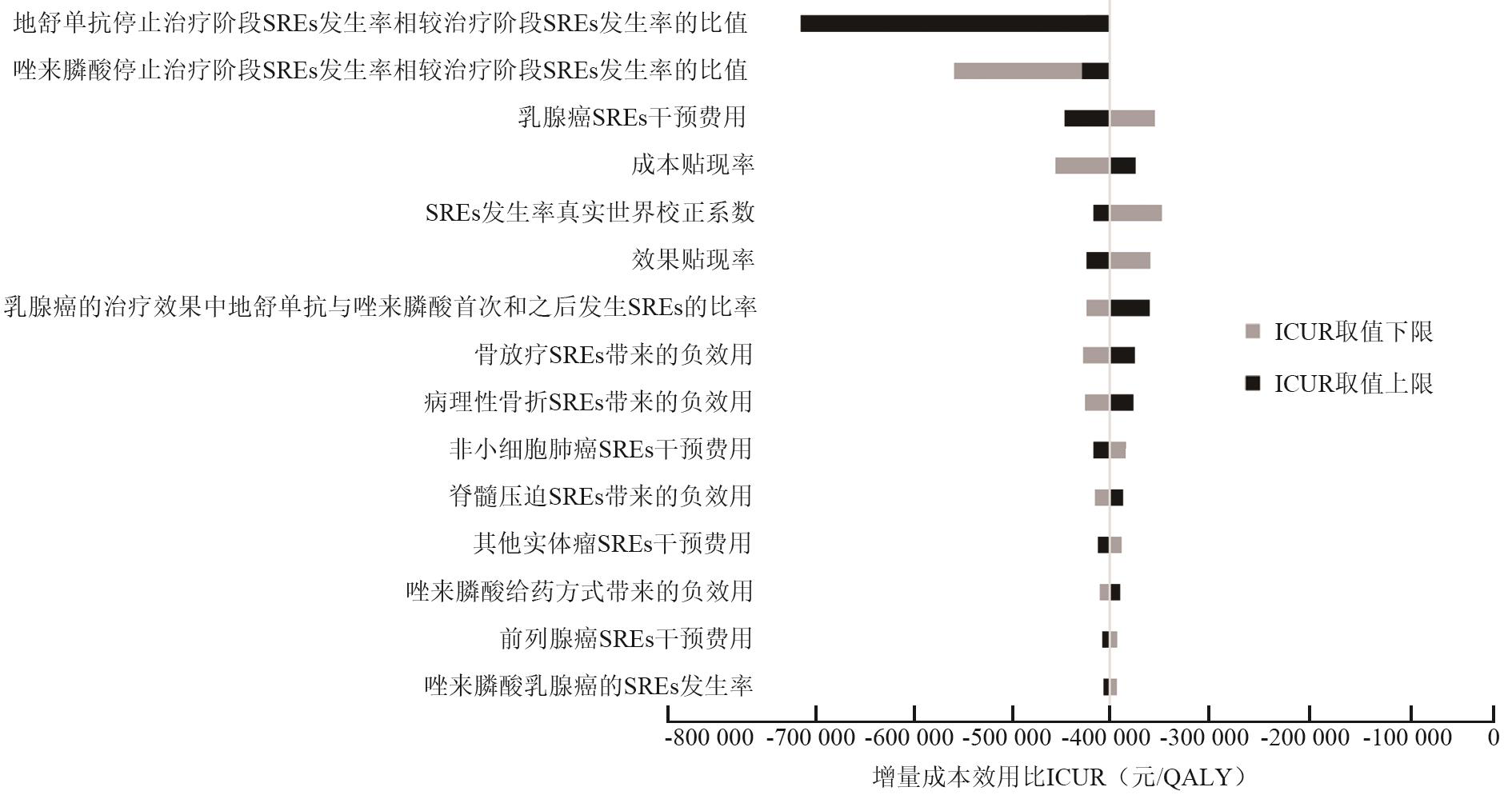

注:SREs为骨相关事件,ICUR为增量成本效用比;QALY是质量调整生命年
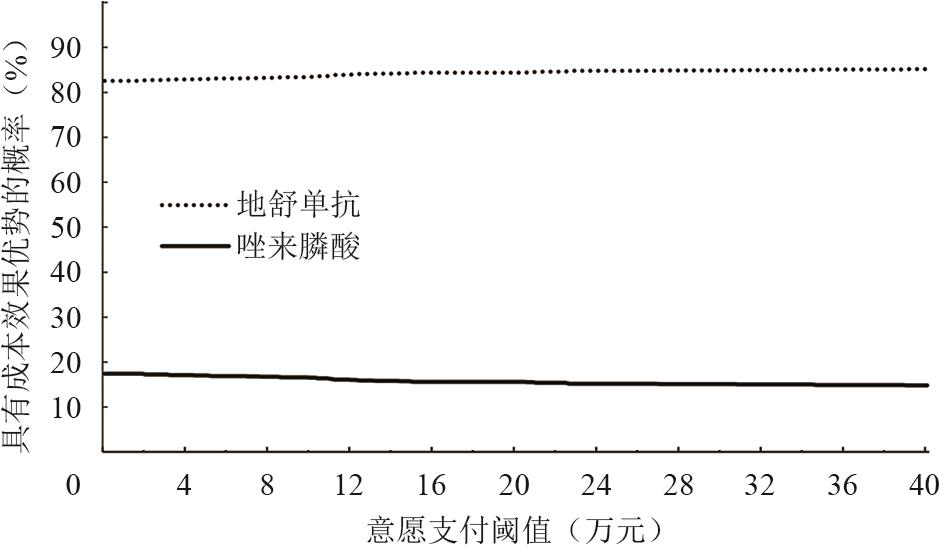
PSA结果支持基础结果的稳健性,在基本卫生体系视角和3倍GDP的WTP阈值下,地舒单抗相比唑来膦酸更具成本-效用的概率为86%,在WTP阈值变动范围内地舒单抗具有成本-效用的概率均更高(图3)。

本研究基于全社会视角下探讨了间接成本,包括照护成本、误工成本,间接成本数据源于临床专家访谈和《2019年国民经济和社会发展统计公报》。各癌种加权平均结果显示,使用地舒单抗可节约间接成本,提高患者的生命质量。全社会视角下的成本数据见表6,成本-效用分析结果见表7。
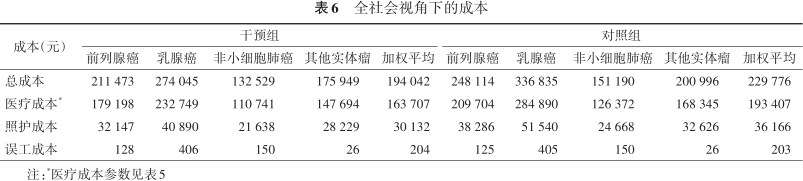
全社会视角下的成本
全社会视角下的成本
| 成本(元) | 干预组 | 对照组 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 加权平均 | 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 加权平均 | |
| 总成本 | 211 473 | 274 045 | 132 529 | 175 949 | 194 042 | 248 114 | 336 835 | 151 190 | 200 996 | 229 776 |
| 医疗成本* | 179 198 | 232 749 | 110 741 | 147 694 | 163 707 | 209 704 | 284 890 | 126 372 | 168 345 | 193 407 |
| 照护成本 | 32 147 | 40 890 | 21 638 | 28 229 | 30 132 | 38 286 | 51 540 | 24 668 | 32 626 | 36 166 |
| 误工成本 | 128 | 406 | 150 | 26 | 204 | 125 | 405 | 150 | 26 | 203 |
注:*医疗成本参数见表5
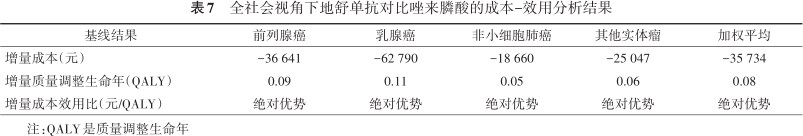
全社会视角下地舒单抗对比唑来膦酸的成本-效用分析结果
全社会视角下地舒单抗对比唑来膦酸的成本-效用分析结果
| 基线结果 | 前列腺癌 | 乳腺癌 | 非小细胞肺癌 | 其他实体瘤 | 加权平均 |
|---|---|---|---|---|---|
| 增量成本(元) | -36 641 | -62 790 | -18 660 | -25 047 | -35 734 |
| 增量质量调整生命年(QALY) | 0.09 | 0.11 | 0.05 | 0.06 | 0.08 |
| 增量成本效用比(元/QALY) | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 | 绝对优势 |
注:QALY是质量调整生命年
晚期恶性实体肿瘤患者多发生骨转移,而骨转移的发生常预示着患者生活质量的下降和生存期的缩短。约65%~75%的前列腺癌[18]、乳腺癌[19]患者,30%~40%的肺癌患者会发生骨转移[20]。若不予以干预,约64%的乳腺癌骨转移患者[21]、约49%的前列腺癌骨转移患者将在24个月内经历SREs;约44%肺癌和其他实体肿瘤(不包括乳腺癌和前列腺癌)的骨转移患者将在9个月内经历SREs[22]。SREs严重影响患者的身体功能,降低患者生活质量,也导致患者病死风险升高。
在控制原发肿瘤疾病的同时,如何合理治疗骨转移、减少SREs尤为重要。在地舒单抗上市之前,长期以来临床主要使用传统药物双膦酸盐治疗骨转移患者,以唑来膦酸为代表的第三代双膦酸盐在临床广泛使用。唑来膦酸可用于治疗恶性肿瘤引起的骨转移,给药方式为静脉滴注,临床上常见的不良反应为肾脏损害,故在肾功能降低的患者中禁用。地舒单抗的上市改变了骨转移治疗现状,疗效、安全性和简便性优于传统药物,为临床治疗带来新的选择。
本研究中评估了地舒单抗与唑来膦酸在中国治疗实体瘤骨转移患者的成本-效用,结果显示地舒单抗虽然单价较高,但能够节约医疗成本和间接成本,同时带来更多的健康产出,在前列腺癌、乳腺癌、非小细胞肺癌及其他实体瘤中均具有成本-效用优势。
此外,笔者讨论了包括间接成本的全社会视角情景下地舒单抗与唑来膦酸对比的结果,地舒单抗比唑来膦酸的成本优势更显著。间接成本包括照护成本与误工成本,主要是因SREs住院花费的照护成本。除了乳腺癌,包括前列腺癌、非小细胞肺癌在内的其他实体瘤平均患病年龄较高,退休及无需工作的人群占比较大,所需照护成本较高。
本研究在研究时长(终生)、模型结构(马尔科夫模型)、对照药品(唑来膦酸)等研究设计上与美国、捷克等其他国家经济性评估模型具有可比性,且研究结论一致。Stopeck等[14]通过构建“接受治疗-停止治疗-死亡”的马尔科夫模型模拟前列腺癌、乳腺癌和非小细胞肺癌患者终生的生存状态,结果表明在3个癌种中地舒单抗与唑来膦酸相比均可减少SREs发生的事件数,提高患者的生命质量,ICUR分别为49 405美元/QALY、78 915美元/QALY、67 931美元/QALY。虽然美国卫生体系没有给出确切的ICUR阈值,但基于已有的事例来看,地舒单抗被认为具有成本-效用优势。Cristino等[23]构建了同样的三状态马尔科夫模型,以前列腺癌、乳腺癌及其他实体瘤为研究对象,基于捷克卫生体系的角度和终生的研究时限来看,地舒单抗在3个癌种中相对于唑来膦酸,仍然具有成本-效用优势。Stopeck等[24]研究表明,从全社会及卫生体系两种研究角度,地舒单抗相比唑来膦酸在治疗前列腺癌、乳腺癌及其他实体瘤骨转移上均具有成本-效用优势,地舒单抗的药品成本虽高于唑来膦酸,但因减少了SREs的事件数而一定程度上节约了成本。
本研究具有一定的局限性。研究所用的健康效用值来自非中国人群的数据,可能无法完全反映中国患者的真实情况;由于缺乏针对非小细胞肺癌的SREs各类型的分布,因此研究中假设非小细胞肺癌的SREs分布与其他实体瘤相同;唑来膦酸未来可能面临国家集采,模型显示唑来膦酸集采后价格不会影响地舒单抗的成本效果优势,但不排除本研究中其他成本数据受国家政策或医疗服务水平提升等因素影响,从而带来研究结果的改变。