
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
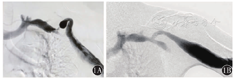
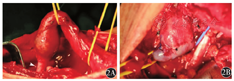
患者 男性,37岁,因"上臂透析通路突发全段红肿热痛,震颤消失1 d"于2017年5月31日入院。查体见上臂头静脉全程红肿膨大,触痛明显,搏动及震颤均消失。患者曾因"肾小球肾炎"致肾功能衰竭,于2000年开始建立左上肢动静脉内瘘(arteriovenous fistula,AVF)进行规律血液透析,其间因通路失功多次进行重建术。曾行左腕部头静脉-桡动脉自体动静脉内瘘、左前臂贵要静脉移位内瘘、左前臂近肘部桡动脉-头静脉AVF及左肘部肱动脉-头静脉自体动静脉内瘘(brachiocephalic fistula,BCF)。自2015年开始(BCF手术后1年)逐渐出现静脉压升高。患者于2017年3月就诊我院,查体见左肘部AVF吻合口可及震颤,上臂头静脉扩张伴迂曲,搏动感强。数字减影血管造影(digital subtraction angiography,DSA)提示左头静脉弓狭窄(cephalic arch stenosis,CAS)(图1A),但患者未遵医嘱及时手术。本次入院诊断为上臂头静脉血栓形成。2017年6月5日在全麻下手术治疗。取左锁骨下横切口,自锁骨下方分离胸大肌并向下牵引,切开胸锁筋膜,显露锁骨下动静脉及头静脉弓汇入部,注意勿伤及胸肩峰动静脉及胸外侧神经。充分游离头静脉弓汇入两端各约1.5 cm长锁骨下静脉并阻断,切除头静脉弓闭塞段(图2A),Fogarty取栓导管取出头静脉内血栓,肝素盐水冲洗管腔后,修剪头静脉弓冗长段并与锁骨下静脉建立端-侧吻合,吻合口约1.0 cm(图2B)。术后内瘘恢复震颤,流量可满足透析要求,于2017年6月12日出院。手术后1个月复查DSA显示吻合口形态良好(图1B)。


头静脉弓最常见的解剖类型是头静脉单支弓经三角-胸大肌肌间沟,穿过锁胸筋膜汇入腋静脉或锁骨下静脉。头静脉弓区瓣膜数量至少2倍于同等长度的远端头静脉区[1]。CAS好发于BCF术后,占BCF失功原因的15%~40%;而腕部AVF仅有2%发生CAS[2]。Bennett等[3]研究69例CAS患者,BCF术后1年内发生CAS占14.5%,术后3年以上发生CAS占44.9%。该研究将CAS分为4型,以Ⅳ型(头静脉弓末端)最常见。BCF术后易发生CAS的确切机制不明,可能和以下原因有关:(1)弓状结构引起局部湍流和剪切力改变损伤内膜;(2)头静脉弓内瓣膜增生病变导致管腔狭窄;(3)三角-胸大肌肌间沟、锁胸筋膜等结构压迫并限制头静脉弓适应性扩张。CAS常见临床表现:透析流量下降,头静脉出现搏动,透析穿刺点不易止血,上臂头静脉瘤样扩张伴迂曲,静脉压升高,通路血栓形成等。
血液透析通路相关CAS治疗主要有经皮血管腔内球囊扩张成形术(percutaneous transluminal angioplasty,PTA)及开放手术治疗。单纯PTA治疗CAS效果有限,一项荟萃分析指出PTA治疗12个月,一期通畅率为0~38%[4]。扩张压力通常较高[(>15 atm),1 atm=101.325 kPa],易发生静脉破裂(14.9%)[1]。目前尚无充分的证据显示PTA联合金属裸支架植入能提高远期通畅率。而联用聚四氟乙烯覆膜支架1年,一期通畅率可提高至32%~72.7%[4]。头静脉弓支架近端深入腋静脉或锁骨下静脉过多导致后者血栓形成是最常见的并发症,并直接威胁同侧上肢透析通路或影响后期通路建立。
文献报告CAS手术治疗12个月,一期通畅率为39%~82%[4],术后因再狭窄而治疗的概率低(由3.5次PTA/人年降至1次PTA/人年)[5]。故有学者将开放手术作为治疗CAS的一线治疗方式[2]。头静脉移位术是常见术式,即将近心端头静脉经皮下隧道与上臂腋静脉或贵要静脉吻合,如此可保留原吻合口及透析穿刺点,避免应用透析导管过渡。但该术式可影响后期依赖贵要-腋静脉系统建立的血透通路。头静脉-颈内或颈外静脉转流术需使用人工血管,目前不作为治疗CAS一线术式,仅当同侧锁骨下静脉同时存在病变时使用[2]。
此患者头静脉弓短段闭塞病变,且在长期静脉高压作用下呈"Z"形冗长迂曲,故采取病变段切除、头静脉-锁骨下静脉原位重建术进行修复。该术式优势在于去除头静脉弓高发病变段,解除局部解剖压迫,纠正迂曲静脉造成的血流动力学异常,同时保护贵要-腋静脉系统,不影响后期利用其建立血透通路。术中切开锁胸筋膜后注意保护胸肩峰动脉、静脉及胸外侧神经。本例患者治疗结果表明,头静脉弓原位移植可作为治疗CAS的手术方式之一。


























