
开窗与分支技术已成为复杂腹主动脉瘤腔内治疗的重要手段。通过移植物的开窗或分支插接腔内重建内脏动脉,将锚定区延伸至腹主动脉内脏段或跨过内脏段达到腹腔动脉上方,既隔绝了瘤腔血流又保证了分支血管的通畅性。随着技术的推广和证据的积累,逐步证实开窗与分支技术腔内修复复杂腹主动脉瘤的安全性和有效性。但两种技术在适应证选择、技术实施、远期结果上也存在一定的不确定性。本文旨在描述开窗与分支技术治疗复杂腹主动脉瘤的历史、理念、解剖适应证和临床证据,同时对两种技术存在的限制进行探讨。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
复杂腹主动脉瘤(complex abdominal aortic aneurysm,cAAA)的概念很广,但当前广义cAAA的界定主要还是取决于动脉瘤近端瘤颈的解剖结构,包括瘤颈的长度、直径、瘤颈夹角、局部钙化以及附壁血栓的范围等[1]。本文主要讨论了cAAA腔内修复术中开窗和分支技术(fenestrated and branched endovascular aortic repair,F/B EVAR)的应用现状与评价[1]。
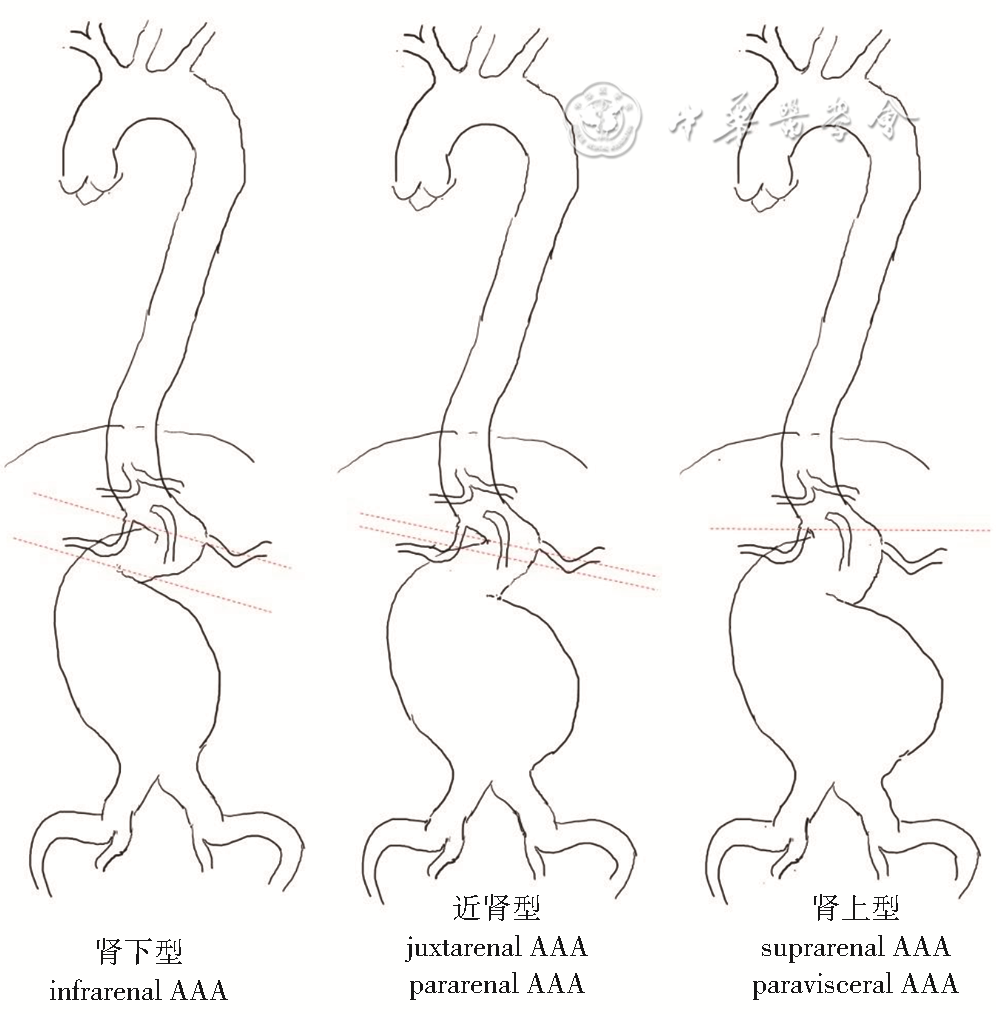
早期cAAA分型较多,包括肾下短瘤颈型(瘤颈<10 mm)、近肾型(juxtarenal abdominal aortic aneurysm;紧邻肾动脉开口,瘤颈为0 mm)、肾上型(suprarenal abdominal aortic aneurysm),其中肾上型AAA又可分为跨肾型(pararenal abdominal aortic aneurysm;瘤体近端位于肾动脉开口以上但未累及肠系膜上动脉)、跨内脏动脉型(paravisceral abdominal aortic aneurysm;瘤体近端位于肾动脉及肠系膜上动脉开口上方但未累及腹腔干动脉)、Ⅳ型胸腹主动脉瘤(thoracoabdominal aortic aneurysm,TAAA;指瘤体近端位于腹腔干动脉以上、膈肌以下)[2, 3]。
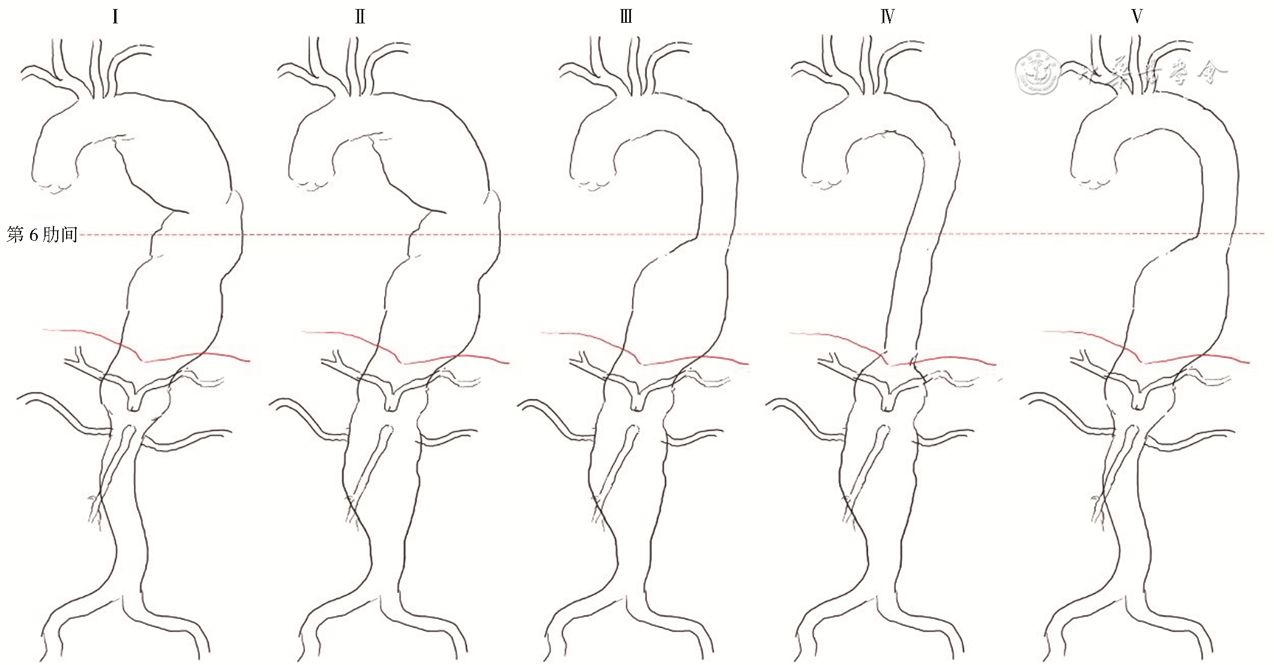
2019年,欧洲血管外科学会(European Society for Vascular Surgery,ESVS)腹主动脉瘤临床管理指南将cAAA分为近肾型AAA和肾上型AAA两类(图1)[4],前者主要指短瘤颈AAA(瘤颈为0~10 mm,包括近肾型或跨肾型),而后者主要指瘤体近端累及单条或两条肾动脉以上的AAA,包括肾上型(或称跨内脏动脉型)及部分未累及膈肌的Crawford Ⅳ型TAAA,由于Crawford分型(图2)概念解释模糊(部分学者认为AAA累及肾动脉以上即为Ⅳ型TAAA[5]),因此两者界限并不严格。

注:AAA为腹主动脉瘤

1996年,Park等[6]首次报道肾动脉开窗支架治疗近肾型AAA。1999年,Brown等[7]在此基础上设计和制作了开窗型腔内移植物,并由美国Cook公司在常规腔内修复器材基础上发展为Zenith开窗腔内移植物用于近肾型AAA的EVAR治疗。目前全球各种开窗型支架几乎都是在Zenith开窗支架的经验基础之上发展起来的。
早期经验发现,单纯开窗的主体支架容易移位导致分支血管的丢失,裸支架虽可以加固主体支架的锚定,减少位移[8],但后期断裂率较高易导致分支血管闭塞,使得密封性更好的覆膜支架最终成为开窗桥接移植物的首选[9]。
FEVAR早期主要以医师改良的腔内移植物(physician-modified endograft,PMEG)为主[10],2012年Zenith定制开窗支架(美国Cook公司)获得美国FDA批准上市后[11],厂家定制的腔内移植物(company-manufactured device,CMD)因其更严谨的方案设计,更低的30 d死亡率和主动脉相关再干预风险逐渐成为个体化定制支架的主流[12, 13]。近年来为了解决定制器材的局限性,众多非定制(off-the-shelf)开窗型支架腔内移植物[如p-Branch(美国Cook公司)、weflow-JAAA(杭州唯强公司)等]正在被研发用于近肾型AAA的临床治疗。
1. 理念或原理:FEVAR通过开窗使得腔内移植物的近端锚定区延伸至肾动脉或内脏动脉区域,从而在保留主动脉重要分支血供的同时降低Ⅰa型内漏风险[14]。
鉴于开窗主体与桥接支架间的非完全密封性,FEVAR技术的前提条件是瘤体尚未累及靶血管(目前认为开窗血管下缘距离瘤体近端至少4~5 mm)[10],此外,还要求靶血管与主动脉分出的角度接近垂直(研究表明靶血管成角越大,远期分支相关并发症及不良事件风险越高[15]),两者缺一,则FEVAR不应当作为首选。
2 解剖适应证与禁忌证:
FEVAR解剖适应证:(1)近端锚定区:肾下主动脉颈部无瘤样扩张,近端颈部长度4~10 mm;近端瘤颈部直径19~31 mm;近端瘤颈长轴与瘤体长轴成角<45°;近端瘤颈长轴与肾上主动脉长轴成角<45°;(2)远端锚定区:双侧髂动脉远端锚定区长度>10 mm,同侧髂动脉直径9~21 mm,对侧髂动脉直径7~21 mm;(3)入路血管:可通过20F(外径8.1 mm)的鞘管。
FEVAR解剖禁忌证:肾动脉主干长度<13 mm,肾动脉直径<4 mm,存在无法牺牲的副肾动脉(可能牺牲的单肾肾实质体积>40%或双肾肾实质体积>25%);内脏分支血管解剖变异。
1. 定制开窗:目前国外上市的的定制开窗支架主要有Zenith Fenestration(ZFEN,美国Cook公司)和Anaconda fenestration(AFEN,日本Terumo公司)两款,遗憾的是目前这两款支架在国内均未能普及。
ZFEN:是全球最早的一款临床定制开窗支架,也是国内唯一获得注册证的开窗支架。该产品采用模块化设计,由开窗主体、分叉主体和髂动脉分支三部分组成。其最大的优势在于其前端后释放装置,能够使得开窗支架在释放过程中旋转及上下调节以完成开窗血管的准确对位;其次,Zenith支架近端带倒刺的不锈钢裸区能够提高开窗支架的稳定性,配合模块化设计,能最大限度地降低主动脉血流冲击的影响,减少位移,提高开窗分支的通畅率。
AFEN:不同于ZFEN的模块化设计,这款开窗支架是由主体和髂支两部分组成。其特点有:(1)开窗主体采用无支撑结构设计,不存在金属网对开窗位置的限制,同时还能够适应更加扭曲的瘤颈(瘤颈90°成角适应证);(2)近端特殊的控释装置使得主体支架在完全释放后仍可以自由调整近端位置,同时近端支架呈完全开放状态,对于一些瘤颈成角较大的病例,能够行肱动脉入路以方便操作,同时可以更加从容地对开窗血管依次进行各项操作。
2. 非定制开窗支架:国外用于非定制的开窗型支架腔内移植物主要有p-Branch(美国Cook公司,双肾+肠系膜上动脉三开窗+腹腔干开槽)与Ventana(美国Endologix公司,双肾小开窗+1大开槽,目前已退市),前者近端封闭效果好(100%),但解剖符合率差(61%),后者解剖符合率好(91%),但近端封闭率差(61%)。
WeFlow-JAAA(杭州唯强公司)支架系统(NCT05179967)是一款我国自主研发的模块化非定制支架,严格来说,这款产品是开窗与分支技术的混合,但其适应证主要还是以近肾型AAA为主。Weflow-JAAA采用肠系膜上动脉改良开窗(3 mm内嵌迷你袖带)、腹腔干动脉开槽联合双肾动脉内嵌分支的设计。双肾动脉内分支设计能大大减少远期Ⅲ型内漏的发生,肠系膜上动脉窗口增加了3 mm内嵌袖带,能够进一步提高开窗与桥接支架的密封性,对于一些肠系膜上动脉水平主动脉轻度扩张的解剖结构也能适用,从而大大扩展了这款支架系统的整体解剖适应范围。相较前两款非定制支架,无论在适应证还是长期耐受性方面均有更大的优势。
1. 总体证据:2014年,Belczak等[16]的系统评价显示FEVAR与开放手术治疗近肾AAA在30 d死亡率、手术持续时间、住院时间、术后肾功能不全及晚期死亡率方面差异均无统计学意义,且于24个月的中位随访期内显示开放手术的晚期死亡率明显高于FEVAR(23% 比 16%)。2019年,Jones等[17]的 Meta分析结果也显示FEVAR对比开放手术治疗cAAA在30 d死亡率及远期生存率方面差异无统计学意义。ESVS2019关于腹主动脉瘤临床管理指南也推荐FEVAR技术作为近肾型AAA治疗的首选方案[4]。
2. 定制支架
ZFEN:2019年,Varkevisser等[18]的一项回顾性研究表明FEVAR治疗cAAA的临床结局与肾下型AAA常规EVAR的临床结局相似,且在30 d死亡率、术后肾功能障碍及整体并发症发生率方面优于开放手术。2021年,Oderich等[19]报道了ZFEN治疗近肾型AAA(瘤颈为4~14 mm)5年随访结果,共67例患者入组,技术成功率为100%,30 d死亡率为1.5%,中位随访时间为59.8个月,5年免于动脉瘤相关死亡率为(96.8±2.3)%,原发性和继发性的肾动脉通畅率分别为(82.7±4.1)%和(95.7±2.1)%,免于二次干预率为(63.5±7.2)%,随访期间发现Ⅰa型内漏1例(1.5%),Ⅰb型内漏1例(1.5%),器械移位2例(3%),动脉瘤囊增大4例(6%),无动脉瘤破裂或中转开放手术。
AFEN:2017年,Midy等[20]报道了EFEFA研究的两年随访结果,16个中心共86例cAAA患者,共重建292条分支血管,重建成功率为99.3%,围术期技术成功率为86.0%,住院及30 d死亡率分别为3.5%及7%,12及24个月的估计总生存率分别为88.3%和85.2%,靶血管通畅率分别为97.2%和96.3%,免于动脉瘤相关再干预率分别为96.3%和88%。2018年,Colgen等[21]报道了AFEN治疗101例cAAA的一年随访结果,311条靶血管,255条开窗重建(195条肾动脉,49条肠系膜上动脉,11条腹腔干动脉),30 d临床成功率(无死亡、Ⅰ或Ⅲ型内漏)为94%(3例死亡,3例内漏),延迟临床成功率(二次干预后或Ⅰ、Ⅲ型内漏自行消失)为97%,1年生存率为91%,靶血管通畅率为97.6%。总之,AFEN相关临床证据的近中期效果尚可,远期效果有待验证。
3 非定制支架:
(1)p-Branch(美国Cook公司):2021年Sveinsson等[22]报道的p-Branch 5年随访数据结果显示,23例患者(12例择期,11例急诊),21例完成随访,技术成功率为91%(择期100%,急诊82%),随访时间为(45±24.4)个月,1年和5年靶血管通畅率分别为96.4%和94%,随访期间无动脉瘤相关死亡率发生,但随访期间48%(10/21)的患者至少接受过一次再干预治疗。表明在择期和急诊情况下,对于特定人群的近肾型AAA使用p-Branch是安全有效的,但较高的再干预率不可忽视。
(2)Ventana(美国Endologix公司):Ventana开窗支架与p-Branch一样存在再干预风险较高的问题。Quiñones-Baldrich等[23]报道的Ventana多中心临床研究结果显示出了与其他移植物相似的二次干预率(12.9%),但实际的再干预率应当更高,因为其试验结果迫使Endologix公司不得不提前终止试验,目前该移植物已退出注册。
(3)weflow-JAAA(杭州唯强公司):Weflow-JAAA人体首次临床试验(NCT04745546)共纳入复杂AAA患者15例,手术技术成功率100%,30 d内无严重不良事件或死亡发生。术后随访6个月内2例死于肾衰竭,均评定与器械无关;随访12个月新增死亡1例,原因不明;术后30 d至12个月未发现Ⅰ、Ⅲ型内漏,分支血管均通畅,无二次干预发生。以上结果证实weflow-JAAA治疗cAAA具有近中期安全性及有效性,远期结果尚待观察,目前其二期多中心临床试验(NCT05179967)正在进行中。
BEVAR的初衷是治疗分支起源于瘤体的TAAA。1997年,Inoue等[25]首次报道使用分支技术重建腹腔干动脉治疗胸降段主动脉瘤术后吻合口假性动脉瘤;2001年,Chuter等[26]首次报道了自制多分支支架治疗Ⅲ型TAAA。而后越来越多的研究报道BEVAR治疗TAAA及cAAA的经验,并在其发展过程中演化出了轴向分支(分支平行贴合于主体支架并朝向头端)、螺旋分支(由主体支架背面发出绕行至前方直接面向内脏分支开口)、逆向分支(轴向分支的分支支架开口朝向头端)及内嵌分支等不同类型[27]。
BEVAR在延长锚定区的同时能加强主体支架与分支支架之间的完整性和密封性,且尽可能地减少主动脉与靶血管之间的夹角,改善血流动力学,相较于FEVAR,BEVAR更加适合瘤体累及分支血管开口的肾上型AAA及TAAA。
1.外向分支:对于外向分支系统,由于长袖带的存在,其相应的分支开口水平需要较实际靶分支血管高出1~2 cm以利于操作,使得主体支架实际的锚定区要远高于靶血管水平,同时靶血管水平的主动脉腔直径也要明显大于主体支架直径以保证一定的器材操作空间。
2. 内嵌分支:有时患者的解剖条件既不符合开窗也不适合外向分支时(如靶分支血管发出角度过锐且同水平主动脉直径较小或存在覆盖过多胸降段主动脉从而导致脊髓缺血、截瘫可能时),内嵌分支技术则提供了一种可行的选择。内分支技术无需靶血管部位主动脉直径过大,同时还能使得主体支架于同水平保持更大的直径,减少分支上方所需覆盖的主动脉范围,在一些需要覆盖腹腔干动脉上方主动脉的患者中降低了截瘫的风险。但内分支本身及相应的预置导管需要占据主体支架腔内空间的缺点决定了内嵌分支的数量不宜过多,否则存在限制主体支架及输送系统(直径)相关解剖适应性的风险。
目前腔内治疗肾上型AAA及TAAA的分支支架系统主要有以t-Branch[28](美国Cook公司)、TAMBE[29](美国Gore公司)为代表的全外分支(轴向分支)系统,E-nside[30](德国Jotec公司)为代表的全内嵌分支系统,以及G-branch[31](深圳先健公司;NCT04731636)为代表的混合分支系统。
1.外分支支架系统:t-Branch全外分支的设计要求腹腔干动脉上方需要有足够的空间,加上其近端能够与上方支架充分重叠的超长锚定区,更适合Ⅰ~Ⅲ型TAAA的腔内修复。但近端锚定区过长(12 cm)的设计易导致术后脊髓缺血高风险[28];而TAMBE系统采用全轴向分支的设计,优化了近端锚定区长度(5.5 cm),降低了截瘫风险,但正因如此使其无法与近端支架充分桥接导致解剖学适用范围减少[32]。
2.内分支支架系统:E-nside采用全内嵌分支技术,从而可以结合开窗与外分支技术的优势,虽然E-nside主要是应用于TAAA,但其肾动脉段的主体支架直径仅24 mm,有利于其应用于部分近肾型及肾上型的cAAA紧急治疗[30]。E-nside的另一大优势就是四个内嵌分支的预置导管设计,对于内嵌分支而言,预置导管使得操作难度大大降低,但四内嵌分支系统(内嵌分支与预置导管的占位效应)对于主体直径的影响也限制了其主动脉及入路相关的解剖适应性[33]。此外,E-nside四内嵌分支和长锚定区设计对于术后截瘫以及远期主体远端血流的影响尚待观察[30]。
3.混合分支支架系统:G-branch支架系统采用模块化设计,双侧肾动脉采用略长的外分支设计,肠系膜上动脉及腹腔干动脉采用预置导丝的内嵌分支设计,结合半释放装置能够使得整个支架系统在腔内进行灵活调整与分支超选[31]。内嵌与外分支相结合的方式,使其能同时兼顾近端锚定区及分支血管水平主动脉的不同直径需求,同时保证相对较细的输送系统,加上两种近端主体长度规格(50 mm和70 mm),使得其解剖适应证同时覆盖更多类型的TAAA及cAAA[31]。
1.总体证据:2017年,Budtz-Lilly等[34]报道其单中心腔内(开窗或分支)治疗cAAA的研究结果并总结了2010年至2017年文献报道的6篇FEVAR或BEVAR相关的大型或多中心研究,发现与FEVAR相比,BEVAR具有相当的技术成功率(95% 比 99%),但24个月的中位随访结果显示BEVAR远期死亡率明显升高(27% 比 18%),与开放手术接近(27% 比 29%)。
2.非定制外分支支架系统(t-Branch):2020年,Konstantinou等[35]报道的关于t-Branch治疗TAAA的系统评价显示30 d死亡率为5.8%(95%CI:2.5%~10.0%),脊髓缺血发生率为12.2%(95%CI:4.1%~23.2%),永久性截瘫发生率为1.3%(95% CI:0%~8.7%),随访(15±7)个月,中期死亡率为6.9%(95% CI:2.4%~12.8%),再干预率为5.7%(95% CI:1.7%~11.4%),急诊手术的30 d死亡率为9%~14%。以上结果表明,外分支支架系统治疗TAAA是一种安全有效的治疗手段。
3.非定制内分支支架系统(E-nside):E-nside的设计理念和经验来源于E-xtra Design Engineering(德国Jotec公司)定制开窗-分支支架系统治疗TAAA成功经验[36],但其本身的临床证据很少,其前瞻性、多中心临床研究INNER-B(NCT04383145)目前正在进行中。
4.混合分支支架系统(G-branch):G-branch目前已完成首次人体临床试验(FIM:NCT04731636),二期多中心临床试验(NCT05054985)已正式开始。前期FIM研究共纳入14例患者,其中近肾及肾上型AAA共10例,TAAA4例,技术成功率100%,无30 d死亡病例,其中10例患者完成6个月随访,6例完成1年随访,1例患者因脑梗死死亡,余患者均存活,随访期间无内漏、永久性截瘫、分支血管闭塞或狭窄发生。
PMEG在国外已逐步被CMD取代[12, 13],但在国内市场,由于国产CMD自身发展缓慢以及进口CMD的推广不足,目前国内腔内治疗cAAA主要还是以PMEG为主,但PMEG本身存在法理和伦理方面的争议,其临床应用也缺乏严格的质量控制与行业监管,完全取决于术者的个人经验,一旦计划不周或改良不当,很可能造成灾难性后果;同时,支架改良过程中的时间成本及感染风险的增加也不容忽视。因此,笔者建议PMEG应当在大的经验丰富的主动脉中心,选择解剖适合、风险可控的患者人群进行实施操作,同时伦理审批的过程也必不可少。
综上所述,F/B EVAR重建内脏动脉分支是cAAA及胸腹主动脉腔内修复技术发展主流;鉴于定制支架的长周期和PMEG的复杂性,“off-the-shelf”器材必然成为未来器材发展的方向,如何解决器材的普适性、非定制性、技术可行性、安全与有效性是长期追求的目标。
所有作者均声明不存在利益冲突



























