
探讨新生儿期发生脑积水患儿的临床特点和病因,比较不同病因脑积水的治疗方法及结局。
收集我院2011年9月至2015年6月住院治疗并在新生儿期发病的脑积水患儿临床资料,记录患儿一般情况、影像学检查结果、治疗方法及疗效。出院后3~6个月对患儿进行随访,比较不同病因所致脑积水对不同治疗方法的疗效和结局,并对足月儿和早产儿脑积水发病原因及治疗方法进行回顾性分析。
共纳入脑积水患儿38例,其中早产儿23例(60.5%),足月儿15例(39.5%)。脑积水病因中颅内出血18例(47.4%),颅内感染11例(28.9%),颅内出血合并颅内感染8例(21.1%),甲基丙二酸尿症合并同型半胱氨酸血症1例(2.6%)。足月儿与早产儿脑积水病因比较差异无统计学意义(P>0.05)。14例颅内出血后脑积水患儿通过连续腰穿、脑室外引流、脑室储液囊反复放液治愈。颅内出血合并颅内感染后脑积水和颅内感染后脑积水患儿分别为9例和6例,最终需行永久分流术;这两种病因引起的脑积水患儿行永久分流术比例明显高于单纯颅内出血患儿(P<0.05)。出院后37例(97.4%)脑积水患儿无复发,16例(42.1%)存在不同程度的神经系统后遗症。
颅内出血和颅内感染是新生儿脑积水的主要病因,单纯颅内出血后脑积水较少需行永久分流术治疗。即使患儿脑积水缓解,也很有可能存在神经系统后遗症。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脑积水是脑脊液生成过多或循环吸收障碍,导致脑脊液在脑室系统或蛛网膜下腔内淤积并不断增多、压力升高,脑室扩大形成。新生儿脑积水主要临床表现为头围进行性增大,前囟扩大隆起,颅缝开裂,颅骨变形,双眼落日征。严重可伴有大脑功能障碍,表现为癫痫、呕吐、抽搐、斜视、眼球震颤等。脑积水对新生儿的主要危害是脑实质受压和颅压增高。如治疗不及时可造成神经系统严重损害,最终导致四肢中枢性瘫痪、智力落后和发育障碍等[1],甚至死亡。目前对脑积水的治疗方法主要包括连续腰穿放脑脊液、脑室外引流、脑室储液囊(Ommaya囊、脑室帽状腱膜下储液囊)反复放液等,经上述治疗脑脊液回流仍然不畅者,需行脑室腹腔分流(ventriculo-peritoneal shunt,V-P)术等永久性引流手术[2]。目前国内有关新生儿脑积水治疗的研究报道较少,其原因可能为国内开展新生儿或小婴儿神经外科手术的医院较少,故多数新生儿脑积水不能得到有效治疗。我院儿科与神经外科多年合作,新生儿及婴儿脑积水可得到内外科联合治疗。本研究总结我院2011年9月至2015年6月住院治疗的新生儿期发病的脑积水患儿,对脑积水的发病原因、治疗过程及随访结果进行分析。
选择2011年9月至2015年6月我院新生儿病房收治的新生儿期发病的脑积水患儿。纳入标准:经临床症状、颅脑超声、头颅CT或MRI诊断,患儿有头围进行性增大,或同时有前囟扩大、张力增高、颅缝增宽等颅内压增高表现[3]。脑室扩大的颅脑超声诊断标准为[4]:(1)侧脑室前角明显扩张,有张力感,前角圆钝,甚至呈球形;(2)旁矢状面侧脑室深大于2 mm,冠状面中线至侧脑室外缘与中线至同侧颅骨内板距离之比增大,一般大于1/3;(3)冠状面第三脑室增宽,大于3 mm。
根据病例记录和影像学检查结果确定脑积水病因,分为颅内出血、颅内感染、颅内出血合并颅内感染和其他因素4类。
(1)连续腰穿:脑积水无明显脑实质受压或颅内压增高症状者,可予反复腰穿。治疗初期可连续3 d进行腰穿,每次放液量10 ml左右[5]。每日测量头围,每隔1~3 d行头颅超声动态监测脑室变化,若脑室形态稳定或缩小,可延长放液间隔直至停止腰穿。如连续腰穿3次后脑室仍进行性扩张伴脑实质受压,则行脑室脑脊液引流。(2)侧脑室外引流:对连续腰穿无效、影像学检查显示脑室继续扩张、脑实质明显受压或合并明显颅内压增高症状者,由神经外科医生行侧脑室脑脊液直接外引流,即将脑脊液直接引流至引流袋中。脑脊液引流量10~15 ml/(kg·d)[6],根据前囟张力、超声监测脑室大小调整引流量。引流14~21 d后,夹闭引流管。3 d后通过超声观察脑室变化,若侧脑室无扩张可拔除引流管,如脑室再次扩大提示需长期引流,应进一步治疗。(3)埋置脑室储液囊反复放液:对腰穿无效、侧脑室外引流后脑实质受压减轻、影像学检查脑室仍缓慢扩张者,可由神经外科医生在头皮帽状腱膜下放置Ommaya囊,通过反复从储液囊抽取脑脊液来控制头围过大或颅内压过高。操作时用注射器缓慢回抽脑脊液,时间>10 min,放液总量一般为10 ml/(kg·d),每日2~3次[7]。根据头围和头颅超声显示的脑室扩张程度调整放液,同时给予相应补液。对脑室炎患儿可通过Ommaya囊穿刺脑室内给予抗生素或激素。住院期间患儿家属学会抽取脑脊液,出院后自行操作,每日测量头围,定期行头颅超声和脑脊液化验检查。如抽取脑脊液逐渐减少可试停抽液,停止抽液后影像学检查示脑室大小稳定2~3个月后可拔除Ommaya囊。如引流超过3~6个月仍不能停止抽液则提示需永久性分流,可行永久分流术[7]。(4)脑室帽状腱膜下引流术(ventriculosubgaleal shunt,VSG):其适应证同Ommaya囊。方法为在帽状腱膜和骨膜之间分离出一个囊腔作为储液囊,把脑室液引流至帽状腱膜下,经过帽状腱膜穿刺抽取脑室液,另部分脑脊液可通过帽状腱膜回吸收[8]。当帽状腱膜下储液囊减小或消失,脑室液常规和生化正常,脑室大小稳定超过2个月则可拔除引流管。如抽液引流超过2个月,脑积水未缓解,则需行永久分流术。(5)V-P分流术:即永久性分流术,适用于上述治疗失败,脑脊液常规和生化基本正常患儿,待体重增长,心肺疾病、贫血、感染等合并症控制后行V-P分流术。
主要采用来院复查和电话随访2种方式进行,均在治疗结束后3~6个月随访患儿的脑积水恢复情况及神经系统后遗症。
应用SPSS 16.0统计软件。计数资料以例数(%)表示,组间比较采用Fisher确切概率法,两两比较采用Benferroni方法对检验水准进行调整。P<0.05为差异有统计学意义。
共纳入脑积水患儿38例,其中男25例,女13例。起病日龄1 h~28 d,脑积水确诊日龄3 h~2个月,平均17 d。其中早产儿23例(60.5%),胎龄28~36周,出生体重1 000~3 900 g;足月儿15例(39.5%),胎龄37~41周,出生体重2 200~3 800 g。临床表现为头围增大、前囟隆起张力增加16例,反应差13例,惊厥8例,呼吸不规则3例,喷射性呕吐2例,肌张力异常17例,双眼有落日征6例。
颅内出血后脑积水18例(47.4%),颅内感染后脑积水11例(28.9%),颅内出血合并颅内感染8例(21.1%),甲基丙二酸尿症合并同型半胱氨酸血症1例(2.6%)。早产儿和足月儿脑积水病因比较差异无统计学意义(P>0.05)。见表1。
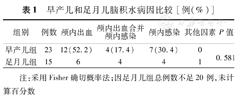
早产儿和足月儿脑积水病因比较[例(%)]
早产儿和足月儿脑积水病因比较[例(%)]
| 组别 | 例数 | 颅内出血 | 颅内出血合并颅内感染 | 颅内感染 | 其他因素 | P值 |
|---|---|---|---|---|---|---|
| 早产儿组 | 23 | 12(52.2) | 4(17.4) | 7(30.4) | 0 | 0.581 |
| 足月儿组 | 15 | 6 | 4 | 4 | 1 |
注:采用Fisher确切概率法;因足月儿组总例数不足20例,未计算百分数
3例轻度脑积水患儿入院后观察数日脑积水稳定,无颅内压增高症状,未予特殊治疗。
9例患儿经腰穿放脑脊液3~34次(其中1例院外腰穿放液34次脑积水未缓解,转入我院),平均放液6次,每次放液量5~15 ml。其中5例治疗后脑室变小并稳定,治愈出院;4例治疗无效改为侧脑室外引流或Ommaya囊治疗。
16例患儿行侧脑室外引流术,持续时间3~28 d,平均21 d,引流量5~20 ml/(kg·d)。其中4例引流后脑室逐渐变小,拔除引流管后脑室大小稳定出院;12例患儿治疗无效行其他引流术。
16例患儿经Ommaya囊反复穿刺抽脑脊液,10~20 ml/(kg·d),每天2~3次,共抽液30~90 d,平均72 d。其中4例治疗后脑室逐渐变小,拔除Ommaya囊后脑室无扩大出院,Ommaya囊放置时间5~16个月;另12例需长期引流,脑积水不能完全缓解,最终行永久分流术(V-P分流术),2例颅内感染并脑室炎全身抗生素治疗效果欠佳,经Ommaya囊穿刺给予抗生素和激素感染控制后行V-P分流术。
7例患儿行VSG治疗,引流持续时间8~16个月,其中2例因脑脊液在帽状腱膜下自行吸收而无需抽液,脑室逐渐变小,稳定2个月后拔除引流管;5例患儿需持续放液最终行V-P分流术。
20例患儿行永久分流术,均在直接外引流或储液囊引流失败后实施。其中17例行V-P分流术,手术年龄2~10个月,平均6个月;另3例患儿分别行枕大池腹腔分流术、中脑导水管疏通术(外院)和第三脑室底造瘘术(外院)。
侧脑室外引流后颅内新鲜出血和引流管堵塞合并脑室新鲜出血各1例;因引流过快出现呼吸暂停1例;Ommaya囊置入术中出现呼吸抑制和引流管堵塞各1例;因抽液过量出现囟门凹陷伴烦躁哭闹1例;拔除Ommaya囊术中出现呼吸抑制1例;VSG术后继发全身感染和因引流管过短拔除引流管失败各1例;V-P分流术后发生颅内感染1例(病原不明);术后分流管弯折堵管行调管术4例。
早产儿组脑积水患儿中12例(52.2%)行永久分流术,足月儿组8例(8/15)行永久分流术,两组比较差异无统计学意义(P>0.05)。
从治疗结局看,单纯颅内出血后脑积水治疗效果较好,多数不需要做永久分流术而治愈;单纯颅内感染后脑积水和颅内出血合并颅内感染脑积水患儿治疗效果较差,多数患儿最终需要永久分流术才可缓解脑积水。单纯颅内出血脑积水患儿行永久分流术治疗例数低于颅内出血合并颅内感染及单纯颅内感染患儿,差异均有统计学意义(P<0.05)。单纯颅内感染后脑积水患儿需永久分流术的比例低于颅内出血合并颅内感染患儿,但差异无统计学意义(P>0.05)。见表2。
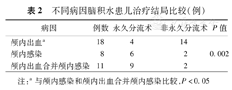
不同病因脑积水患儿治疗结局比较(例)
不同病因脑积水患儿治疗结局比较(例)
| 病因 | 例数 | 永久分流术 | 非永久分流术 | P值 |
|---|---|---|---|---|
| 颅内出血a | 18 | 4 | 14 | |
| 颅内感染 | 8 | 6 | 2 | 0.002 |
| 颅内出血合并颅内感染 | 11 | 9 | 2 |
注:a与颅内感染和颅内出血合并颅内感染比较,P<0.05
所有患儿出院后随访3~6个月,仅1例颅内出血合并颅内感染患儿经Ommaya囊反复穿刺引流6月余仍无效,外院行第三脑室底造瘘术,术后脑室仍有缓慢扩张;其余37例经上述方法治疗后均完全缓解,有效率97.4%(37/38)。但有42.1%(16/38)患儿出现不同程度神经系统后遗症,表现为癫痫及不同程度的运动、认知、语言和听力障碍,无死亡病例。
新生儿脑积水是新生儿脑室内出血、颅内感染、脑肿瘤、先天畸形(Dandy-Walker畸形、Chiari畸形、颅底软骨发育异常、矢状窦闭锁)等疾病的常见并发症[9]。据报道25%~74%脑室内出血早产儿会发生出血后脑积水[10],主要为Ⅲ~Ⅳ度颅内出血,而足月儿脑室内-脑室周围出血后脑积水也屡有报道,一般认为与产伤和围产期缺氧有关[11]。脑室内出血发生后,积血中的小凝血块、血液等随着脑脊液流动,可随脑脊液循环进入第三脑室阻塞中脑导水管,进入蛛网膜下腔引起蛛网膜炎,引起脑脊液循环不良和聚积,导致脑积水的发生。本组38例脑积水患儿中有颅内出血26例(68.4%),由此可见颅内出血是导致新生儿脑积水的主要原因。本组患儿中致脑积水第2位的原因为颅内感染,包括单纯感染和颅内出血后并发感染共19例(50.0%)。感染后脑积水的形成与病原菌侵入脑膜引起毛细血管扩张充血及通透性增加,并产生纤维蛋白等炎症渗出物,堵塞脑脊液循环通路造成梗阻有关;另外炎症因子的局部刺激引起蛛网膜、蛛网膜下腔、蛛网膜绒毛、软脑膜及神经根周围间隙等部位的纤维增生、黏连,甚至发生闭塞,引起脑脊液回流和吸收障碍,亦可加重脑积水[2]。近年来有机酸代谢异常引起的脑积水也有报道,本组有1例甲基丙二酸尿症合并同型半胱氨酸血症引起脑积水,其机制与同型半胱氨酸造成血管壁破坏,血管弹性下降引起脑脊液回流障碍及颅内压增高有关[12]。
新生儿脑积水治疗主要有内科保守及外科手术治疗。保守治疗时利用药物减少脑脊液分泌效果较差,临床应用较少[13];在脑积水早期通过连续腰穿引流脑脊液既可降低颅内压,同时还可将脑脊液中陈旧血液和增高的蛋白质排出,减轻梗阻,使脑脊液循环通畅[5]。但长时间连续腰穿有可能造成感染,故不宜长期操作。本组患儿中有9例最初采用连续腰穿治疗,5例脑积水得到缓解,避免了外科手术治疗。如连续腰穿无效,需采用外科治疗,常见的外科治疗包括脑室外引流、Ommaya囊引流,近年我院开展了VSG引流[14]。侧脑室外引流可以把脑脊液较快引流到体外,尤其是脑室内存在较多血凝块时用其他方法常不能有效引流出血凝块,而侧脑室外引流的引流管相对较粗,可使脑室中的血凝块流出,有可能解除梗阻,使脑积水缓解[6],本组4例(4/16)患儿通过脑室外引流使梗阻性脑积水再通,避免后续手术治疗。如脑室内无血凝块且需较长时间引流,可选择头皮下放置储液囊,目前多用Ommaya囊。其优点是可经囊反复穿刺抽取脑脊液,降低脑室内压力,减轻脑积水对脑室周围脑实质的压迫,还可通过储液囊脑室内注射抗生素和激素,治疗脑室炎取得不错效果。VSG是通过人工分离帽状腱膜制造一个储液囊,使脑室内引流出来的脑脊液暂时储存在帽状腱膜下,部分自行吸收。当帽状腱膜下囊腔引流出的脑脊液超过其吸收能力时,帽状腱膜下囊肿增大,压力会增高,如头颅超声示脑积水加重,则需经帽状腱膜抽吸囊肿中的脑脊液减压。这种方法是近年来国内开展的外科姑息引流术,刚用于新生儿脑积水,我院近年也开展了这一新的手术方法。与传统的引流方法相比,此法引流出的脑脊液有可能全部被帽状腱膜吸收,可避免常规穿刺抽液,减少皮肤感染风险,同时脑脊液通过帽状腱膜自动吸收,可保持水和电解质平衡[8]。本组有7例行VSG引流,2例脑积水完全缓解,其中1例因引流管较短拔除困难。目前此法应用较少,还需不断积累经验。如果上述引流仍不能彻底缓解脑积水,则需行永久性分流手术。最常用的永久分流术为V-P分流术,接受此手术的患儿需终身携带引流管,且随着患儿体格增长需更换引流管,此方法是在其他治疗方法都无效时不得不施行的手术。
目前,国内外学者对新生儿颅内出血[7,8]、颅内感染等原因所致脑积水患儿的治疗进展报道颇多[15]。诸多神经外科医生依据脑积水病因、梗阻部位对永久分流术式的选择作了大量研究[16,17,18,19],但关于新生儿脑积水病因与治疗方法的横向相关性研究报道较少。本研究显示,新生儿颅内出血后脑积水治疗效果相对较好,可经脑室外引流、储液囊穿刺引流等过渡性引流方法治愈。其原因可能为颅内出血后脑积水以机械性阻塞为主,通过连续腰穿及外科引流,放出脑脊液中陈旧血液和增高的蛋白质,引流出过多的脑脊液而降低颅内压。不仅减轻对脑室周围脑实质的压迫,还通过脑脊液的不断稀释减轻梗阻,并为脑脊液吸收途径代偿性改变赢得时间,最终避免被动的永久外科分流术。而颅内感染导致的脑积水,由于炎症引起脑室内炎性渗出物较多,不仅可以阻塞脑脊液循环通路引起回流障碍,还可局部刺激引发蛛网膜、软脑膜炎,继发纤维组织增生黏连致闭塞,引起脑脊液吸收障碍,且常伴脑室炎,梗阻不易解除。如果在颅内出血的基础上合并颅内感染,治疗难度将明显增加。多数经过渡性引流不能解除脑脊液梗阻,大多数最终需要永久性分流,即V-P分流。V-P分流是通过皮下隧道将分流管的两端分别置入侧脑室和腹腔内,中间阀门可以控制分流压力,将脑室内无法正常吸收的脑脊液引流到腹腔,通过腹腔内大网膜吸收。此方法适合大多数类型的脑积水,是神经外科治疗脑积水的常用手术方式,也是目前最有效的方法[20]。神经内镜下第三脑室底造瘘术通过颅骨钻孔,在第三脑室底部人为造一瘘口,使第三脑室与蛛网膜下腔直接相通,形成新的脑脊液循环通路,已经成为神经外科最经典的脑室内手术[21]。因可避免患儿生长发育需再次手术换管和终身带管对患儿心理影响的不利因素,加之其微创、安全和有效,第三脑室底部造瘘术正在逐渐替代传统的V-P分流术[22],成为儿童梗阻性脑积水的首选治疗方式。3个月以下婴儿手术成功率为25%,但手术成功患儿最终仍有约20%需行V-P分流[23]。
从本组病例治疗结果看,上述治疗方法都可能出现合并症。侧脑室引流可出现血凝块堵管和引流管位置不适引起新的出血,Ommaya囊可出现引流管堵塞或过度引流,VSG可有全身感染和引流管在帽状腱膜下较短造成拔管困难,V-P分流可存在感染、分流管堵塞及脑脊液分流过度或不足等并发症[24]。因此儿科和神经外科医生应共同讨论,根据患儿年龄、发病原因、身体状况制订有针对性的个体化治疗方案。从随访结果看,虽然本组新生儿脑积水经过治疗,多数得到缓解,但仍有42%(16/38)患儿出现癫痫及不同程度的运动、认知、语言和听力障碍等神经系统后遗症。究其原因可能是治疗前脑积水已对脑实质造成压迫和损伤,脑积水缓解只能减少之后的脑损伤,对已经形成的脑损伤则无治疗作用。因此对有脑积水高危因素的新生儿应加强脑室监测,及时发现及时治疗。
综上所述,新生儿脑积水多数因颅内出血和感染所致,早产儿与足月儿脑积水病因无明显差异。大多数单纯颅内出血患儿无需永久分流术治疗即可缓解脑积水,而颅内感染,尤其是颅内出血合并颅内感染后脑积水预后相对较差,患儿最终需行永久分流术才能缓解病情。脑积水即使缓解也很有可能出现神经系统后遗症,早期诊断、早期治疗是改善预后的关键[25]。



























