
探讨外周放置中心静脉导管(PICC)后合并胸腔积液患儿临床特点及诊疗过程,从而加强医护人员的认识。
选择2006年5月至2016年6月本院新生儿重症监护病房PICC后合并胸腔积液患儿的临床资料进行回顾性分析。
共纳入PICC置入后合并胸腔积液患儿4例,均为早产儿,于放置PICC后第2~ 4天突然出现呼吸困难,未见发热、反应差等全身感染征象。床旁胸部X线片及超声检查均提示右侧胸腔积液;胸腔穿刺可抽出乳糜样液体,颜色为乳白色或淡黄色;拔除PICC导管同时胸腔穿刺放液后呼吸困难好转。
PICC置管后出现不明原因进行性加重的呼吸困难需考虑合并胸腔积液,明确诊断后应尽早拔除PICC导管。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
外周放置中心静脉导管(peripheally inserted central catheter,PICC)指经上肢贵要静脉、肘正中静脉、头静脉、肱静脉、颈外静脉(新生儿可经下肢大隐静脉、头部颞静脉、耳后静脉等)穿刺置管,导管尖端定位于上腔静脉或下腔静脉。PICC技术于20世纪70年代首次应用于美国新生儿科[1],1996年在我国新生儿临床开展[2],其操作方便、安全、保留时间长、可耐受高渗药物、钙剂、血管活性药物等。虽然PICC具有侵入性,存在导管堵塞、异位、静脉炎、感染等并发症风险,但合并胸腔积液较少见。现将我院新生儿重症监护病房(NICU)PICC后合并胸腔积液患儿的诊疗情况总结如下。
选择2006年5月至2016年6月我院NICU行PICC后合并胸腔积液的患儿。入选标准:日龄≤28 d,临床表现有心率增快,呼吸困难,频发呼吸暂停,且程度重;行PICC穿刺侧出现不同程度颈部、肩部、胸廓软组织肿胀;胸部X线片提示胸腔积液,行胸腔穿刺可抽出乳糜样液体。呼吸暂停诊断标准[3]:呼吸停止>20 s,伴有心率减慢<100次/min或出现青紫、血氧饱和度降低和肌张力低下。
收集患儿性别、胎龄、出生体重、放置PICC日龄、PICC置入情况、PICC导管情况、合并胸腔积液时临床表现、胸腔积液特点、实验室检查、诊疗经过等临床资料进行回顾性分析。
共纳入PICC后合并胸腔积液患儿4例,其中男2例,女2例;均为早产儿,胎龄31~33周,体重1 010~1 700 g。于生后第3~8天留置PICC,3例患儿出现送管困难,管端未送至预计位置,位于第1、2胸椎水平;1例导管尖端位于第3胸椎。发生病情变化前所有患儿呼吸平稳,未见胸腔积液征象。
我院2006年以来共放置PICC 567例,发生胸腔积液4例,发生率为0.7%(4/567)。
4例患儿于置管后第2~4天出现胸腔积液症状,表现为突然出现的呼吸困难、紫绀明显,频繁呼吸暂停;3例患儿呼吸衰竭需行气管插管机械通气,1例需行无创机械通气;复查胸部X线片提示PICC管端位置位于第1、2胸椎水平。临床特点见表1。
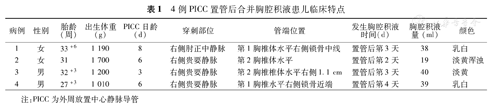
4例PICC置管后合并胸腔积液患儿临床特点
4例PICC置管后合并胸腔积液患儿临床特点
| 病例 | 性别 | 胎龄(周) | 出生体重(g) | PICC日龄(d) | 穿刺部位 | 管端位置 | 发生胸腔积液时间(d) | 胸腔积液量(ml) | 颜色 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 女 | 33+6 | 1 190 | 8 | 右侧肘正中静脉 | 第1胸椎体水平右侧锁骨中线 | 置管后第3天 | 38 | 乳白 |
| 2 | 女 | 31 | 1 700 | 6 | 右侧贵要静脉 | 第2胸椎体水平 | 置管后第2天 | 19 | 淡黄浑浊 |
| 3 | 男 | 32+3 | 1 200 | 3 | 右侧贵要静脉 | 第2胸椎椎体水平右侧1.1 cm | 置管后第3天 | 40 | 淡黄 |
| 4 | 男 | 27+3 | 1 010 | 6 | 右侧贵要静脉 | 第1胸椎水平右侧锁骨近端 | 置管后第4天 | 39 | 乳白 |
注:PICC为外周放置中心静脉导管
4例患儿PICC后合并胸腔积液时均无发热、反应差等全身感染征象。仅1例患儿胸腔积液中有核细胞数明显增高(病例4),血常规及CRP正常,血培养均为阴性。见表2。
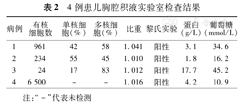
4例患儿胸腔积液实验室检查结果
4例患儿胸腔积液实验室检查结果
| 病例 | 有核细胞数 | 单核细胞(%) | 多核细胞(%) | 比重 | 黎氏实验 | 蛋白(g/L) | 葡萄糖(mmol/L) |
|---|---|---|---|---|---|---|---|
| 1 | 961 | 42 | 58 | 1.041 | 阳性 | 3.1 | 34.6 |
| 2 | 234 | 55 | 45 | 1.010 | 阳性 | 1.8 | 16.2 |
| 3 | 24 | 17 | 83 | 1.012 | 阳性 | 17.7 | 45.2 |
| 4 | 6 500 | - | - | 1.016 | 阳性 | 4.2 | 10.9 |
注:"-"代表未检测
所有患儿行床旁胸部X线片及超声均提示右侧胸腔积液,立即停用PICC,于床旁超声引导下胸腔穿刺抽出积液,颜色为乳白色或淡黄色。3例呼吸衰竭患儿逐步下调呼吸机参数,24 h内拔除气管插管。4例患儿均在1~2 d内完全脱离呼吸机,行胸腔穿刺后均未再出现呼吸困难症状,穿刺后6 h内复查胸部X线片胸腔积液好转,治愈出院。
随着围产医学的发展,早产儿特别是极低出生体重儿抢救成功率明显升高。PICC技术的广泛应用在早产儿救治方面起到了重要作用。PICC常见并发症包括堵管、导管移位、断裂、脱出、静脉炎、血栓形成、感染等[4],合并胸腔积液较少见。一旦发生胸腔积液病情进展快,病情重,甚至危及生命。本组4例患儿在出现呼吸困难后及时完成床旁胸部X线片及超声检查,证实为右侧胸腔积液,予立即拔除PICC并行胸腔穿刺抽取积液后呼吸困难很快好转,提示对于留置PICC导管的患儿短时间内出现进行性加重的呼吸困难而难以用其他原因解释时,需考虑是否合并胸腔积液。
新生儿胸腔积液较少见,台湾一项多中心研究总结了1999年1月至2009年12月胸腔积液患儿情况,PICC所致胸腔积液3例,占胸腔积液患儿的14%[5]。因PICC合并胸腔积液为少见合并症,目前仅见少数病例报道[6,7,8]。加拿大一项研究显示,NICU留置PICC 926例,发生胸腔积液7例,发生率为0.76%[9],与本研究PICC相关胸腔积液发生率为0.7%相仿;另一项研究报道显示,76例极低出生体重儿放置PICC,合并胸腔积液4例[10],发生率远高于本研究。本组4例患儿中3例PICC送管困难,管端未送至预计位置,1例导管尖端位于第3胸椎,但病情变化时导管尖端位置漂移至第1胸椎,提示PICC管端位置不正确及留置过程中发生导管管端位置漂移,需注意合并症的发生。
PICC合并胸腔积液原因尚不完全明确,考虑与以下因素相关:(1)导管位置:本组4例患儿导管尖端均未达到上腔静脉入口的预计位置,其所处血管血流速度慢、管腔细;(2)输液成分:输注钙剂、脂肪乳等刺激性药物易导致血管内膜受损[11,12];(3)肢体活动:新生儿穿刺侧肢体一般不予制动,肢体屈伸可带动导管在血管内来回抽动,增加导管与血管壁的机械性摩擦,肌肉对血管壁挤压,很可能损伤血管内膜,并增加液体外渗的机会。同时还可能使原本位置良好的导管尖端移位[8]。胸腔穿刺液体外观为淡黄或乳白色,应注意与新生儿乳糜胸相鉴别。新生儿乳糜胸是由于淋巴液漏入胸腔引起,PICC亦是引起继发性乳糜胸的少见病因,乳糜液细胞以淋巴细胞为主,甘油三酯明显升高而糖升高并不明显,诊断标准为细胞数>1×109/L,淋巴细胞>80%,甘油三酯>1.1 mmol/L[3]。本研究中4例患儿均行胸腔积液检测,虽然3例有核细胞数及单核细胞比例未达诊断标准,未做甘油三酯定量,1例细胞数明显升高,不能除外乳糜胸,但本组患儿均行1次胸腔穿刺即好转,不符合一般乳糜胸的特点。
综上所述,对于留置PICC导管的早产儿,一旦出现不明原因进行性加重的呼吸困难需考虑是否合并胸腔积液,尽早行床旁胸部X线片或超声检查明确诊断。合并胸腔积液的患儿应及时拔除PICC导管并行胸腔穿刺放液。同时规范操作流程,准确放置导管尖端位置,正确进行导管维护,必要时复查胸部X线片查看导管尖端有无移位,对预防及减少并发症发生至关重要。



























