
探讨超未成熟(extremely premature,EP)婴儿和超低出生体重(extremely low birth weight,ELBW)婴儿早期存活率及其影响因素。
回顾性分析2010年1月至2015年12月山东大学附属省立医院收治的EP婴儿和(或)ELBW婴儿临床资料。根据其生后存活状况分为存活组和死亡组,比较影响两组婴儿存活率的相关因素;再按出生时间分为2014年前和2014年及以后两组,比较两阶段婴儿存活率和围产期早期死亡的影响因素,并对其死因顺位进行分析。
研究期间共纳入EP婴儿和(或)ELBW婴儿142例,其中仅符合EP诊断16例(11.3%),仅符合ELBW诊断88例(62.0%),两者均符合38例(26.8%)。中位胎龄28(27,29)周,中位出生体重925(830,965)g。存活组76例(53.5%),死亡组66例(46.5%)。影响两组婴儿早期存活率的因素为出生体重、胎盘早剥、围产期窒息、早发型脓毒症、肺出血(P均<0.05)。2014年前共纳入EP婴儿和(或)ELBW婴儿67例,存活30例(44.8%);2014年及以后共纳入75例,存活46例(61.3%),两阶段婴儿存活率差异有统计学意义(χ2=3.900,P=0.048)。2014年前死亡组婴儿围产期死亡原因前2位分别是围产期窒息和早发型脓毒症,2014年及以后死因顺位首位是早发型脓毒症。
随着早产儿窒息复苏技术的提高和早产儿呼吸支持策略的优化,EP婴儿和(或)ELBW婴儿早期生存率有所提高,早发型脓毒症成为影响该组人群早期存活率的重要因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
超未成熟(extremely premature,EP)婴儿与超低出生体重(extremely low birth weight,ELBW)婴儿各脏器发育极不成熟,并发症多,救治难度大,常因遗留后遗症而对家庭和社会造成负担。美国、日本、欧洲等发达国家与地区EP婴儿和(或)ELBW婴儿存活率已达到较高水平,远期生存质量也有明显改善[1]。我国医疗资源相对不足,该组人群的救治经验尚欠缺,且受经济基础和文化背景传统观念的影响,其监护人救治积极性相对较低,导致我国该组人群成活率较发达国家低。因此,对该组人群早期存活率及影响因素进行总结,不断积累救治经验,有助于提高其存活率。本研究回顾性分析2010年1月至2015年12月山东大学附属省立医院收治的EP婴儿和(或)ELBW婴儿早期存活率及围产期影响因素,为进一步完善早期救治手段提供依据。
回顾性选择2010年1月至2015年12月山东大学附属省立医院新生儿重症监护病房(neonatal intensive care unit,NICU)收治的全部EP婴儿和(或)ELBW婴儿。EP婴儿为出生胎龄22~27周的活产新生儿;ELBW婴儿为出生体重<1 000 g的活产新生儿[2]。
通过病案查询系统调取研究对象的电子病历,并查阅死亡登记本。收集并记录患儿临床资料。包括:(1)一般情况:性别、胎龄、出生体重、分娩方式、围产期有无窒息;(2)母亲围产期资料:母亲年龄、受孕方式、胎儿数、产前激素使用情况、入NICU时龄、有无胎盘早剥;(3)生后因素:有创通气、无创持续气道正压通气(nasal continuous positive airway pressure,NCPAP)、肺表面活性物质(pulmonary surfactant,PS)使用情况,严重呼吸窘迫综合征(respiratory distress syndrome,RDS)、早发型脓毒症(early onset sepsis,EOS)、肺出血(pulmonary hemorrhage)、脑室内出血(intraventricular hemorrhage,IVH)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、晚发型脓毒症(late onset sepsis,LOS)等。
(1)根据EP婴儿和(或)ELBW婴儿生后存活状况分为存活组和死亡组。选取围产期窒息、出生体重、胎龄、胎盘早剥、EOS、产前激素使用情况、严重RDS、肺出血、IVH、NEC、LOS共11个变量,进行影响婴儿早期存活率的单因素及多因素分析。(2)纳入对象生后早期均每4 h观察生命体征,并于生后24 h、72 h、1周采集血标本监测感染指标,结合临床征象进行综合评估以确保EOS诊断的敏感度与准确度。(3)2014年1月起,根据"2013年欧洲新生儿RDS防治指南"[3]和2014年美国儿科学会"早产儿出生时呼吸支持"指南[4],对原有呼吸支持理念进行更新,包括生后30 min内立即应用NCPAP,规范应用PS(猪肺磷脂注射液),生后24 h左右开始使用枸橼酸咖啡因防治早产儿呼吸暂停。按照婴儿出生时间分为2014年前和2014年及以后两组,比较两阶段婴儿存活率、影响围产期死亡的因素及根本死亡原因顺位。根据《济南市围产儿、5岁以下儿童死亡报告卡》填卡说明,根本死亡原因定义为直接导致死亡事件的疾病或损伤,或产生致命损伤的事故或暴力情况。
应用SPSS 22.0统计软件。符合正态分布的计量资料以 ±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验;计数资料以例(%)表示,组间比较采用χ2检验。单因素分析中,将P<0.05的变量采用逐步引入剔除法,建立Logistic回归模型,计算出优势比(odds ratios,OR)值及95%可信区间(confidence interval,CI)。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较采用秩和检验;计数资料以例(%)表示,组间比较采用χ2检验。单因素分析中,将P<0.05的变量采用逐步引入剔除法,建立Logistic回归模型,计算出优势比(odds ratios,OR)值及95%可信区间(confidence interval,CI)。P<0.05为差异有统计学意义。
共纳入EP婴儿和(或)ELBW婴儿142例,其中男65例(45.8%),女77例(54.2%);中位胎龄28(27,29)周;中位出生体重925(830,965)g;母亲年龄30(27,34)岁;仅符合EP诊断16例(11.3%),仅符合ELBW诊断88例(62.0%),两者均符合38例(26.8%)。自然受孕110例(77.5%),人工受孕32例(22.5%);单胎78例(54.9%),双胎/多胎64例(45.1%);入NICU时龄0.18(0.08,0.50)h。存活组76例(53.5%),死亡组66例(46.5%);存活组住院时间65(38,91)d,死亡组死亡日龄3.6(1.6,6.2)d。
存活组胎盘早剥、围产期窒息、EOS、肺出血、IVH比例低于死亡组,出生体重高于死亡组,差异有统计学意义(P<0.05)。见表1。
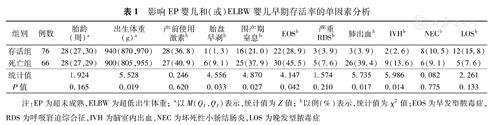
影响EP婴儿和(或)ELBW婴儿早期存活率的单因素分析
影响EP婴儿和(或)ELBW婴儿早期存活率的单因素分析
| 组别 | 例数 | 胎龄(周)a | 出生体重(g)a | 产前使用激素b | 胎盘早剥b | 围产期窒息b | EOSb | 严重RDSb | 肺出血b | IVHb | NECb | LOSb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 存活组 | 76 | 28(27,30) | 940(870,970) | 28(36.8) | 1(1.3) | 16(21.0) | 22(28.9) | 3(3.9) | 3(3.9) | 2(2.6) | 8(10.5) | 12(15.8) |
| 死亡组 | 66 | 28(27,29) | 900(805,955) | 27(40.9) | 6(9.1) | 25(37.9) | 30(45.5) | 5(7.6) | 26(39.4) | 9(13.6) | 6(9.1) | 5(7.6) |
| 统计值 | 1.924 | 5.528 | 0.246 | 4.556 | 4.870 | 4.147 | 1.574 | 5.735 | 5.986 | 0.082 | 2.261 | |
| P值 | 0.165 | 0.019 | 0.620 | 0.033 | 0.027 | 0.042 | 0.210 | 0.017 | 0.014 | 0.775 | 0.133 |
注:EP为超未成熟,ELBW为超低出生体重;a以M(Q1,Q3)表示,统计值为Z值;b以例(%)表示,统计值为χ2值;EOS为早发型脓毒症,RDS为呼吸窘迫综合征,IVH为脑室内出血,NEC为坏死性小肠结肠炎,LOS为晚发型脓毒症
出生体重、胎盘早剥、围产期窒息、EOS、肺出血与EP婴儿和(或)ELBW婴儿早期存活率相关(P<0.05)。见表2。
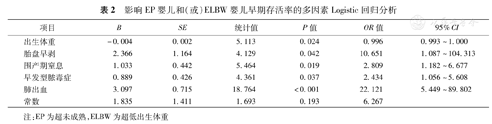
影响EP婴儿和(或)ELBW婴儿早期存活率的多因素Logistic回归分析
影响EP婴儿和(或)ELBW婴儿早期存活率的多因素Logistic回归分析
| 项目 | B | SE | 统计值 | P值 | OR值 | 95%CI |
|---|---|---|---|---|---|---|
| 出生体重 | -0.004 | 0.002 | 5.113 | 0.024 | 0.996 | 0.993~1.000 |
| 胎盘早剥 | 2.366 | 1.164 | 4.129 | 0.042 | 10.651 | 1.087~104.313 |
| 围产期窒息 | 1.033 | 0.442 | 5.464 | 0.019 | 2.809 | 1.182~6.677 |
| 早发型脓毒症 | 0.889 | 0.426 | 4.361 | 0.037 | 2.434 | 1.056~5.608 |
| 肺出血 | 3.097 | 0.715 | 18.764 | <0.001 | 22.121 | 5.449~89.802 |
| 常数 | 1.835 | 1.411 | 1.693 | 0.193 | 6.267 |
注:EP为超未成熟,ELBW为超低出生体重
2014年前共纳入EP婴儿和(或)ELBW婴儿67例,2014年及以后共纳入75例。两阶段婴儿性别、胎龄、出生体重、围产期窒息、胎盘早剥等因素差异无统计学意义(P>0.05);2014年及以后组产前使用激素比例增加、应用PS和有创通气比例降低、首次PS使用时间和CPAP初始通气时间更早,差异均有统计学意义(P<0.05)。见表3。
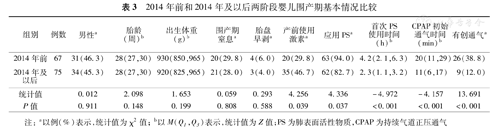
2014年前和2014年及以后两阶段婴儿围产期基本情况比较
2014年前和2014年及以后两阶段婴儿围产期基本情况比较
| 组别 | 例数 | 男性a | 胎龄(周)b | 出生体重(g)b | 围产期窒息a | 胎盘早剥a | 产前使用激素a | 应用PSa | 首次PS使用时间(h)b | CPAP初始通气时间(min)b | 有创通气a |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2014年前 | 67 | 31(46.3) | 28(27,30) | 930(850,965) | 20(29.8) | 4(6.0) | 20(29.8) | 63(94.0) | 4.2(2.1,6.3) | 20(11,29) | 26(38.8) |
| 2014年及以后 | 75 | 34(45.3) | 28(27,30) | 920(825,965) | 21(28.0) | 3(4.0) | 35(46.7) | 62(82.7) | 2.3(1.1,3.2) | 11(6,17) | 9(12.0) |
| 统计值 | 0.012 | 2.098 | 1.653 | 0.059 | 0.293 | 4.256 | 4.336 | -4.972 | -4.157 | 13.691 | |
| P值 | 0.911 | 0.148 | 0.199 | 0.808 | 0.588 | 0.039 | 0.037 | <0.001 | <0.001 | <0.001 |
注:a以例(%)表示,统计值为χ2值;b以M(Q1,Q3)表示,统计值为Z值;PS为肺表面活性物质,CPAP为持续气道正压通气
2014年前共纳入67例,存活30例(44.8%);2014年及以后共纳入75例,存活46例(61.3%),两阶段婴儿存活率比较差异有统计学意义(χ2=3.900, P=0.048)。
2014年前67例婴儿中死亡37例(55.2%),2014年及以后75例婴儿中死亡29例(38.7%),两阶段死亡婴儿胎龄、出生体重、胎盘早剥、围产期窒息、严重RDS、肺出血、IVH、NEC、LOS差异无统计学意义,2014年及以后组产前使用激素比例和EOS发生率高于2014年前组,差异有统计学意义(P<0.05)。见表4。
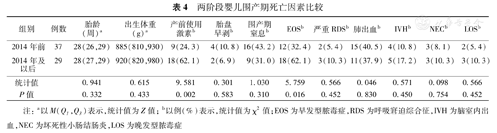
两阶段婴儿围产期死亡因素比较
两阶段婴儿围产期死亡因素比较
| 组别 | 例数 | 胎龄(周)a | 出生体重(g)a | 产前使用激素b | 胎盘早剥b | 围产期窒息b | EOSb | 严重RDSb | 肺出血b | IVHb | NECb | LOSb |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2014年前 | 37 | 28(26,29) | 885(810,930) | 9(24.3) | 4(10.8) | 16(43.2) | 12(32.4) | 2(5.4) | 15(40.5) | 4(10.8) | 3(8.1) | 2(5.4) |
| 2014年及以后 | 29 | 28(27,29) | 920(820,980) | 18(62.1) | 2(6.9) | 9(31.0) | 18(62.1) | 3(10.3) | 11(37.9) | 5(17.2) | 3(10.3) | 3(10.3) |
| 统计值 | 0.941 | 0.615 | 9.581 | 0.301 | 1.030 | 5.759 | 0.566 | 0.046 | 0.571 | 0.098 | 0.566 | |
| P值 | 0.332 | 0.433 | 0.002 | 0.583 | 0.310 | 0.016 | 0.452 | 0.830 | 0.450 | 0.754 | 0.452 |
注:a以M(Q1,Q3)表示,统计值为Z值;b以例(%)表示,统计值为χ2值;EOS为早发型脓毒症,RDS为呼吸窘迫综合征,IVH为脑室内出血,NEC为坏死性小肠结肠炎,LOS为晚发型脓毒症
根据根本死亡原因的定义,2014年前根本死亡原因顺位为围产期窒息、EOS、IVH、NEC、LOS、严重RDS及其他因素;2014年及以后死因顺位为EOS、围产期窒息、IVH、LOS、严重RDS、NEC及其他因素。
EP婴儿和(或)ELBW婴儿的并发症较多,远期预后较差,其救治是目前充满挑战的医学课题。研究显示,发达国家EP婴儿总体存活率达85%,其中胎龄26~27周、出生体重700~999 g婴儿存活率约90%,胎龄24~25周、出生体重500~699 g存活率在50%~70%[6,7,8]。国内相关报道较少。姜娜等[9]报道2008—2012年救治的135例EP婴儿总存活率68.1%。中国医师协会新生儿科医师分会进行的一项包括117家医院的全国性调查结果显示,EP婴儿存活率和ELBW婴儿存活率分别为53.66%和66.1%[10]。本研究中,EP婴儿和(或)ELBW婴儿的总存活率为53.5%,2014年及以后存活率为61.3%,与全国性调查数据接近。与发达国家相比,本研究中该组人群的存活率相对较低,这可能与发达国家医疗资源相对丰富,以及我国社会经济文化等因素制约的监护人救治意愿有关。
本研究中,死亡组EP婴儿和(或) ELBW婴儿死亡时间为3.6(1.6,6.2)d,时间较早,提示其死亡结局与围产期因素有相关性。早产儿相对于足月儿更易发生窒息,窒息后可出现IVH、肺出血等并发症,往往成为EP婴儿和(或)ELBW婴儿生后早期死亡的直接原因。国外2011年研究表明,出生窒息引起的死亡约占早产儿全部死亡病例的50%[11]。我国自20世纪90年代开始引进新生儿窒息复苏项目,经过十余年努力该项目已在全国普及和推广,新生儿窒息占新生儿总体死亡的20%~30%,死因顺位在第2位或第3位[12]。白小红等[13]对2007—2011年116例死亡早产儿进行分析,窒息因素在早产儿死因顺位中排第3位。本研究中,2014年前死亡组婴儿窒息比例为43.2%,是首要的根本死亡原因;2014年及以后窒息比例仅为31.0%,且死因顺位后移至第2位。
EP婴儿和(或) ELBW婴儿早期易发生新生儿RDS、呼吸暂停和呼吸衰竭,呼吸因素是该组人群生后所面临的首要难关;有创呼吸支持可加重早产儿肺损伤、增加BPD发生率已经成为共识。2013年欧洲新生儿RDS防治指南[3]的制订与推广,以及2014年美国儿科学会"早产儿出生时呼吸支持"指南[4]和2016年欧洲RDS指南的更新[14],优化了无创通气策略。本中心自2014年根据上述指南制订新生儿RDS防治流程,对于产前激素进行规范管理,实现生后30 min内尽早开始无创呼吸支持,并规范枸橼酸咖啡因的应用。因此,两阶段比较显示,积极的产前使用激素、无创通气初始时间提前、减少有创通气应用,这些更为优化的呼吸支持策略进一步提升了EP婴儿和(或)ELBW婴儿存活率。
感染是影响早产儿存活的重要因素,宫内感染是新生儿EOS的病因,由宫内感染引起的早产约占24%,是早期自发性早产的主要原因[15]。宫内感染可导致胎儿发生围产期感染,继而累及多个器官如肺、血液、肾上腺、心脏、脑,甚至引发胎儿全身炎症反应综合征(fetal inflammatory response syndrome, FIRS)[16],其病理学诊断标准包括胎盘绒毛血管炎和(或)脐带血管炎。新生儿EOS是胎儿宫内感染引发FIRS的病理生理过程在生后的延续和表现。新生儿尤其早产儿EOS临床表现隐匿,仅有体温不稳定、心率增快、外周循环差和呼吸困难[17],缺乏特异性生物学标志物界定胎儿围产期感染及其所引发的新生儿EOS[18,19]。本研究结果显示,2014年及以后EOS发生率增加,死因顺位前移至首位,提示EOS是该组人群的重要死亡因素,且影响力呈增强趋势。
本研究表明,随早产儿窒息复苏项目的推广和生后早期呼吸管理策略的优化,围产期窒息发生率呈下降趋势,而EOS越来越成为制约EP婴儿和(或) ELBW婴儿救治和早期存活的首要因素。美国疾病控制中心和美国儿科学会近年来均已制订针对绒毛膜羊膜炎产妇所分娩的新生儿围产期感染防治指南,但在晚期早产儿和足月儿中实施该类指南会导致为防治少数早发感染而使所有新生儿较为普遍的抗菌药物暴露的临床结局[20]。目前对EP早产儿围产期感染的界定和防治措施尚缺乏共识。本研究结果提示,国内迫切需要开展大样本前瞻性临床研究和病原学检测,为EP婴儿和(或)ELBW婴儿围产期感染的正确评估与更优化的救治策略提供更有力的科学依据。



























