
系统评价母亲5,10-亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)基因C677T位点多态性与国人子代先天性心脏病(congenital heart disease,CHD)易感性的相关性。
通过检索PubMed、Embase、Web of science、中国生物医学文献数据库、中文科技期刊全文数据库、中国期刊全文数据库及万方数据库,检索时间为建库至2017年1月,纳入国人MTHFR基因C677T位点多态性与CHD易感性的病例对照试验研究。以病例组和对照组MTHFR基因C677T位点基因型分布的比值比(odds ratio,OR)为疗效测量指标,采用revMan 5.3进行统计分析。
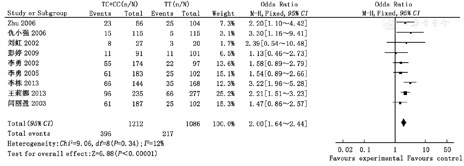
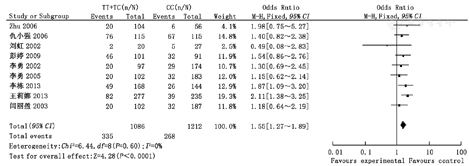
共纳入9篇文献,其中病例组(CHD患儿母亲)1 221例,对照组(健康儿童母亲)1 108例。Meta分析结果显示,母亲MTHFR基因C677T位点TT/TC、TT/CC、TC/CC、TT/TC+CC、TT+TC/CC多态性与国人CHD易感性相关,OR分别为1.85(95%CI 1.50~2.28)、2.33(95%CI 1.81~3.00)、1.24(95%CI 1.00~1.54)、2.00(95%CI 1.64~2.44)和1.55(95%CI 1.27~1.89),差异均有统计学意义(P<0.05)。
母亲MTHFR基因C677T位点多态性与国人子代CHD易感性相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
先天性心脏病(congenital heart disease,CHD)是指婴幼儿出生时就存在的心血管结构或功能异常。全球每年约出生CHD患儿790万,我国CHD患儿占出生婴儿的6‰~8‰,其是导致新生儿死亡的原因之一,也是人类出生缺陷中最常见疾病之一[1,2]。迄今为止,CHD发病机制尚未完全阐明,但是越来越多证据表明CHD是环境和遗传因素交互作用的结果[3],孕早期补充叶酸可减少婴幼儿发生CHD的风险[4],孕妇叶酸代谢的关键酶5,10-亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)基因C677T位点多态性可增加子代CHD风险[5]。鉴于CHD有着不同的遗传背景,单个研究样本量较小,本研究采用Meta分析定量评价中国母亲MTHFR基因C677T位点多态性与其子代CHD易感性的关系,为减少我国CHD出生缺陷及预防CHD提供理论依据。
计算机检索PubMed、Embase、Web of science、中国生物医学文献数据库(Chinese biomedical literature database,CBM)、中文科技期刊全文数据库、中国期刊全文数据库(Chinese journal full text database,CNKI)、万方数据库,检索时间从建库至2017年1月,并追查纳入文献和相关综述的参考文献。全面检索MTHFR基因C677T位点多态性与国人CHD易感性的病例对照试验研究。英文检索词为"MTHFR"、"5,10-methylenetetrahydrofolate reductase"、"congenital heart disease"、"congenital cardiac defects"、"polymorphism";中文检索词为"亚甲基四氢叶酸还原酶"、"基因多态性"和"先天性心脏病"。
(1)纳入标准:①研究类型为病例对照研究;②研究对象为国人CHD患儿和健康儿童的母亲,CHD由专科医生行超声检查明确诊断,类型包括房间隔缺损、室间隔缺损、动脉导管未闭、法洛四联征等;③文献报道了CHD患儿母亲和健康儿童母亲MTHFR基因多态性的分布频数;④对照组群体中基因型分布符合哈迪-温伯格(Hardy-Weinberg,HWE)遗传平衡定律。(2)排除标准:重复报道、综述、病例报告。
由2名研究者独立筛选文献并交叉核对,对于难以确定是否纳入的试验,通过小组讨论解决分歧。
主要信息包括:(1)文献题目、第一作者、发表日期、地区等;(2)样本量;(3)基因型频数、基因型检测方法;(4)结局指标包括子代CHD发生率;(5)采用纽卡斯尔渥太华量表(Newcastle-Ottawa Scale,NOS)评价纳入研究的文献质量[6]。
应用revMan 5.3软件进行Meta分析,以比值比(odd ratio,OR)及95%置信区间(confidence intervals,CI)为效应分析统计量。首先计算对照组基因型是否符合HWE平衡,若P>0.05,则认为对照组基因型符合HWE。采用χ2检验对纳入研究进行异质性检验,当纳入文献间无显著统计学异质性时(I2<50%,P>0.1),采用固定效应模型;有显著统计学异质性时(I2>50%,P<0.1),采用随机效应模型。合并OR值的显著性检验采用Z检验。分别计算MTHFR基因C677T位点多态性在5种遗传模型下的OR值及95%CI。P<0.05为差异有统计学意义。纳入文献发表偏倚采用STATA 12.0软件进行Begg′s检验和漏斗图评估。
经过系统检索,共检索到文献225篇,其中中文文献167篇(CNKI 56篇、CBM 80篇、万方31篇),英文文献58篇(PubMed 38篇、Embase 20篇)。排除重复发表文献25篇,初步阅读标题和摘要排除文献93篇;通过阅读全文排除综述12篇,无相关数据11篇,研究人群非中国人群13篇,专家述评4篇。最终有9篇纳入本研究[7,8,9,10,11,12,13,14,15],其中8篇文献为中文,1篇文献为英文。病例组(CHD患儿及其母亲)共1 221例,对照组(健康儿童及其母亲)共1 108例,均为中国人,无地域、种族之分。见表1。
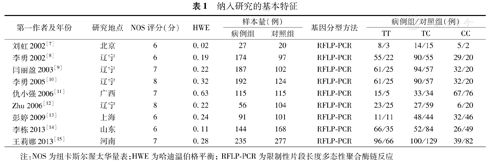
纳入研究的基本特征
纳入研究的基本特征
| 第一作者及年份 | 研究地点 | NOS评分(分) | HWE | 样本量(例) | 基因分型方法 | 病例组/对照组(例) | |||
|---|---|---|---|---|---|---|---|---|---|
| 病例组 | 对照组 | TT | TC | CC | |||||
| 刘虹2002[7] | 北京 | 6 | 0.02 | 27 | 20 | RFLP-PCR | 8/3 | 14/15 | 5/2 |
| 李勇2002[8] | 辽宁 | 6 | 0.19 | 174 | 97 | RFLP-PCR | 55/22 | 90/55 | 29/20 |
| 闫丽盈2003[9] | 辽宁 | 7 | 0.22 | 187 | 102 | RFLP-PCR | 61/25 | 94/57 | 32/20 |
| 李勇2005[10] | 辽宁 | 8 | 0.32 | 192 | 124 | RFLP-PCR | 61/25 | 90/57 | 32/20 |
| 仇小强2006[11] | 广西 | 7 | 0.63 | 115 | 115 | RFLP-PCR | 15/5 | 33/34 | 67/76 |
| Zhu 2006[12] | 辽宁 | 8 | 0.22 | 56 | 104 | RFLP-PCR | 23/25 | 27/59 | 6/20 |
| 彭婷2009[13] | 上海 | 6 | 0.24 | 91 | 101 | RFLP-PCR | 11/11 | 48/44 | 32/46 |
| 李栋2013[14] | 山东 | 6 | 0.11 | 144 | 168 | RFLP-PCR | 66/35 | 52/84 | 26/49 |
| 王莉娜2013[15] | 河南 | 7 | 0.28 | 235 | 277 | RFLP-PCR | 96/66 | 100/129 | 39/82 |
注:NOS为纽卡斯尔渥太华量表;HWE为哈迪温伯格平衡;RFLP-PCR为限制性片段长度多态性聚合酶链反应
纳入文献的NOS评分介于6~8分之间,见表1。
Meta分析结果显示,母亲MTHFR基因C677T位点TT/TC多态性、TT/CC多态性、TC/CC多态性、TT/TC+CC多态性、TT+TC/CC多态性与子代CHD易感性成正相关(OR=1.85,95%CI 1.50~2.28;OR=2.33,95%CI 1.81~3.00;OR=1.24,95%CI 1.00~1.54;OR=2.00,95%CI 1.64~2.44;OR=1.55,95%CI 1.27~ 1.89),差异均有统计学意义(P<0.05);异质性检验结果表明纳入研究组比较无统计学异质性,故采用固定效应模型,见图1,图2,图3,图4,图5。
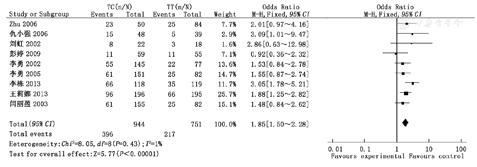

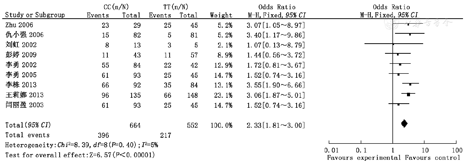

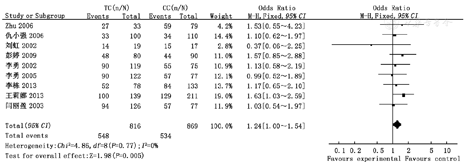



逐一剔除单个研究,对剩余研究再次进行统计分析,敏感性分析结果与Meta分析结果一致,剩余研究间异质性未见明显改变,提示Meta分析结果稳定性较好。
Begg′s检验进行定量分析发表偏倚,各遗传模型下均无发表偏倚存在。漏斗图定性分析发表偏倚,结果显示大部分研究位于漏斗底部,未见明显的不对称,提示无明显发表偏倚,见图6。
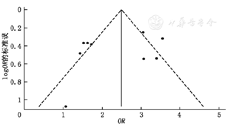

注:OR为比值比
MTHFR是叶酸代谢和同型半胱氨酸(homocysteine,Hcy)代谢通路中的关键酶之一。MTHFR基因C677T位点突变是最常见的突变类型,可导致MTHFR活性降低,使叶酸在甲硫氨酸代谢中的作用降低,甲硫氨酸合成减少,进一步导致S腺苷甲硫氨酸(S-adenosyl methionine,SAM)合成减少,而SAM是细胞内重要的甲基供体,参与体内甲基化反应[12]。MTHFR定位于1p36.3,MTHFR基因第4外显子上的第677个核苷酸上发生突变时,可使该基因位点处产生Hinf I限制性酶识别序列,导致所编码的缬氨酸替代原有丙氨酸,增加MTHFR的遇热不稳定性,导致MTHFR酶活性明显下降和高Hcy血症的风险增加[16]。已有研究表明Hcy代谢异常在CHD的发生发展中起重要作用,母亲高Hcy血症与子代CHD的发生密切相关[17]。
研究表明子代CHD是环境和遗传因素共同作用导致的多基因遗传病,环境因素包括母亲孕期所处的环境及胎儿在母亲体内发育的环境[18]。越来越多证据表明,母亲早期补充叶酸可降低子代发生CHD的风险,特别是室间隔缺损、法洛四联症和大动脉转位[19];另有研究表明在孕期服用叶酸拮抗剂,可使子代患CHD的风险增高2倍[20]。另一方面,子代CHD的发生也可能与母亲孕期叶酸代谢酶的活性相关,母亲叶酸代谢相关酶MTHFR基因C677T位点突变可导致四氢叶酸合成减少,子代体内Hcy水平升高,造成子宫内高危环境,进一步影响胎儿心脏的正常发育[10]。
母亲MTHFR基因C677T位点多态性与国人子代CHD易感性的关系尚无定论。2009年余章斌等[21]发表的Meta分析结果显示,母亲MTHFR基因C677T位点TT/CC多态性、TC/CC多态性、TT+TC/CC多态性与子代CHD的发生无关;2010年霍晓旭等[22]Meta分析结果却显示母亲MTHFR基因C677T多态性与其子代CHD的发生有关,母亲携带纯合突变基因型(TT)是其子代发生CHD的重要危险因素。两篇研究结论存在差异的原因可能与纳入研究的数量及人群代表性有关。本研究全面检索了中外文数据库,是基于中国人群的定量分析,且近期有新的原始研究发表,样本量较大,因此本Meta分析结果稳定性较好。已有研究表明中国人群的MTHFR基因C677T位点变异频率高于西方人群,不同国家、同一国家不同地区及同一地区不同民族间MTHFR基因突变有着显著差异[8],子代CHD的发生有不同的遗传背景。而本研究只分析中国人群母亲MTHFR基因C677T位点多态性与子代CHD易感性的相关性,虽然结果显示5种遗传模型下二者均具有相关性,但鉴于子代CHD的发病机制非常复杂,本研究结论尚需高质量大样本的研究进一步证实。



























