分析小于胎龄(small for gestational age,SGA)早产儿早期体格追赶生长情况,探讨影响其追赶生长的因素。
采用单中心、回顾性研究方法,研究对象为2012年1月至2015年10月在我院新生儿重症监护病房住院治疗7 d以上且出院时完全经口喂养的SGA早产儿。追赶生长定义为相应体格指标Z值较出生时上升≥0.67,完成追赶生长定义为体重位于同性别同年龄参考人群的第10百分位以上。根据校正胎龄40±4周、校正年龄(corrected age,CA)3±1.5月、CA 6±1.5月时体重有无追赶生长分为追赶生长组和无追赶生长组,分别进行组间特点比较,并寻找预测追赶生长的指标。
共纳入SGA早产儿81例,男45例,女36例,胎龄(34.6±1.7)周,出生体重(1 617±348) g,出生身长(41.0±3.2) cm,出生头围(29.7±2.0) cm。校正胎龄40±4周、CA 3±1.5月、CA 6±1.5月的随访率分别为86.4%、66.7%、58.0%,出现体重追赶生长的比例分别为32.9%、55.6%、66.0%,完成体重追赶生长的比例分别为52.9%、64.8%、66.0%。校正胎龄40±4周时,与无追赶生长组比较,追赶生长组男婴比例高、恢复出生体重时间早、合并动脉导管未闭比例低,差异有统计学意义(P<0.05);CA 3±1.5月时,与无追赶生长组比较,追赶生长组出生胎龄大、出院身长百分位数大、住院天数短、合并动脉导管未闭比例低、校正胎龄40周时体重百分位数大,差异有统计学意义(P<0.05);CA 6±1.5月时,与无追赶生长组比较,追赶生长组住院天数短、校正胎龄40周时体重百分位数大、CA 3±1.5月时体重、身长及头围百分位数大,差异有统计学意义(P<0.05)。多因素分析显示,CA 3±1.5月体重百分位数是影响CA 6±1.5月体重追赶生长的独立因素(P=0.002,OR=1.221,95%CI 1.076~1.385);CA 3±1.5月时体重百分位数每提高5个百分位数,CA 6±1.5月时完成体重追赶生长的可能性增加2.965倍(95%CI 1.480~5.942)。
SGA早产儿校正胎龄40±4周及CA 3±1.5月时,体重和身长均呈快速增加的趋势。各年龄阶段影响完成追赶生长的因素不同,CA 3个月时的体重、身长及头围百分位数可较好的预测CA 6个月是否完成追赶生长。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
随着围产医学的发展和进步,越来越多的早产儿得以存活,一旦早产和宫内发育迟缓二者共同出现,会使婴儿体格生长落后、器官系统功能发育落后及死亡风险增加[1,2,3]。大部分早产儿与无并发症的小于胎龄(small for gestational age,SGA)婴儿追赶生长出现在出生后前两年,但有的早产儿生长延迟可持续到儿童时期,有些极低出生体重儿生长过程中完全没有追赶生长[4]。大量研究显示,早期体格生长与远期健康及神经系统发育密切相关[3,5,6]。因此,重视SGA早产儿适时、恰当的追赶生长,对提高此组高危婴儿远期发展和生存质量十分必要。本研究回顾性分析我院SGA早产儿住院期间及出院后的体格生长情况,探讨营养强化对追赶生长的作用,寻找追赶生长成功和失败的影响因素,并希望通过随访早期体格生长状况预测后期可能发生问题的高危人群,为更加有针对性地进行高危早产儿随访提供依据。
选择2012年1月至2015年10月我院新生儿重症监护病房(neonatal intensive care unit,NICU)收治的SGA早产儿,随访截止时间2016年3月11日。入选标准:(1)胎龄<37周;(2)单胎;(3)SGA婴儿(出生体重小于2013年Fenton生长曲线第10百分位[7]);(4)生后24 h内住院;(5)住院时间≥7 d;(6)出院时完全经口喂养。排除标准:(1)患有影响喂养和发育的严重疾病,包括进展性坏死性小肠结肠炎(necrotizing enterocolitis,NEC)、先天性消化道畸形、严重先天性心脏病、先天性遗传代谢病、重度支气管肺发育不良(bronchopulmonary dysplasia,BPD);(2)住院期间放弃治疗或死亡。出院标准:生命体征平稳,原发病已治愈,经口喂养能满足每日液量和能量需求,体重持续增长,且体重已达到或超过1 800 g。
采用凯华文大联合实验室开发的病案管理系统和海泰电子病历系统检索2012年1月至2015年10月住院患儿资料,并配合手工检索NICU患儿出院登记本,筛选2013年以前采用2003年[8]、2013年以后采用2013年[7]Fenton评价标准诊断的SGA早产儿,随后采用2013年Fenton标准结合性别再评估,确定本组研究对象。病案查询结束后由课题负责人核查数据完整性和真实性。记录研究对象出生、出院、生后1~2周、校正胎龄40±4周、校正年龄(corrected age,CA)3±1.5月、CA 6±1.5月的体格生长情况及相应临床资料。
2013年以前按2006年[9]、2013年以后按2013年[10]中国新生儿营养支持临床应用指南进行,个体化决定每日液量、热卡供给量,目标液量140~160 ml/(kg·d),目标热卡110~130 kcal/(kg·d)。积极肠道内营养,根据喂养耐受情况逐渐增加奶量,鼓励母乳喂养,当母乳喂养量达到80~100 ml/(kg·d)时添加母乳强化剂(出生体重<2 000 g给予全强化),对不能母乳喂养或不能完全母乳喂养者辅以早产儿配方奶或早产儿出院后配方奶(post-discharge formula,PDF)。生后24 h内接受肠道外营养,当肠内营养热卡达到所需总热卡的80%~90%时停用。出院后鼓励继续母乳喂养,体重<相应胎龄第25百分位时采用母乳半强化或PDF喂养,当体重达到相应胎龄第25百分位以上时逐渐改为母乳或标准婴儿配方奶喂养。CA 4~6个月时添加辅食。
住院期间每日测量患儿体重[赛康医用度量系统(杭州)有限公司电子婴儿秤],每周测量身长和头围(标准卷尺)。随访期间身长采用身长测量仪测量,头围、体重测量同前。测量时仅留单衣并予以校正,测量结果记录于病历中。体重测量精确至5 g,身长和头围精确至0.1 cm。
研究期间,早产儿出院后随访以新生儿专业主任医师为主,每位医生随访对象相对固定。出生后年龄均以CA表述。出院后随访时间按计划为校正胎龄40周、CA 1、2、3、6个月,根据随访时婴儿体格、神经系统发育状况、健康情况等,随访医生针对性调整随访时间。由于随访时间并非完全相同及绝对整月,因此数据分析按实际随访年龄评估,数据呈现按年龄段划分为出院时、校正胎龄40±4周、CA 3±1.5月、CA 6±1.5月。
(1)校正胎龄满40周前的体重、身长、头围均根据2013年Fenton早产儿生长发育曲线评价[7],判断其位于同性别、同胎龄婴儿相应数据的百分位数及Z值(Z评分法为标准差的离差法)。(2)CA 3±1.5月、6±1.5月的体重、身长、头围采用卫生部妇幼保健与社区卫生司授权、首都儿科研究所研发的儿童体格生长与营养评价系统V1.0中的中国标准[11],评价其位于同性别、同月龄婴儿相应数据的百分位数及Z值。(3)根据SGA早产儿身长/头围比值(body length/ head circumference,BL/HC)将其分为匀称型与非匀称型,BL/HC>1.36为匀称型,BL/HC <1.36为非匀称型[12]。追赶生长定义为相应体格指标Z值较出生时上升≥0.67[13]。完成追赶生长定义为体重位于同性别、同年龄参考人群的第10百分位以上。
根据校正胎龄40±4周、CA 3±1.5月、CA 6±1.5月时体重有无追赶生长分为追赶生长组和无追赶生长组。
应用SPSS 21.0统计软件进行分析。正态分布的计量资料以 ±s表示,多组比较采用方差分析,两两比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较及等级资料比较均采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法;多因素分析采用二元Logistic回归(偏最大似然估计前进法);预测指标最佳界值采用受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
±s表示,多组比较采用方差分析,两两比较采用t检验;不符合正态分布的计量资料以M(Q1,Q3)表示,组间比较及等级资料比较均采用非参数检验;计数资料以例(%)表示,组间比较采用χ2检验或Fisher精确概率法;多因素分析采用二元Logistic回归(偏最大似然估计前进法);预测指标最佳界值采用受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
共纳入符合标准的SGA早产儿81例,其中男45例(55.6%),女36例(44.4%);顺产14例(17.3%),剖宫产67例(82.7%);匀称型SGA 48例(59.3%),非匀称型SGA 33例(40.7%);胎龄(34.6±1.7)周(29.9~36.9周),出生体重(1 617±348) g(770~2 330 g),出生身长(41.0±3.2) cm(33~48 cm),出生头围(29.7±2.0) cm(24~35 cm)。住院天数中位数20(7~99) d。出院时纯母乳喂养48例(59.3%),PDF喂养21例(25.9%),混合喂养8例(9.9%),4例喂养方式不详(4.9%);轻度窒息5例(6.2%),动脉导管未闭(patent ductus arteriosus,PDA) 9例(11.1%),脑室周围-脑室内出血(periventricular-intraventricular hemorrhages,PIVH) 12例(14.8%),围生期巨细胞病毒(cytomegalovirus,CMV)感染1例(1.2%),可疑NEC 1例(1.2%),脓毒症10例(12.3%),轻中度BPD 3例(3.7%)。体重下降最低日龄中位数3(2,3) d,体重下降2.8%±2.1%,恢复出生体重日龄(4.8±2.4) d,达全肠道营养时间中位数12(8,18) d。
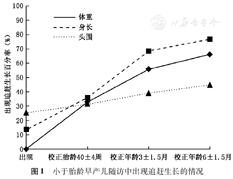
校正胎龄40±4周、CA 3±1.5月、CA 6±1.5月的随访率分别为86.4%、66.7%、58.0%。出院后低体重程度有所减轻,主要追赶生长发生在CA 3个月以内,校正胎龄40±4周、CA 3±1.5月、CA 6±1.5月的体重Z值和百分位数均大于出生时,而且校正胎龄40±4周、CA 3±1.5月时均大于前一年龄段,差异有统计学意义(P<0.05);CA 6±1.5月与CA 3±1.5月相比差异无统计学意义(P>0.05),见表1。身长和头围的变化趋势与体重相似。在追赶生长过程中,CA 3±1.5月和CA 6±1.5月时体重指数(body mass index,BMI)分别为(16.1±1.5)、(16.7±1.6) kg/m2,其Z值(t=0.636,P=0.528)及百分位数(t=1.036,P=0.306)差异无统计学意义。
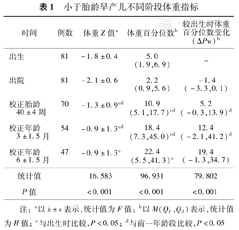
小于胎龄早产儿不同阶段体重指标
小于胎龄早产儿不同阶段体重指标
| 时间 | 例数 | 体重Z值a | 体重百分位数b | 较出生时体重百分位数变化(ΔPw)b |
|---|---|---|---|---|
| 出生 | 81 | -1.8±0.4 | 5.0(1.9,6.9) | - |
| 出院 | 81 | -2.1±0.6 | 2.2(0.9,5.6) | -1.4(-3.3,0.1) |
| 校正胎龄40±4周 | 70 | -1.3±0.9cd | 10.9(5.1,17.7)cd | 5.2(-0.3,13.9)d |
| 校正年龄3±1.5月 | 54 | -0.9±1.3cd | 18.4(7.3,45.0)cd | 12.4(-2.1,41.2)d |
| 校正年龄6±1.5月 | 47 | -0.9±1.3c | 22.4(5.5,41.3)c | 19.4(-1.3,34.7) |
| 统计值 | 16.583 | 96.931 | 79.802 | |
| P值 | <0.001 | <0.001 | <0.001 |
注:a以 ±s表示,统计值为F值;b以M(Q1,Q3)表示,统计值为H值;c与出生时比较,P<0.05;d与前一年龄段比较,P<0.05
±s表示,统计值为F值;b以M(Q1,Q3)表示,统计值为H值;c与出生时比较,P<0.05;d与前一年龄段比较,P<0.05
单因素分析显示,女婴、恢复出生体重慢及早期罹患PDA影响校正胎龄40±4周时的体格生长,胎龄小、住院时间长、早期罹患PDA、出院时低身长、校正胎龄40±4周时低体重是CA 3±1.5月不能完成追赶生长的危险因素,住院时间长、校正胎龄40±4周时低体重及CA 3±1.5月时体格生长落后是CA 6±1.5月无追赶生长的危险因素。见表2。
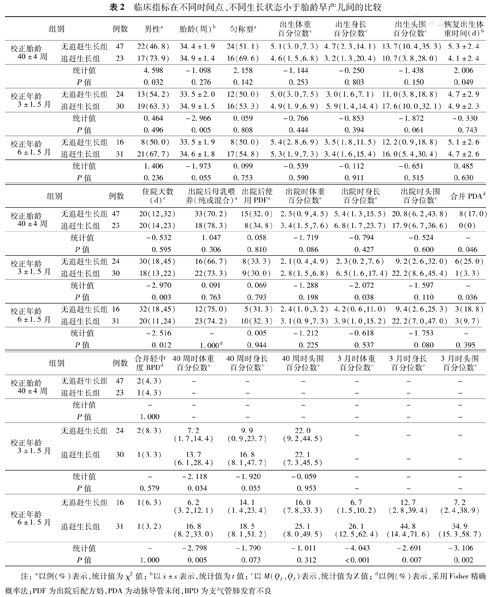
临床指标在不同时间点、不同生长状态小于胎龄早产儿间的比较
临床指标在不同时间点、不同生长状态小于胎龄早产儿间的比较
| 组别 | 例数 | 男性a | 胎龄(周)b | 匀称型a | 出生体重百分位数c | 出生身长百分位数c | 出生头围百分位数c | 恢复出生体重时间(d)b | |
|---|---|---|---|---|---|---|---|---|---|
| 校正胎龄40±4周 | 无追赶生长组 | 47 | 22(46.8) | 34.4±1.9 | 24(51.1) | 5.1(3.0,7.3) | 4.7(2.3,14.1) | 13.7(10.4,35.3) | 5.3±2.4 |
| 追赶生长组 | 23 | 17(73.9) | 34.9±1.4 | 16(69.6) | 4.6(1.5,6.8) | 3.2(1.3,20.4) | 10.7(3.8,28.0) | 4.1±2.4 | |
| 统计值 | 4.598 | -1.098 | 2.158 | -1.144 | -0.250 | -1.438 | 2.006 | ||
| P值 | 0.032 | 0.276 | 0.142 | 0.253 | 0.803 | 0.150 | 0.049 | ||
| 校正年龄3±1.5月 | 无追赶生长组 | 24 | 13(54.2) | 33.5±2.0 | 12(50.0) | 5.0(3.0,7.5) | 3.0(1.6,7.1) | 11.0(3.8,18.8) | 4.7±2.9 |
| 追赶生长组 | 30 | 19(63.3) | 34.9±1.5 | 16(53.3) | 4.9(1.9,6.9) | 5.9(1.4,14.4) | 17.6(10.0,32.1) | 4.9±2.3 | |
| 统计值 | 0.464 | -2.966 | 0.059 | -0.766 | -0.853 | -1.872 | -0.330 | ||
| P值 | 0.496 | 0.005 | 0.808 | 0.444 | 0.394 | 0.061 | 0.743 | ||
| 校正年龄6±1.5月 | 无追赶生长组 | 16 | 8(50.0) | 33.5±1.9 | 8(50.0) | 5.4(2.8,6.9) | 3.5(1.8,11.5) | 12.2(0.9,18.8) | 5.1±2.6 |
| 追赶生长组 | 31 | 21(67.7) | 34.6±1.8 | 17(54.8) | 5.3(1.9,7.3) | 3.4(1.6,15.4) | 16.0(5.4,30.4) | 4.7±2.6 | |
| 统计值 | 1.406 | -1.973 | 0.099 | -0.539 | -0.112 | -0.651 | 0.485 | ||
| P值 | 0.236 | 0.055 | 0.753 | 0.590 | 0.911 | 0.515 | 0.630 | ||
| 组别 | 例数 | 住院天数(d)c | 出院后母乳喂养(纯或混合)a | 出院后使用PDFa | 出院时体重百分位数c | 出院时身长百分位数c | 出院时头围百分位数c | 合并PDAd | |
|---|---|---|---|---|---|---|---|---|---|
| 校正胎龄40±4周 | 无追赶生长组 | 47 | 20(12,32) | 33(70.2) | 15(32.0) | 2.5(0.9,4.5) | 5.4(1.3,15.5) | 20.8(6.2,43.8) | 8(17.0) |
| 追赶生长组 | 23 | 20(14,23) | 18(78.3) | 8(34.8) | 3.4(1.5,7.6) | 6.8(1.7,23.7) | 17.9(6.7,36.6) | 0(0) | |
| 统计值 | -0.532 | 1.047 | 0.058 | -1.719 | -0.794 | -0.524 | - | ||
| P值 | 0.595 | 0.306 | 0.810 | 0.086 | 0.427 | 0.600 | 0.046 | ||
| 校正年龄3±1.5月 | 无追赶生长组 | 24 | 30(18,45) | 16(66.7) | 8(33.3) | 2.1(0.4,4.9) | 2.3(0.2,7.6) | 9.2(2.6,32.0) | 6(25.0) |
| 追赶生长组 | 30 | 18(13,22) | 22(73.3) | 9(30.0) | 2.8(1.5,6.8) | 6.5(1.6,17.4) | 22.2(8.6,45.4) | 1(3.3) | |
| 统计值 | -2.970 | 0.091 | 0.069 | -1.288 | -2.072 | -1.597 | - | ||
| P值 | 0.003 | 0.763 | 0.793 | 0.198 | 0.038 | 0.110 | 0.036 | ||
| 校正年龄6±1.5月 | 无追赶生长组 | 16 | 32(18,45) | 12(75.0) | 5(31.3) | 2.4(1.0,3.2) | 4.2(0.6,11.0) | 9.4(2.6,25.3) | 3(18.8) |
| 追赶生长组 | 31 | 20(11,24) | 23(74.2) | 10(32.3) | 3.1(0.9,7.3) | 3.9(1.0,15.2) | 22.2(7.0,47.0) | 3(9.7) | |
| 统计值 | -2.516 | - | 0.005 | -1.212 | -0.618 | -1.753 | - | ||
| P值 | 0.012 | 1.000d | 0.944 | 0.225 | 0.537 | 0.080 | 0.395 | ||
| 组别 | 例数 | 合并轻中度BPDd | 40周时体重百分位数c | 40周时身长百分位数c | 40周时头围百分位数c | 3月时体重百分位数c | 3月时身长百分位数c | 3月时头围百分位数c | |
|---|---|---|---|---|---|---|---|---|---|
| 校正胎龄40±4周 | 无追赶生长组 | 47 | 2(4.3) | - | - | - | - | - | - |
| 追赶生长组 | 23 | 1(4.3) | - | - | - | - | - | - | |
| 统计值 | - | - | - | - | - | - | - | ||
| P值 | 1.000 | - | - | - | - | - | - | ||
| 校正年龄3±1.5月 | 无追赶生长组 | 24 | 2(8.3) | 7.2(1.7,14.4) | 9.9(0.9,23.7) | 22.0(9.2,44.5) | - | - | - |
| 追赶生长组 | 30 | 1(3.3) | 13.7(6.1,28.4) | 16.8(8.1,47.7) | 22.1(7.3,45.5) | - | - | - | |
| 统计值 | - | -2.118 | -1.920 | -0.059 | - | - | - | ||
| P值 | 0.579 | 0.034 | 0.055 | 0.953 | - | - | - | ||
| 校正年龄6±1.5月 | 无追赶生长组 | 16 | 1(6.3) | 6.2(3.2,12.1) | 14.1(1.4,23.4) | 16.0(7.8,33.3) | 6.7(1.5,10.2) | 12.7(2.8,39.4) | 7.2(2.4,38.9) |
| 追赶生长组 | 31 | 1(3.2) | 16.8(8.2,33.0) | 18.5(8.1,51.2) | 25.1(8.0,49.5) | 26.1(12.5,62.4) | 44.8(14.4,71.6) | 34.9(15.3,58.7) | |
| 统计值 | - | -2.798 | -1.790 | -1.011 | -4.043 | -2.691 | -3.106 | ||
| P值 | 1.000 | 0.005 | 0.073 | 0.312 | <0.001 | 0.007 | 0.002 | ||
注:a以例(%)表示,统计值为χ2值;b以 ±s表示,统计值为t值;c以M(Q1,Q3)表示,统计值为Z值;d以例(%)表示,采用Fisher精确概率法;PDF为出院后配方奶,PDA为动脉导管未闭,BPD为支气管肺发育不良
±s表示,统计值为t值;c以M(Q1,Q3)表示,统计值为Z值;d以例(%)表示,采用Fisher精确概率法;PDF为出院后配方奶,PDA为动脉导管未闭,BPD为支气管肺发育不良
CA 6±1.5月时失访与随访早产儿比较,随访早产儿出生胎龄偏低、住院时间偏长,与失访早产儿比较差异有统计学意义(P<0.05);两组出生及出院时体格生长状况、早期疾病情况、出院后喂养情况等差异均无统计学意义(P>0.05)。见表3。
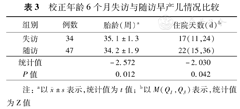
校正年龄6个月失访与随访早产儿情况比较
校正年龄6个月失访与随访早产儿情况比较
| 组别 | 例数 | 胎龄(周)a | 住院天数(d)b |
|---|---|---|---|
| 失访 | 34 | 35.1±1.3 | 17(11,24) |
| 随访 | 47 | 34.2±1.9 | 22(15,36) |
| 统计值 | -2.572 | -2.030 | |
| P值 | 0.012 | 0.042 |
注:a以 ±s表示,统计值为t值;b以M(Q1,Q3)表示,统计值为Z值
±s表示,统计值为t值;b以M(Q1,Q3)表示,统计值为Z值
多因素分析显示,胎龄(P=0.612)、出院身长百分位数(P=0.231)、住院天数(P=0.328)、校正胎龄40±4周体重百分位数(P=0.341)、校正胎龄40±4周身长百分位数(P=0.884)均不是CA 3±1.5月体重追赶生长的独立保护/危险因素。仅CA 3±1.5月体重百分位数是CA 6±1.5月体重追赶生长的独立因素(P=0.002,OR=1.221,95%CI 1.076~1.385)。按每5个百分位数分类赋值分析,结果显示,CA 3±1.5月体重百分位数每增加5%,CA 6±1.5月完成体重追赶生长的可能性增加2.965倍(95%CI 1.480~5.942)。
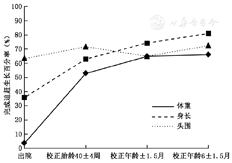
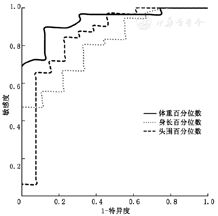
以CA 3±1.5月时体重百分位数预测CA 6±1.5月是否完成追赶生长进行ROC曲线分析,曲线下面积(area under curve,AUC)=0.931(P<0.001),最佳界值为第10.8百分位数,敏感度89.7%,特异度87.5%;CA 3±1.5月身长百分位数预测CA 6±1.5月身长是否完成追赶生长的AUC=0.807(P=0.005),最佳界值为第11百分位数,敏感度80.6%,特异度66.7%;CA 3.5月头围百分位数预测CA 6.5月头围是否完成追赶生长的AUC=0.846(P<0.001),最佳界值为第10.1百分位数,敏感度84.4%,特异度76.9%。见图3。

SGA早产儿是早产儿中更加高危的一组人群,不仅体现在体格生长水平低,还体现在疾病易感性增加,包括出生早期高死亡率、更长时间的机械通气和应用激素治疗、更高的慢性肺疾病(chronic lung disease,CLD)风险、氧疗时间更长、早产儿视网膜病(retinopathy of prematurity,ROP)Ⅲ期的风险更高[14,15]。同时,随访研究也发现,SGA早产儿在成长期也存在脑瘫发生率增加、2 h血糖水平升高、胰岛素生成指数显著降低等代谢问题[16,17],甚至在成年期发生高血压和2型糖尿病的风险更高,低IQ和身材矮小的风险也更高[18]。
SGA早产儿出生后即受到额外关注,住院期间予以积极的营养支持和综合管理,但由于现行的营养支持策略和早期疾病等影响,出院时难以改变其体格生长落后的状况。本研究结果显示,尽管经过住院期间的积极干预、综合护理及营养支持,SGA早产儿出院时生长迟缓问题仍进一步加剧。Hair等[19]和Senterre和Rigo[20]研究结果显示,SGA早产儿出院时100%或80%仍为SGA,与本研究结果类似。此现象提示加强SGA早产儿医院内及出院后管理的必要性及存在的挑战。
本组研究对象住院期间及出院后营养管理均经过个体化体格生长评估决定,体重<相应性别、年龄第25百分位数时予以强化营养素喂养,包括使用母乳强化剂或早产儿出院后配方奶,整体营养方案在我国2013年"中国新生儿营养支持临床应用指南"[10]出台前后没有区别。恢复出生体重的时间间接反映了早期的液体入量及营养状态,生后给予母乳加强化剂或早产儿配方奶有助于生后早期的体重增长[19,21],恢复出生体重时间越早,早期体重增长越快。对于极/超低出生体重早产儿出院后继续营养强化的讨论、研究不断开展,但专注于SGA早产儿的研究有限。通常认为,需额外关注SGA早产儿早期营养,避免进一步发育落后并需控制强化程度,但是Guellec等[22]研究并未发现早期营养强化对远期认知和学习能力有帮助。Boguszewski等[18]研究结果显示,SGA婴儿快速追赶生长与远期代谢紊乱有关,与同年龄适于胎龄婴儿比较,1岁时有追赶生长的SGA婴儿空腹血糖水平和胰岛素抵抗比例更高。早产/低出生体重儿从足月至4个月时快速线性生长与18岁时的超重或肥胖有相关性[23]。
本研究结果显示,女婴、恢复出生体重时间晚、存在PDA限制液体入量是影响校正胎龄40周时SGA早产儿体格生长的主要因素。Bertino等[24]研究发现,患有包括PDA在内的内科疾病的极低出生体重儿与健康适于胎龄儿相比生长发育更差,与本文结果一致。合并PDA导致体重追赶欠佳的原因可能与PDA时限制液量有关。随着动脉导管关闭,液量及热卡不再受到限制,体重的追赶生长不再有差异。本研究未发现BPD对体格生长的影响,主要与本组研究对象胎龄较大、BPD病情较轻有关。
早产儿早期追赶生长是预测后期追赶生长的重要因素,也是影响成人期体格状态的因素[25,26]。本研究结果显示,出院至CA 3±1.5月是SGA早产儿体格生长干预治疗的最佳时间窗,经出院后继续干预及管理,校正胎龄40±4周及CA 3±1.5月时,体重、身长有快速增加的趋势,约2/3 SGA早产儿完成追赶生长。CA 3±1.5月时各项体格生长百分位数仍低于第10~11百分位数,则预计CA 6±1.5月时继续存在生长迟缓的可能性较大。CA 3±1.5月时体重百分位数每提高5个百分位数,CA 6±1.5月龄时完成体重追赶生长的可能性增加2.965倍。SGA早产儿CA 3个月生长状况对CA 6个月生长水平的预测有助于提示需高度关注的高危婴儿,利于对高危婴儿家长进行随访必要性的提醒,进一步加强CA 3个月时生长迟缓婴儿CA 3~6个月期间的管理及营养支持非常必要。Knops等[25]对1 338例胎龄<32周和(或)出生体重<1 500 g的新生儿进行了10年的随访发现,3个月时体重>3 500 g与5岁时达到正常身高存在相关性。Claas等[27]研究发现SGA早产儿伴有头围追赶生长者正常认知预后的比例高于无追赶生长者,Cooke[3]认为出院时完成追赶生长对后期神经系统发育非常重要。
Darendeliler等[28]研究结果显示,早产儿出生时体格生长状况及SGA类型影响后续生长,而本研究未发现此现象,考虑与本研究着眼于早产儿中的SGA婴儿这一特殊群体有关,这部分人群出生时体重及百分位数均低,因此未显示出生时体格生长状况对后续生长的影响。本研究CA 6±1.5月时失访SGA早产儿胎龄偏大、住院时间稍短,因此可能高估本组人群生长迟缓的发生率。
综上所述,SGA早产儿校正足月后追赶生长持续存在,约2/3婴儿CA 6个月时完成追赶生长。CA 3个月内是早期干预的重要时间窗,CA 3个月的体格生长参数可较好的预测CA 6个月是否完成追赶生长。我们今后需继续增加随访比例,延长随访时间,并关注早期体格生长对婴幼儿、儿童乃至青春期、成人时期的体格生长及健康的影响。