
探讨胎龄<32周早产儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)与早产儿脑病(encephalopathy of prematurity,EOP)的相关性。
回顾性配对研究,选取2009—2014年本院新生儿科收治的胎龄<32周并在校正胎龄足月或近足月时完成头颅磁共振成像(magnetic resonance imaging,MRI)检查的早产儿。将罹患NEC的早产儿纳入NEC组;根据胎龄、出生体重1∶2配对,选取非NEC早产儿为对照组。采用χ2检验分析两组早产儿发生EOP的情况及影像学特点。
共纳入早产儿312例,其中NEC组104例,对照组208例。NEC组EOP发生率高于对照组(27.9%比17.3%),差异有统计学意义(P=0.030)。两组早产儿头颅MRI检查结果以非囊性EOP为主,且NEC组非囊性EOP比例高于对照组(89.7%比63.9%),差异有统计学意义(P=0.017)。
胎龄<32周早产儿NEC与EOP的发生可能具有一定相关性,头颅MRI影像学表现以非囊性损伤为主。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
世界卫生组织统计全球早产儿发生率约为10%,胎龄<32周早产儿每年出生约230万[1]。研究显示,早产儿有不良神经发育预后的风险[2,3]。2005年Volpe[4]首次提出了早产儿脑病(encephalopathy of prematurity,EOP)的概念,其是指以早产儿为高发人群,以脑白质病变为主,且常合并其他部位脑损伤的疾病。EOP是导致早产儿不良神经发育预后的重要原因之一[5]。新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿重症监护病房较常见危重症,发生率1%~5%[6],病死率高达15%~30%[7],存活患儿常伴有神经发育不良,有研究显示早产儿NEC与EOP密切相关[8,9]。已有远期随访研究证实校正胎龄足月时头颅磁共振成像(magnetic resonance imaging,MRI)检查可有效预测EOP患儿的预后情况[5,10]。本文通过回顾性配对研究探讨胎龄<32周罹患NEC的早产儿在校正胎龄足月时头颅MRI情况,从而了解NEC与EOP的相关性,以期为EOP的早期防治提供依据。
回顾性选取2009—2014年本院新生儿科收治的胎龄<32周早产儿。纳入标准:(1)患儿在校正胎龄足月或近足月时完成了头颅MRI检查;(2)临床资料完整。排除标准:(1)NEC组排除Ⅰ期NEC患儿;(2)MRI结果显示脑室内或脑实质出血、脑梗死、脑畸形、核黄疸等;(3)有先天畸形或染色体异常、遗传代谢病、产前检查已明确存在颅脑异常的患儿;(4)放弃治疗、死亡、转院等患儿。
根据患儿出院诊断将罹患NEC(Ⅱ期或Ⅲ期)的患儿纳入NEC组,按1∶2的比例选取胎龄、出生体重相近的非NEC患儿为对照组。
患儿一般资料,包括性别、胎龄、出生体重、母亲年龄、母亲妊娠期合并疾病情况、患儿出生时情况等。
早产儿于校正胎龄足月或近足月时生命体征平稳下行头颅MRI检查(西门子AVANTO 1.5T超导型MR扫描系统)。患儿检查前15~30 min给予药物镇静,用棉花团堵塞外耳道以减轻机器噪音,头部棉垫适当固定减少运动伪影。头颅MRI结果均由2名资深影像科医生分析,共同得出诊断报告。
应用SPSS 19.0软件进行统计分析。符合正态分布的计量资料以 ±s表示,组间比较采用t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数Mann-Whitney U检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,组间比较采用t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用非参数Mann-Whitney U检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
研究期间共1 115例胎龄<32周早产儿完成颅脑MRI检查,纳入NEC组104例,其中Ⅱ期73例(70.2%),Ⅲ期31例(29.8%)。根据胎龄、出生体重1∶2配对,对照组纳入208例。两组早产儿基本资料比较差异无统计学意义(P>0.05)。见表1。
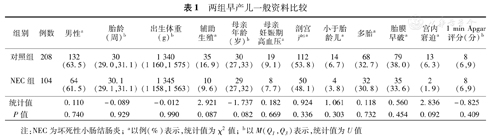
两组早产儿一般资料比较
两组早产儿一般资料比较
| 组别 | 例数 | 男性a | 胎龄(周)b | 出生体重(g)b | 辅助生殖a | 母亲年龄(岁)b | 母亲妊娠期高血压a | 剖宫产a | 小于胎龄儿a | 多胎a | 胎膜早破a | 宫内窘迫a | 1 min Apgar评分(分)b |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 对照组 | 208 | 132(63.5) | 30(29.0,31.1) | 1 340(1 160,1 575) | 35(16.9) | 30(27,33) | 19(9.1) | 112(53.8) | 14(6.7) | 68(32.7) | 79(38.0) | 13(6.3) | 8(6,9) |
| NEC组 | 104 | 64(61.5) | 30.1(29.1,31.1) | 1 345(1 158,1 563) | 10(9.6) | 29(27,32) | 8(7.7) | 50(48.1) | 4(3.8) | 32(30.8) | 35(33.6) | 2(1.9) | 8(6,9) |
| 统计值 | 0.110 | -0.089 | -0.012 | 2.921 | -1.737 | 0.182 | 0.924 | 1.061 | 0.118 | 0.560 | 2.836 | -0.825 | |
| P值 | 0.740 | 0.929 | 0.990 | 0.087 | 0.082 | 0.669 | 0.336 | 0.303 | 0.732 | 0.454 | 0.092 | 0.409 |
注:NEC为坏死性小肠结肠炎;a以例(%)表示,统计值为χ2值;b以M(Q1,Q3)表示,统计值为U值
共纳入NEC患儿104例,发病日龄21(14,32) d,发病时校正胎龄33.4(32.0,34.7)周。Ⅱ期73例,其中ⅡA期62例(59.6%),ⅡB期11例(10.6%);Ⅲ期31例,其中ⅢA期11例(10.6%),ⅢB期20例(19.2%)。急性期手术治疗25例,其中ⅡA期1例,ⅢA期10例,ⅢB期14例。
NEC组患儿发生EOP 29例(29/104,27.9%),对照组发生EOP 36例(36/208,17.3%),两组EOP发生率差异有统计学意义(χ2=4.703,P=0.030)。Ⅱ期NEC患儿发生EOP 25例(25/73,34.2%),Ⅲ期NEC患儿发生EOP 4例(4/31,12.9%),Ⅱ期NEC患儿EOP发生率高于Ⅲ期NEC患儿,差异有统计学意义(χ2=7.061,P=0.008)。急性期手术治疗NEC患儿发生EOP 3例(3/25,12.0%),非手术治疗NEC患儿发生EOP 26例(26/79,32.9%),两组差异无统计学意义(χ2=3.155,P=0.076)。
两组患儿头颅MRI检查EOP形式均以非囊性EOP为主。NEC组患儿发生EOP 29例,其中MRI结果为非囊性EOP 26例(89.7%),囊性EOP 3例(10.3%);对照组发生EOP 36例,其中非囊性EOP 23例(63.9%),囊性EOP 13例(36.1%)。NEC组非囊性EOP比例高于对照组,差异有统计学意义(OR= 1.403,95%CI 1.066~1.847 ,χ2=5.746,P=0.017)。具体情况见表2、图1。

两组患儿MRI检查EOP发生情况(例)
两组患儿MRI检查EOP发生情况(例)
| EOP形式 | 分布部位 | NEC组(n=104) | 对照组(n=208) | χ2值 | P值 |
|---|---|---|---|---|---|
| 囊性 | 3 | 13 | 1.614 | 0.204 | |
| 脑室体部周围白质 | 3 | 5 | |||
| 非囊性 | 26 | 23 | 10.180 | 0.001 | |
| 多发 | 3 | 1 | |||
| 脑叶白质损伤+基底节损伤 | 2 | 2 | |||
| 脑叶白质损伤+脑室周围白质损伤 | 1 | 0 | |||
| 单独脑叶白质损伤 | 9 | 10 | |||
| 单独脑室周围白质损伤 | 8 | 5 | |||
| 单独基底节损伤 | 3 | 3 | |||
| 胼胝体损伤 | 0 | 1 | |||
| 内囊后肢损伤 | 0 | 1 |
注:MRI为磁共振成像,EOP为早产儿脑病,NEC为坏死性小肠结肠炎
EOP发病原因及致病机制较复杂,目前仍未完全明确,通常认为多因素通过多种机制共同导致。胎龄、出生体重是EOP最主要的高危因素[13]。NEC在新生儿重症监护病房发生率为1%~5%[6],出生体重<1 500 g早产儿发生率为12%[14],病死率高达15%~30%[7],20%~40%需手术治疗。目前较多研究发现,NEC早产儿存在神经发育不良预后。Rees等[9]Meta分析结果显示,NEC组患儿45%存在神经发育损害(OR=1.58,95%CI 1.25~1.99,P=0.0001),更多患儿合并脑瘫(OR=1.55,95%CI 1.19~2.03,P=0.001)、视觉障碍(OR=2.31,95%CI 1.04 ~5.11,P=0.04)、认知障碍(OR=1.72,95%CI 1.35~2.19,P<0.0001)、精神运动损害(OR=1.71,95%CI 1.34~2.18,P<0.0001)等。Youn等[13]一项多中心配对研究显示,极低出生体重NEC患儿脑室周围白质软化发生率较非NEC患儿更高(24.5%比13%,P=0.004)。本文结果显示,胎龄<32周早产儿NEC组EOP发生率高于对照组,提示NEC可能导致EOP的发生,进而影响神经发育预后。
NEC分期可用于NEC严重程度评估,Ⅲ期NEC患儿通常需要手术治疗。有研究显示NEC需要手术的患儿病死率高达50%[15],手术治疗也是NEC严重程度的标志之一[16],故通常认为Ⅲ期NEC患儿和手术治疗的NEC患儿神经发育预后可能更差。Rees等[9]Meta分析结果显示,Ⅲ期NEC或手术治疗的NEC患儿神经发育损害更多(OR=2.34,95%CI 1.51~3.60,P=0.0001)。Hintz等[8]一项多中心回顾性研究显示,手术治疗的超低出生体重NEC患儿(n=124)合并脑室周围白质软化比例较非NEC患儿(n=121)更高(13.7%比6.5%,P=0.005),认为手术治疗是NEC患儿神经发育损伤的独立危险因素(OR=1.78,95%CI 1.17~2.73)。Adesanya等[16]研究发现,出生体重<1 500 g早产儿,NEC致肠穿孔早产儿较非NEC肠穿孔早产儿Bayley Ⅱ评估智力发育指数和心理发育指数评分更低。本文尚未发现Ⅲ期NEC患儿或急性期手术治疗的NEC患儿EOP发生率较Ⅱ期NEC患儿高,可能与此类患儿病情较重,病死率和放弃治疗比例相对较高,通常不能完成MRI检查,故未能纳入本研究有关。
Volpe[17]认为导致早产儿神经预后不良的致病因素之一为EOP,且以非囊性EOP为主。目前研究认为,非囊性EOP较囊性EOP预后较好,多与认知缺陷、语言落后、行为异常,以及情绪控制障碍、工作记忆障碍等有关[18]。本研究结果显示,将常见的围产期高危因素引起的统计偏倚予以排除,在一定程度上证明了胎龄<32周早产儿NEC与EOP的发生可能有一定相关性。但是仍有其他许多高危因素可能与NEC、EOP存在一定关系,仍需进一步研究。
有研究显示,NEC发生时循环不稳定导致的全身炎症反应[19]和组织灌注不足[20]可能是导致EOP发生的机制。NEC常伴有严重的全身炎症反应,包括肿瘤坏死因子α、白细胞介素1、白细胞介素6、白细胞介素8、白细胞介素10、白细胞介素12、白细胞介素18、血小板活化因子、一氧化氮等大量炎症介质释放[6,21],可进一步活化小胶质细胞,使少突胶质细胞前体细胞受损,引起髓鞘化障碍、轴突发育异常[21]。Schat等[20]研究发现,NEC组患儿较对照组更易合并脑血管调节异常(60.0%比38.5%),而血管调节异常可能与NEC时的血流动力学变化有关。另有研究发现发生NEC时存在血管内皮生长因子、一氧化氮的异常变化,二者均是参与血管调节的重要物质,可能对脑组织灌注产生影响。故NEC致EOP的机制需要进一步研究明确。
本研究显示,NEC组EOP患儿的头颅MRI表现主要以非囊性损伤为主(89.7%),这种损伤头颅B超难以发现,需要MRI检查进行诊断。NEC早产儿患EOP比例较高,且MRI表现以非囊性EOP为主,需加强早期头颅MRI评估及神经预后评估随访,早期干预,以改善预后。



























