
新生儿坏死性小肠结肠炎是新生儿重症监护室中一种发生率较高的严重胃肠道急症,尚缺乏有效的干预手段。外泌体不仅可作为细胞间通讯的重要媒介参与疾病的发生发展,还可作为药物载体用于疾病的治疗。本文就外泌体对坏死性小肠结肠炎的治疗作用前景进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是新生儿尤其是早产儿最常见的胃肠道急症之一,也是诱发肠穿孔和全身炎症反应综合征的重要原因[1]。NEC在我国低出生体重儿和极低出生体重儿中发病率分别为2.50%和4.53%[2]。NEC病程长、预后差,存活的患儿常伴有短肠综合征、肠狭窄和远期神经发育障碍等多种后遗症,不仅严重影响患儿生存质量,还给患儿家庭和社会带来沉重的负担[3]。外泌体是由细胞分泌的一种具有脂质双层膜结构的微小膜泡,普遍存在于各种体液中[4]。作为细胞间交流的天然载体,外泌体在NEC等炎性肠病中的治疗潜能逐渐引起国内外学者的关注。因此,本文拟对母乳、干细胞等多种来源外泌体用于NEC治疗的前景展开综述。
外泌体是不同于微囊泡和凋亡小体的一种细胞外囊泡亚型,通常指初级核内体经过细胞质膜内陷后以外泌形式释放、直径50~150 nm、杯形的脂质双层囊泡[5],见表1。外泌体中含有亲本细胞来源的蛋白质(Mix、TSG101、CD63、CD9等)、核酸(DNA、miRNA、mRNA、lncRNA等)、脂质等多种成分,可以反映亲本细胞的生理状态并发挥功能[6,7]。因此,对外泌体不同内容物的研究可从不同角度揭示外泌体的功能。小胶质细胞可通过外泌体促进Tau蛋白向神经元传播及Tau蛋白在脑内各区域扩散,加速患者认知功能的丧失[8]。肺癌细胞外泌体来源的miR-21进入受体细胞后能通过活化信号传导与转录激活因子3上调血管内皮生长因子表达水平,促进肺癌细胞转移和血管生成[9]。甲状腺癌干细胞分泌的外泌体可向正常甲状腺细胞传递lncRNA,诱发正常甲状腺细胞发生上皮细胞-间充质转化[10]。外泌体通过其内容物介导细胞间物质运输及信号传递,参与细胞存活与凋亡、血管新生、血栓形成、炎症免疫反应等,在生理状态维持及疾病进程中发挥重要作用。外泌体天然存在于体液中,具有稳定的膜结构、良好的生物相容性、高生物渗透性、低免疫原性、低毒性等特征,已成为一种极具前景的药物载体。目前通过皂苷处理法、孵育法、冻融循环法、超声法、挤出法和基因工程等技术可实现外泌体载药(将药物包封于外泌体,实现药物的靶向递送),但存在载药周期长、载药量和载药过程不可控等缺点,限制了临床应用[11]。虽然外泌体载药有望成为治疗NEC的新手段,但方法和技术仍需进一步完善。
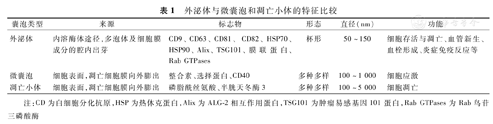
外泌体与微囊泡和凋亡小体的特征比较
外泌体与微囊泡和凋亡小体的特征比较
| 囊泡类型 | 来源 | 标志物 | 形态 | 直径(nm) | 功能 |
|---|---|---|---|---|---|
| 外泌体 | 内溶酶体途径,多泡体及细胞膜成分的腔内出芽 | CD9、CD63、CD81、CD82、HSP70、HSP90、Alix、TSG101、膜联蛋白、Rab GTPases | 杯形 | 50~150 | 细胞存活与凋亡、血管新生、血栓形成、炎症免疫反应等 |
| 微囊泡 | 细胞表面,凋亡细胞膜向外膨出 | 整合素、选择蛋白、CD40 | 多种多样 | 100~1 000 | 细胞应激 |
| 凋亡小体 | 细胞表面,凋亡细胞膜向外膨出 | 磷脂酰丝氨酸、半胱天冬酶3 | 多种多样 | 100~5 000 | 细胞凋亡 |
注:CD为白细胞分化抗原,HSP为热休克蛋白,Alix为ALG-2相互作用蛋白,TSG101为肿瘤易感基因101蛋白,Rab GTPases为Rab鸟苷三磷酸酶
NEC的发病机制尚不明确,胃肠道发育不完全是早产儿发生NEC的主要原因,喂养成分、喂养方式、肠道微生态、肠道黏膜易感性等也与NEC的发生有关,可导致肠黏膜屏障受损,抑制肠上皮细胞增殖、凋亡和迁移,最终造成肠壁局灶性坏死[12]。外泌体是机体自身分泌产生的无细胞结构囊泡,免疫排斥反应低,无异常增殖风险,并且可通过靶向到达特定组织,传递蛋白、脂类、RNA等信号调控分子,参与细胞间通讯。基于这些特性,母乳、间充质干细胞(mesenchymal stem cell,MSCs)等来源的外泌体对NEC治疗具有良好的应用前景。
临床诊疗指南明确指出母乳喂养可显著降低NEC的发病率[13],但母乳中发挥保护活性的成分尚未完全阐明。随着多种生物活性因子相继在母乳中被发现[14],人们对母乳的认识已不再局限于单纯营养作用。研究发现,表皮生长因子、乳铁蛋白和生物活性肽等母乳成分可有效预防新生儿感染,抵抗炎症反应,促进肠道菌群建立、免疫成熟和器官发育,进而预防NEC的发生[15,16]。随着我国人类母乳库陆续建立,母乳喂养得到全面普及的同时,早产儿获得母乳的途径也得到了有效保障[17]。因此,深入挖掘母乳中有保护作用的新型有效成分可能为NEC的防治提供新策略。
动物研究发现母乳外泌体可促进子代肠道发育、对抗NEC损伤。用猪乳来源的外泌体灌胃后,小鼠肠道增殖细胞核抗原PCNA表达升高,核转录因子p53基因表达下降,肠绒毛增高,隐窝加深,肠组织增殖能力增强[18]。细胞水平研究发现牛乳来源外泌体可显著促进肠道杯状细胞系增殖和黏蛋白MUC2表达,抑制NEC相关的炎症指标水平[19]。Hock等[20]还发现大鼠乳源外泌体可增强肠上皮细胞增殖能力,促进肠道干细胞标记物Lgr5的表达,提示乳源外泌体或许能通过促进肠道干细胞增殖和分化对抗NEC损伤。
人乳来源的外泌体也可以保护肠上皮细胞免受氧化应激的影响,减轻肠黏膜损伤[21,22]。人乳外泌体尤其是早产母乳来源的外泌体可显著促进小肠上皮细胞增殖和迁移,对抗NEC损伤,部分恢复NEC大鼠肠道上皮的增殖和迁移功能[23],这提示母乳来源外泌体对肠道起重要保护作用。但母乳来源外泌体通过何种途径对NEC的防治发挥作用尚不明确。已知成熟的miRNA与RNA诱导沉默复合体结合后,可通过与其靶mRNA的3′端非编码区结合,抑制靶mRNA翻译或导致其降解,进而影响细胞生长、代谢等多种生物学过程。miR-22-3p是母乳中可以检测到的最丰富的外泌体miRNA之一,miR-22-3p表达上调能显著抑制NEC的关键炎症信号分子核因子κB活性[24,25]。此外,乳源外泌体中的miR-125b也可下调p53基因表达[24]。外泌体不仅可保护miRNA免受消化酶消化,还可作为miRNA成熟场所,明显改善miRNA被吸收率和作用效能[26]。上述研究初步表明,外泌体miRNA与肠道上皮细胞增殖、凋亡及迁移等与肠道修复相关的生物过程密切相关,有望为NEC的防治提供新的治疗靶点和思路。
富集于母乳中的外泌体有良好的安全性和生物相容性,已成为极具应用前景的新型药物载体。中药姜黄素与乳源外泌体共孵育后可显著抑制乳腺癌、肺癌、宫颈癌等肿瘤细胞系的增殖和成瘤能力,较单独姜黄素处理组的抑制效果高3~5倍[27]。此外,乳源外泌体可促进姜黄素抑制巨噬细胞释放白细胞介素6和肿瘤坏死因子α等炎症因子[27],也可显著增强姜黄素对抗大鼠NEC的作用[28]。质谱分析发现,乳源外泌体可通过增加溶解度、稳定性和生物利用度增强姜黄素的作用效果。这提示乳源外泌体作为新型药物载体对NEC防治有良好前景。除了作为外源性药物的载体,母乳还含有多聚糖、寡糖、活性蛋白、多肽等多种对NEC有防治作用的生物活性物质。其中多聚糖可降低致病菌黏附,保护早产儿肠上皮细胞免受细菌侵袭与损伤[29];低聚糖可调控新生儿肠道菌群,促进双歧杆菌和乳酸杆菌生长,有助于新生儿肠道菌群抵抗病原微生物[30]。糖巨肽是母乳中κ-酪蛋白被凝乳酶水解后所产生的多肽片段,有减轻肠道感染、维持肠道微生态平衡等作用,对NEC新生大鼠肠道有保护作用[31]。如能利用母乳外泌体良好的载药特性,以外源或内源活性物质作为内容物,通过共孵育等方案改造母乳外泌体,对内容物的活性与稳定性进一步优化,有望为NEC的防治开发新的治疗手段。
干细胞疗法是近年治疗NEC的一种新型细胞疗法,因其免疫原性低、多向分化潜能高,具有良好的临床转化潜能[32,33]。外源性MSCs移植可显著改善NEC模型大鼠体重、临床疾病评分和肠道病理损伤[34]。研究发现MSCs移植后在体内实验中分化作用微弱,不足以解释其功能,提示MSCs移植的保护效应很可能存在其他机制;旁分泌作用介导的细胞间相互作用是MSCs参与组织修复的主要机制,而外泌体正是MSCs发挥旁分泌作用的良好通讯载体[35]。新近研究发现,MSCs来源外泌体可发挥与MSCs类似的功能,包括修复组织损伤、抑制炎症反应和调节免疫系统等[36]。Rager等[35]发现将骨髓来源MSCs产生的外泌体经腹腔注射后可显著降低新生大鼠NEC的发生率和严重程度,有利于维持肠道屏障的完整性。MSCs外泌体可能通过内含的抗凋亡miRNAs(如miR-15b和miR-34c)、伤口愈合相关的mRNA以及生长因子受体发挥作用[37]。此外,其他类型干细胞分泌的外泌体也展现出对NEC不同程度的防治潜能,如羊水MSCs、羊水神经干细胞来源外泌体以及新生儿肠道神经干细胞来源外泌体等[38,39]。其中,羊水来源的MSCs具有来源丰富、易于采集和运输、增殖活性佳等优势,可作为干细胞外泌体的稳定来源。进一步对干细胞来源的外泌体进行改造,例如将肠道细胞保护剂肝素结合样表皮生长因子与干细胞来源外泌体共孵育后给药,有望增强外泌体的肠道保护能力[40]。鉴于干细胞外泌体良好的生物特征及在调节肠道功能中的潜在活性,干细胞来源外泌体作为NEC的无细胞治疗剂已初具优势;其作为药物及药物载体应用于NEC治疗具有巨大的潜能。
肠道菌群失调与NEC发病有密切关系,NEC患儿生后早期初始化菌群定植模式存在异常,尤其在NEC发生之前,肠道菌群结构已发生质和量的变化。研究表明,细菌来源的外泌体样膜外囊泡可与免疫细胞相互作用,调节炎症反应,将毒力因子(如酶、DNA和RNA)转运至宿主细胞并导致细胞损伤[41]。细菌外泌体样膜外囊泡可通过刺激肠上皮细胞紧密连接蛋白表达增强屏障功能,使内皮细胞黏附分子表达上调,促进抗原呈递,诱导肠道局部过度炎症反应和肠道菌群失调,进而导致NEC的发生[42]。如能针对性干预肠道菌群外泌体样膜外囊泡的释放,维持宿主-菌群之间的动态平衡,或能阻断NEC的发生。
外泌体是细胞经过内吞-融合-外排等一系列调控过程而形成的纳米级细胞外小囊泡,是细胞间交流的天然载体,有望用于NEC的治疗。此外外泌体由于具有无细胞结构、易于改造、对靶细胞亲和力佳、广泛存在、在体半衰期长等优势,有望成为良好的药物载体。今后需要对母乳、干细胞和其他来源外泌体的内容物、靶向性和作用机制进行进一步研究,以期发现治疗NEC的新思路和方法。
所有作者均声明不存在利益冲突



























