
探讨内皮前体细胞来源的微囊泡(endothelial progenitor cells-derived microvesicles,EPC-MVs)对缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)的保护作用及机制。
培养大鼠内皮前体细胞(endothelial progenitor cells,EPCs),使用超速离心法从EPCs培养液中提取微囊泡。选择健康7日龄新生SD大鼠60只,随机分为对照组、HIBD组、生理盐水组、EPC-MVs组,每组各15只。HIBD组、生理盐水组、EPC-MVs组制备HIBD模型,生理盐水组、EPC-MVs组分别在HIBD模型制备完成后予脑室内注射生理盐水、EPC-MVs,72 h后处死大鼠取脑组织,TTC染色检测脑组织梗死情况、实时荧光定量聚合酶链反应检测血管内皮生长因子(vascular endothelial growth factor,VEGF)mRNA、蛋白免疫印迹检测VEGF蛋白表达变化。
从12周龄SD大鼠脾脏提取及培养的细胞经形态学及流式细胞术检测确认为EPCs。EPCs培养上清中高速离心分离获得的EPC-MVs经透射电镜观察符合微囊泡的形态学特征。对照组未检测到梗死脑组织,HIBD组、生理盐水组、EPC-MVs组脑梗死体积比分别为(80.3±6.3)%、(77.9±8.9)%、(35.2±7.7)%,EPC-MVs组小于HIBD组和生理盐水组(P<0.001)。HIBD组、生理盐水组、EPC-MVs组脑组织VEGF mRNA及蛋白表达均高于对照组(P<0.001),EPC-MVs组高于HIBD组和生理盐水组(P<0.001),生理盐水组和HIBD组间差异无统计学意义(P>0.05)。
脑室内注射EPC-MVs可减轻新生大鼠HIBD的程度,其机制可能与上调VEGF表达相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是新生儿最常见的严重疾病之一,目前仍缺乏有效的治疗手段,多数病例预后不良[1]。内皮前体细胞(endothelial progenitor cells,EPCs)对维持血管壁的完整性及血管损伤修复起重要作用[2],缺氧缺血时EPCs可活化,对脑神经损害发挥保护作用[3,4]。然而,将EPCs应用于HIBD的治疗还面临诸多挑战[5]。微囊泡是细胞在生理或病理情况下分泌产生的异质性膜分泌体系,直径30~1 000 nm,富含生物信息传递媒介,携带母细胞来源相关的多种蛋白质、脂类、DNA、mRNA、微小RNA等,可将母体细胞的重要生物学特性传递到靶细胞中,是细胞间通信的一种新机制[6,7]。本研究选择7日龄新生SD大鼠建立HIBD模型,收集体外培养EPCs分泌微囊泡,通过脑室内注射内皮前体细胞来源的微囊泡(endothelial progenitor cells-derived microvesicles, EPC-MVs),探讨EPC-MVs对HIBD是否存在保护作用。
健康12周龄清洁级SD大鼠10只(雌雄不限)、7日龄清洁级新生SD大鼠60只(雌雄不限),均由第三军医大学实验动物中心提供,动物许可证编号:SYXK(渝)2017-0001。7日龄新生SD大鼠随机分为对照组、HIBD组、生理盐水组、EPC-MVs组,每组15只。
主要材料为内皮细胞培养基EBM-2、胎牛血清(Gibco公司,美国),实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒(Takara公司,日本),蛋白测定试剂盒及RNA提取试剂Trizol(碧云天公司,中国),2,3,5-氯化三苯基四氮唑(2, 3, 5-triphenyltetrazolium chloride,TTC)试剂(Sigma公司,美国);山羊抗鼠单抗CD133-APC、CD34-FITC(eBioscience公司,美国)、兔抗鼠单抗vWF-FITC(Abcam公司,美国)、兔抗鼠单抗Flk-1-AF647(BioLegend公司,美国);兔抗大鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)及GAPDH、山羊抗兔IgG(Abcam公司,美国),ECL增强化学发光检测试剂盒(PIERCE公司,美国)。主要设备为二氧化碳培养箱(三洋公司,日本),低温高速离心机(Beckman公司,美国),实时荧光定量PCR仪(Funglyn Biotech公司,加拿大),流式细胞检测仪(BD公司,美国),透射电镜(飞利浦公司,荷兰),缺氧实验箱(捷普瑞公司,中国),蛋白免疫印迹装置(Bio-Rad公司,美国),凝胶成像系统(天能公司,中国)。
将12周龄SD大鼠脱臼处死,无菌条件下取出大鼠脾脏并剪成小块,在筛网上研磨后以无菌磷酸盐缓冲液冲洗,收集细胞悬液,加于淋巴细胞分离液上,保持其分界面,采用密度梯度离心法分离并获得单个核细胞,使用含有5%胎牛血清的EBM-2培养基重悬,调整细胞浓度为1×108/ml接种于纤连蛋白预先包被的培养皿中,置于37 ℃、5%CO2的恒温培养箱中培养。3 d后首次换液,之后每2 d换液一次。
收集生长良好的第3代(P3)细胞,调整细胞浓度为1×109 /ml的单细胞悬液于EP管中,分别加入10μl CD133-APC、CD34-FITC、vWF-FITC以及Flk-1-AF647(抗体浓度为1∶100)避光孵育30 min,以同型IgG为对照,流式细胞术检测细胞免疫表型。目前尚无EPCs特异性细胞标志物,将CD133、CD34、vWF以及Flk-1均为阳性作为鉴定EPCs的方法[8,9]。
取EPCs培养上清,采用梯度离心法获得EPC-MVs[10]。具体方法:4℃、300×g离心5 min去除细胞;取上清4℃、1 200×g离心20 min去除大的细胞碎片和颗粒;取上清4℃、10 000×g离心40 min去除细胞器和细胞颗粒;取上清4℃、110 000×g离心1 h,沉淀后即为EPC-MVs。应用透射电镜对EPC-MVs进行形态学鉴定,蛋白测定试剂盒测定EPC-MVs蛋白浓度,用生理盐水制成浓度为0.1 mg/ml的EPC-MVs混悬液备用。
HIBD模型采用改良Rice法[11],7日龄新生大鼠乙醚吸入麻醉,分离右侧颈总动脉,双线结扎后切断。术后恢复0.5 h后放入8%氧气与92%氮气的室温低氧混合气体缺氧舱内,通气2.5 h,气体流量2 L/min。对照组为假手术组,仅分离右侧颈总动脉,不予结扎动脉及低氧处理,HIBD组仅接受HIBD模型制备,生理盐水组在HIBD模型制备后予脑室内注射生理盐水,EPC-MVs组在HIBD模型制备后予脑室内注射EPC-MVs。
生理盐水组、EPC-MVs组大鼠在HIBD模型制备完毕后,乙醚浅麻醉,参照大鼠脑立体定位图谱,在脑立体定向仪引导下用5 μl微量进样器向实验动物侧脑室内分别注射5 μl生理盐水及5 μl EPC-MVs(0.5 μg),缓慢注射5 min,留针约5 min后缓缓拔出注射器。实验动物在脑室内注射72 h后处死、断头取脑,进行后续检测。
将脑组织在4℃生理盐水中冰冻5 min,沿冠状面作2 mm厚度连续切片。将切片置于2% TTC溶液中,37℃避光孵育30 min,磷酸盐缓冲液清洗后,使用4%多聚甲醛固定。染成红色的为正常脑组织,白色为梗死脑组织。使用Image J软件分析每只新生SD大鼠脑组织的相对脑梗死体积。计算公式:脑梗死体积比(%)=(健侧大脑半球体积-梗死侧非梗死区大脑半球体积)/健侧大脑半球体积×100%。
根据GenBank大鼠VEGF基因序列设计及合成引物,以β-actin为内参基因,见表1。提取脑组织RNA,逆转录后进行实时荧光定量PCR。扩增参数:95℃ 4 min,95℃ 20 s,60℃ 30 s,72℃ 30 s,共35个循环。每个样本做3个复孔。采用2-ΔΔCT法进行相对定量。

实时荧光定量聚合酶链反应引物
实时荧光定量聚合酶链反应引物
| 基因名称 | 引物序列 | 长度 |
|---|---|---|
| VEGF | 上游引物:5′- CAAAGCCAGCACATAGGAGAGA -3 | 71 bp |
| 下游引物:5′- CTATCTTTCTTTGGTCTGCATTCAC -3′ | ||
| β-actin | 上游引物:5′- CCCATCTATGAGGGTTACGC -3′ | 150 bp |
| 下游引物:5′- TTTAATGTCACGCACGATTTC -3′ |
注:VEGF为血管内皮生长因子,β-actin为内参基因
脑组织加入液氮充分研磨,加入RIPA裂解液、苯甲基磺酰氟100∶1混合液,冰上裂解30 min,13 000×g 4℃离心15 min,取上清液BCA法测定蛋白浓度并配平。加入等体积的4×SDS上样缓冲液混匀,100℃加热8 min,以40 μg/well加样,聚丙烯酰胺凝胶电泳、转膜、封闭,兔抗大鼠VEGF抗体1∶500,兔抗大鼠GAPDH抗体1∶1 000,4℃孵育过夜,二抗山羊抗兔IgG 1∶1 000室温孵育2 h,化学发光试剂曝光后进行图像采集及积分光密度测定,以VEGF与对应GAPDH的积分光密度比值代表VEGF的相对表达水平。
应用SPSS 23.0统计软件进行数据分析。符合正态分布的计量资料以 ±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSDt检验。P<0.05为差异有统计学意义。
±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSDt检验。P<0.05为差异有统计学意义。
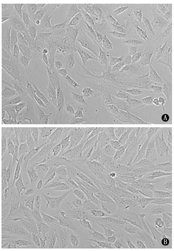
从12周龄SD大鼠脾脏分离培养的EPCs经体外培养后,第4天及第7天在光学显微镜下可见单层贴壁生长的梭形细胞(图1),符合EPCs形态特征。通过流式细胞术检测,所培养的细胞CD133、CD34、vWF、Flk-1阳性率分别为(59.0±2.0)%、(71.8±1.7)%、(82.4±1.1)%、(95.6±0.7)%。以上实验结果提示所培养细胞为EPCs。

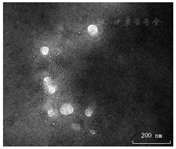
透射电镜下观察,分离获得的微囊泡呈球形或椭圆形,直径介于50~100 nm之间(图2),其形态、大小符合既往文献报道的微囊泡特征[6,7]。

TTC染色后对照组脑组织全部染成红色,未见白色梗死灶。HIBD组及生理盐水组均可见大片白色缺血梗死灶,两组脑梗死体积比大于EPC-MVs组[(80.3±6.3)%、(77.9±8.9)%比(35.2±7.7)%],差异有统计学意义(P<0.001);HIBD组和生理盐水组比较,差异无统计学意义(P>0.05)。见图3。
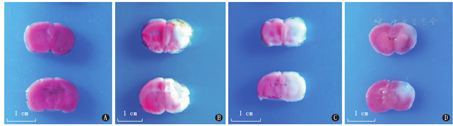

注:HIBD为缺氧缺血性脑损伤;EPC-MVs为内皮前体细胞来源的微囊泡
HIBD后72 h,与对照组(1.00±0.00)相比,HIBD组(2.10±0.25)、生理盐水组(2.09±0.28)及EPC-MVs组(3.77±0.78)大鼠脑组织中VEGF mRNA表达均升高,差异有统计学意义(P<0.001);EPC-MVs组高于生理盐水组和HIBD组,差异有统计学意义(P<0.001);生理盐水组和HIBD组比较,差异无统计学意义(P>0.05)。
HIBD后72 h,HIBD组(0.39±0.07)、生理盐水组(0.38±0.08)及EPC-MVs组(0.64±0.13)VEGF蛋白水平均高于对照组(0.20±0.02),差异有统计学意义(P<0.001);EPC-MVs组高于生理盐水组和HIBD组,差异有统计学意义(P<0.001);生理盐水组和HIBD组比较,差异无统计学意义(P>0.05)。见图4。
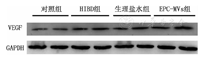

注:HIBD为缺氧缺血性脑损伤;EPC-MVs为内皮前体细胞来源的微囊泡;VEGF为血管内皮生长因子
HIBD是新生儿不可逆性脑损伤的主要原因,目前除亚低温治疗外,尚无其他满意的治疗措施。因此探寻安全有效的HIBD治疗方法具有重要价值。HIBD的病理机制复杂,涉及氧化应激、炎症反应、兴奋性毒性、细胞凋亡等。研究发现通过诱导脑缺氧缺血损伤部位的血管生成,不仅能够增加损伤部位的供氧,同时能促进神经发生及突触形成,进而改善HIBD的预后[12]。因此,探讨HIBD后血管相关机制有重要意义。
EPCs是血管内皮前体细胞,参与血管壁完整性的维持、血管损伤修复等过程,在血管生成过程中发挥重要作用[13]。研究表明,缺氧缺血可活化EPCs,促进其向损伤部位迁移,并可对脑神经损害发挥保护作用,减轻损伤、改善预后[14]。但是,将EPCs作为细胞治疗方式应用于HIBD的治疗还面临许多困难,可能存在远期疗效不确定、肿瘤发生风险、伦理问题等严重且不容忽视的安全隐患[15]。
研究发现EPCs具有分泌MVs的能力。本研究通过体外培养EPCs,应用超高速梯度离心法收集EPC-MVs。MVs为直径30~1 000 nm的膜性结构,电镜下观察本研究收集的EPC-MVs符合上述形态学特点。MVs内含脂质、蛋白质、微小RNA等多种生物活性物质,能够将母体细胞的重要生物学特性传递到靶细胞中,在细胞传递中发挥重要作用[16]。与EPCs相比,EPC-MVs不仅携带EPCs的生物学特性,同时具有选择性组装、靶向投递等特点,能够远距离、长时程、多靶点的高效作用于靶组织、细胞,MVs膜结构还能保持酶及遗传物质(如微小RNA)的活性[17]。并且,EPC-MVs参与维持血脑屏障完整性[18]。因此,将EPC-MVs作为HIBD的新型治疗手段具有研究价值。
本研究建立新生SD大鼠HIBD模型,将EPC-MVs通过脑室内注射的方法移植入脑组织,观察到EPC-MVs可显著减轻缺氧缺血后脑组织损伤范围。有研究表明,EPCs对脑损伤的保护作用与调控VEGF有关[19],EPC-MVs作为一种信号传递机制,并携带EPCs的生物学特性,其对HIBD的保护作用是否与VEGF有关,在研究中我们进行了进一步探讨。
VEGF是一种血管生成及渗透因子,具有重要的调节血管生长和发育的作用[20]。大脑发育早期,VEGF及其受体大量表达于皮层神经元,之后表达逐步下降[21]。多种应激,包括缺氧缺血,可诱导神经系统VEGF表达升高,促进神经细胞在缺氧缺血时的存活及血管修复、血管新生等,对神经系统损伤具有保护作用[22,23,24]。本研究应用实时荧光定量PCR及蛋白免疫印迹方法检测到脑室内注射EPC-MVs可上调VEGF mRNA及蛋白表达,提示EPC-MVs的保护作用与上调VEGF表达相关,但具体调控信号通路还有待进一步研究。
综上所述,本研究初步证实EPC-MVs可在新生SD大鼠HIBD中发挥神经保护作用,其机制可能与上调VEGF表达相关,为探索HIBD新的治疗手段提供了实验室依据和新思路。
所有作者均声明不存在利益冲突



























