
探讨早产儿肠外和肠内营养支持期间血游离肉碱和酰基肉碱水平的动态变化及其与营养方式、胎龄和体重增长速度的关系。
选择2017年1~12月生后24 h内入住上海交通大学医学院附属新华医院新生儿重症监护室并接受肠外营养支持的早产儿,根据胎龄分为超早产儿(<28周)、极早产儿(28~31周)、中期早产儿(32~33周)和晚期早产儿(34~36周)4组,根据日均体重增长情况分为<15 g/(kg·d)组和≥15 g/(kg·d)组,分别于出生后、完全肠外营养、肠内联合肠外营养和完全肠内营养期间采用干血滤纸片法收集血液标本,应用液相色谱-串联质谱联用技术检测游离肉碱和酰基肉碱浓度。应用SPSS 21.0统计软件比较不同营养支持方式、不同胎龄、不同体重增长速度早产儿血中游离肉碱和酰基肉碱水平的变化与差异。
共纳入早产儿124例,收集标本410份。早产儿出生后随着营养方式由肠外营养逐渐过渡至肠内营养,血游离肉碱和大部分血酰基肉碱(C3、C4、C10DC、C12、C12∶1、C12DC、C14、C16、C16∶1、C16-OH、C18等)水平呈下降趋势;胎龄较小的早产儿出生后血中C4-OH(P=0.001)和C5(P=0.001)水平更高;体重增长缓慢的早产儿出生后血C5-OH水平较低(P=0.006)。
早产儿生后早期血游离肉碱和酰基肉碱水平随营养方式改变呈下降趋势,提示外源性摄入相对不足;C4-OH和C5水平与胎龄成负相关;出生后较低的C5-OH水平可能与短期内体重增长缓慢有关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胎龄较小的早产儿、极低出生体重儿、超低出生体重儿以及因疾病、手术等因素所致消化道功能不全的患儿,生后早期均需依赖肠外营养摄入生长发育所需的营养素和能量,随后缓慢启动和逐渐推进肠内营养,直至建立完全肠内营养。肉碱参与长链脂肪酸氧化,同时有助于清除异常有机酸和减少脂酰辅酶A累积所致的细胞损伤。肉碱与有机酸和脂肪酸代谢密切相关,游离肉碱和酰基肉碱水平异常能反映特定的代谢表型[1,2]。本研究通过了解早产儿血游离肉碱、酰基肉碱水平随营养方式改变的动态变化以及与胎龄、体重的关系,探讨营养、代谢与生长发育的联系。
选择2017年1~12月生后24 h内入住上海交通大学医学院附属新华医院新生儿重症监护室并接受肠外营养支持的早产儿进行前瞻性研究。排除肠外营养持续时间<3 d,以及有遗传代谢性疾病、多发畸形、染色体异常及其他严重先天性缺陷的患儿。本研究获得上海交通大学医学院附属新华医院伦理委员会批准(XHEC-C-2016-139),并在https://www.clinicaltrials.gov/完成临床研究注册(NCT03100305),患儿家长均签署知情同意书。
(1)根据胎龄分为超早产儿(<28周)、极早产儿(28~31周)、中期早产儿(32~33周)和晚期早产儿(34~36周)4组;(2)根据日均体重增长情况分为<15 g/(kg·d)组和≥15 g/(kg·d)组[3,4],日均体重增长 ,其中n为自恢复出生体重至出院的时间(d),w1为出院体重(kg),w2为出生体重(kg)。
,其中n为自恢复出生体重至出院的时间(d),w1为出院体重(kg),w2为出生体重(kg)。
根据2013年《中国新生儿营养支持临床应用指南》进行营养支持。肠外营养采用6%小儿复方氨基酸、20%中长链脂肪乳及不同浓度葡萄糖、电解质、维生素和微量元素等,完全肠外营养期间不额外补充肉碱;肠内营养首选母乳或强化母乳,次选配方奶,包括蔼儿舒(雀巢)、特别能恩(雀巢)、纽太特(纽迪希亚)。根据各种制剂的营养成分含量计算肠外和肠内营养的热卡、脂肪、肉碱摄入情况。
各阶段采血时间:(1)出生后:日龄0~2 d,开始肠外营养支持前;(2)完全肠外营养:肠外营养热卡摄入达80 kcal/(kg·d)或肠内营养的配方乳或母乳摄入达20 ml/(kg·d)前;(3)肠内联合肠外营养:肠内营养热卡达总热卡的50%;(4)完全肠内营养:停止肠外营养支持后3 d或出院前。均采用干血滤纸片法收集血液标本。
标本采集后室温下晾干,于-20℃冰箱保存待测[5]。应用液相色谱-串联质谱联用技术检测干血滤纸片酰基肉碱浓度,检测仪器为串联四极杆液相色谱仪(Waters,xevo-TQ)。酰基肉碱检测的同位素内标为NSK-B(Cambridge Isotope Laboratories, Inc.),包括2H9-肉碱、2H3-乙酰肉碱、2H3-丙酰肉碱、2H3-丁酰肉碱、2H9-异戊酰肉碱、2H3-辛酰肉碱、2H9-肉豆蔻酰肉碱和2H3-棕榈酰肉碱,检测内容包括游离肉碱和多种短链、中链和长链酰基肉碱。
应用SPSS 21.0统计软件进行数据分析。符合正态分布的计量资料以 ±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,需控制协变量时采用协方差分析,多组间两两比较采用LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,需控制协变量时采用协方差分析,多组间两两比较采用LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
研究期间符合入选标准的早产儿共136例,因多发畸形、可疑遗传代谢性疾病排除5例,因自动出院等原因导致肠外营养持续时间过短排除7例,共纳入124例,男68例,女56例,胎龄(31.8±2.6)周,出生体重(1 527±332)g。随胎龄增加,住院天数缩短,剖宫产率降低,新生儿窒息、呼吸窘迫综合征、支气管肺发育不良、坏死性小肠结肠炎、低蛋白血症、败血症的发生率降低,差异有统计学意义(P<0.05);不同胎龄组间性别构成、母亲妊娠期高血压、妊娠期糖尿病、胎儿生长受限、胎儿宫内窘迫、前置胎盘、胎盘早剥、胎膜早破、脐带异常比例以及新生儿肺炎、呼吸暂停、先天性心脏病、新生儿黄疸、胃肠功能紊乱、新生儿低血糖等发生率差异无统计学意义(P>0.05),见表1。共收集血标本410份,完全肠外营养期间热卡摄入低于肠内联合肠外营养和完全肠内营养阶段,同时随着肠外营养向肠内营养过渡,脂肪和肉碱摄入逐渐增加,差异有统计学意义(P<0.05),见表2。
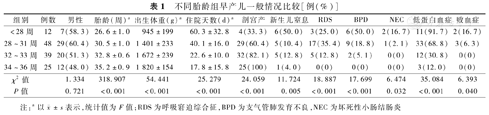
不同胎龄组早产儿一般情况比较[例(%)]
不同胎龄组早产儿一般情况比较[例(%)]
| 组别 | 例数 | 男性 | 胎龄(周)a | 出生体重(g)a | 住院天数(d)a | 剖宫产 | 新生儿窒息 | RDS | BPD | NEC | 低蛋白血症 | 败血症 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <28周 | 12 | 7(58.3) | 26.6±1.0 | 945±199 | 60.3±32.8 | 4(33.3) | 6(50.0) | 3(25.0) | 6(50.0) | 2(16.7) | 11(91.7) | 2(16.7) |
| 28~31周 | 48 | 29(60.4) | 30.5±1.0 | 1 401±233 | 40.1±16.0 | 29(60.4) | 5(10.4) | 17(35.4) | 9(18.8) | 1(2.1) | 33(68.8) | 3(6.3) |
| 32~33周 | 39 | 20(51.3) | 32.8±0.6 | 1 672±239 | 22.6±10.0 | 32(82.1) | 5(12.8) | 5(12.8) | 2(5.1) | 0(0) | 12(30.8) | 0(0) |
| 34~36周 | 25 | 12(48.0) | 35.2±0.9 | 1 820±154 | 17.8±15.8 | 25(100) | 1(4.0) | 0(0) | 0(0) | 0(0) | 3(12.0) | 0(0) |
| χ2值 | 1.334 | 318.907 | 54.441 | 25.279 | 24.059 | 11.724 | 18.887 | 17.699 | 6.474 | 35.084 | 6.393 | |
| P值 | 0.721 | <0.001 | <0.001 | <0.001 | <0.001 | 0.005 | <0.001 | <0.001 | 0.032 | <0.001 | 0.040 |
注:a以 ±s表示,统计值为F值;RDS为呼吸窘迫综合征,BPD为支气管肺发育不良,NEC为坏死性小肠结肠炎
±s表示,统计值为F值;RDS为呼吸窘迫综合征,BPD为支气管肺发育不良,NEC为坏死性小肠结肠炎
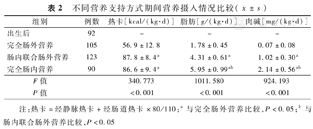
不同营养支持方式期间营养摄入情况比较( ±s)
±s)
不同营养支持方式期间营养摄入情况比较( ±s)
±s)
| 组别 | 例数 | 热卡[kcal/(kg·d)] | 脂肪[g/(kg·d)] | 肉碱[mg/(kg·d)] |
|---|---|---|---|---|
| 出生后 | 92 | - | - | - |
| 完全肠外营养 | 105 | 56.9±12.8 | 1.78±0.45 | 0.07±0.08 |
| 肠内联合肠外营养 | 123 | 87.8±8.4a | 4.31±0.61a | 1.02±0.30a |
| 完全肠内营养 | 90 | 86.6±9.4a | 5.95±0.99ab | 2.14±0.56ab |
| F值 | 340.773 | 1011.580 | 924.193 | |
| P值 | <0.001 | <0.001 | <0.001 |
注:热卡=经静脉热卡+经肠道热卡×80/110;a与完全肠外营养比较,P<0.05;b与肠内联合肠外营养比较,P<0.05
除C4DC、C5-OH、C6DC外,其他血游离肉碱和酰基肉碱水平随营养方式改变均发生显著变化(P均<0.05),并呈现不同的变化趋势。早产儿出生后随着营养方式由肠外营养逐渐过渡至肠内营养,血游离肉碱和大部分血酰基肉碱水平呈下降趋势,如C3、C4、C10DC、C12、C12∶1、C12DC、C14、C16、C16∶1、C16-OH、C18等,见图1;部分酰基肉碱水平在开始完全肠外营养后明显升高,而后在肠内营养期间又有所下降,如C5、C10、C10∶1、C14∶2、C16∶2、C18∶1、C18∶2、C18DC等,见图2。
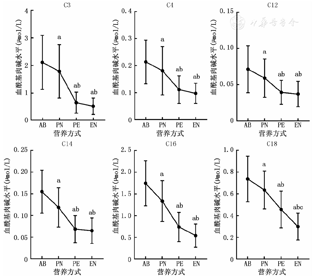

注:AB为出生后;PN为完全肠外营养;PE为肠内联合肠外营养;EN为完全肠内营养;a与AB比较,P<0.05;b与PN比较,P<0.05;c与PE比较,P<0.05
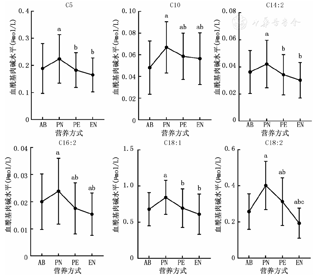

注:AB为出生后;PN为完全肠外营养;PE为肠内联合肠外营养;EN为完全肠内营养;a与AB比较,P<0.05;b与PN比较,P<0.05;c与PE比较,P<0.05
不同胎龄早产儿游离肉碱水平差异无统计学意义(P>0.05)。胎龄<28周早产儿短链酰基肉碱C3DC(P<0.001)、C4(P=0.004)、C4-OH(P=0.001)、C5(P=0.001)、C5∶1(P=0.019)、C5-OH(P=0.002)、C5DC(P<0.001),中链酰基肉碱C6(P<0.001)、C8(P<0.001)、C10∶1(P=0.012),以及长链酰基肉碱C14-OH(P=0.044)、C14DC(P=0.027)、C16DC(P<0.001)、C18-OH(P=0.022)水平低于其他胎龄组,其中C4-OH和C5水平呈随胎龄减小而升高的趋势,见图3。
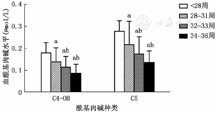

注:a与胎龄<28周组比较,P<0.05;b与胎龄28~31周组比较,P<0.05
日均体重增长<15 g/(kg·d)组胎龄小于≥15 g/(kg·d)组,差异有统计学意义(P<0.05);两组完全肠外营养、肠内联合肠外营养和完全肠内营养各阶段的热卡摄入差异无统计学意义(P>0.05);日均体重增长<15 g/(kg·d)组早产儿出生后血C2、C5-OH和C18∶1水平高于≥15 g/(kg·d)组,差异有统计学意义(P<0.05),见表3。两组游离肉碱及其他酰基肉碱水平差异无统计学意义(P>0.05)。进一步以胎龄为协变量进行协方差分析,结果显示不同体重增长速度组早产儿出生后血C5-OH水平差异有统计学意义(胎龄F=7.169,P=0.009;不同体重增长速度F=4.801,P=0.031)。
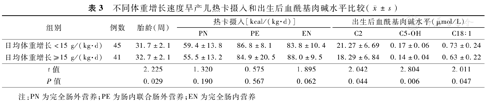
不同体重增长速度早产儿热卡摄入和出生后血酰基肉碱水平比较( ±s)
±s)
不同体重增长速度早产儿热卡摄入和出生后血酰基肉碱水平比较( ±s)
±s)
| 组别 | 例数 | 胎龄(周) | 热卡摄入[kcal/(kg·d)] | 出生后血酰基肉碱水平(μmol/L) | ||||
|---|---|---|---|---|---|---|---|---|
| PN | PE | EN | C2 | C5-OH | C18∶1 | |||
| 日均体重增长<15 g/(kg·d) | 45 | 31.7±2.1 | 59.4±13.8 | 86.8±8.1 | 83.8±10.4 | 21.27±6.69 | 0.17±0.06 | 0.73±0.24 |
| 日均体重增长≥15 g/(kg·d) | 41 | 32.7±2.1 | 55.5±13.2 | 84.9±20.5 | 88.0±9.5 | 18.29±6.84 | 0.14±0.04 | 0.63±0.22 |
| t值 | 2.225 | 1.320 | 0.575 | 1.895 | 2.042 | 2.804 | 2.011 | |
| P值 | 0.029 | 0.190 | 0.567 | 0.062 | 0.044 | 0.006 | 0.047 | |
注:PN为完全肠外营养;PE为肠内联合肠外营养;EN为完全肠内营养
肉碱在细胞能量代谢中具有重要作用,并且能与氨基酸中间代谢产物及酰基残基相结合,有助于清除体内异常有机酸、减少脂酰辅酶A累积造成的细胞损伤[6,7]。研究显示,健康的母乳喂养足月儿生后数天内血肉碱水平降低,随后逐渐升高,6月龄时可达成人水平[8]。而本研究结果显示,早产儿出生后从肠外营养过渡至肠内营养的过程中,尽管日龄增长,血游离肉碱和大部分酰基肉碱水平仍呈下降趋势。肉碱来源以食物摄入为主(约占75%),小部分在γ-丁基甜菜碱羟化酶的作用下由机体自身合成[9]。研究表明,新生儿肝脏中γ-丁基甜菜碱羟化酶活性仅为成人的12%,早产儿组织内肉碱贮存更少[8,10],容易发生肉碱缺乏。由于肠外营养液中通常不含肉碱,本研究中早产儿在完全肠外营养时几乎无肉碱摄入,因此生后早期肉碱水平降低。而后即使逐渐增加母乳或配方奶喂养,外源性肉碱摄入随之增加,多数酰基肉碱水平的下降趋势仍无明显好转。对于较长时间肉碱摄入不足的早产儿,仅依赖母乳或配方奶中的肉碱含量可能是不够的。目前多数研究认为补充肉碱能够增强脂肪酸代谢,改善对脂肪乳剂的耐受性,有利于正氮平衡和体重增长,有利于改善呼吸暂停、呼吸窘迫综合征和胃肠功能紊乱,因此对肠外营养支持的新生儿应预防性补充肉碱;同时也有少数研究结果显示补充肉碱后并未发生上述益处,大剂量补充时还应警惕发生胃肠道不适、惊厥发作等不良反应[11,12,13,14]。
本研究中完全肠外营养期间热卡摄入明显低于其他营养阶段,主要原因是部分早产儿的肠外营养尚未达到稳定量即开始增加肠内喂养而过渡至下一阶段。在脂肪摄入方面,肠外营养采用中长链脂肪乳剂,长链脂肪酸在肉碱的作用下进入线粒体完成β氧化,中链脂肪酸不需依赖肉碱的转运,但其在细胞质的氧化代谢仍有肉碱参与[15,16]。本研究中不同营养支持方式的脂肪摄入量差异较大,与脂质种类及代谢途径不同有关。
除营养方式和营养摄入量以外,胎龄也是血游离肉碱和酰基肉碱水平的重要影响因素。Tokuriki等[17]的研究结果显示,早产儿游离肉碱水平随着校正胎龄增加而升高,但也有研究报道早产儿和足月儿的游离肉碱水平并无显著差异[18],本研究结果显示不同胎龄早产儿游离肉碱水平差异无统计学意义。然而,血酰基肉碱水平与胎龄、出生体重、采样时日龄等因素有关[19,20,21,22]。本研究进一步证实早产儿出生后1~2 d内血C4-OH和C5水平随胎龄改变。有研究表明,极低出生体重儿脐血短、中链酰基肉碱水平升高,提示胎儿胎盘单位的相应脂肪酸氧化代谢增强,与本研究结果一致[23]。Gucciardi等[18]研究则发现血中长链酰基肉碱水平与胎龄成正相关,在超低出生体重儿中甚至低于足月儿20%~50%。本研究并未观察到相似的结果,可能与疾病状态和治疗手段的影响有关。部分短链酰基肉碱水平受到氨基酸摄入和代谢的影响,小胎龄早产儿酰基肉碱水平升高还可能与器官功能障碍(如肝功能损伤)或组织对肉碱利用不足有关。
通过对比不同体重增长速度早产儿出生后的血游离肉碱和酰基肉碱水平发现,体重增长缓慢的早产儿可能具有特定的肉碱代谢特点,表现为较高的血C2、C5-OH、C18∶1水平。考虑到除胎龄和热卡摄入以外,早产儿的体重增长速度可能还受到其他许多因素影响,因此其肉碱代谢与生长发育的关系仍需更多研究证实。
本研究样本量相对较小,此外,肉碱代谢可能与心血管疾病[24]、肺血管疾病[25]、新生儿坏死性小肠结肠炎[26]等患病情况以及输血等治疗干预相关,可能对研究结果产生一定影响。将来的研究方向包括制定不同胎龄早产儿在肠外及肠内营养期间血游离肉碱和酰基肉碱水平的截断值,评估是否存在肉碱不足及其相关不良预后的发生风险;进一步明确补充肉碱的益处和不良反应,确定有效、安全的剂量范围,以改善早产儿生长发育和疾病康复。
所有作者均声明不存在利益冲突



























