
系统评价妊娠期孕妇亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)与早产的相关性。
计算机检索PubMed、Embase、Web of Science、Cochrane图书馆、维普、中国知网、万方数据库和中国生物医学文献数据库自建库至2019年11月30日发表的关于评价或探讨妊娠期孕妇SCH与早产风险的文献,提取纳入研究的SCH定义、孕妇孕周、出生胎龄、研究类型等信息,应用Stata 12.0软件进行Meta分析。
最终纳入9篇队列研究和12篇病例对照研究,其中英文文献11篇,中文文献10篇,涵盖7个国家和地区,共100 016例孕妇,其中SCH孕妇7 562例。Meta分析结果显示,妊娠期孕妇SCH是发生早产的危险因素(OR=1.46,95%CI 1.25~1.71,P<0.001)。按照出生胎龄进行亚组分析显示,孕妇妊娠期SCH增加了胎龄<37周(OR=1.43,95%CI 1.16~1.76,P=0.001)、<34周(OR=1.84,95%CI 1.41~2.39,P<0.001)及<32周早产(OR=1.65,95%CI 1.08~2.52,P=0.020)的发病风险。进一步按照研究类型和SCH定义进行亚组分析,结果均显示妊娠期孕妇SCH会增加早产风险。
SCH是发生早产的危险因素,但仍有必要进一步开展质量更高、样本量更大的研究进行验证。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
早产是围产儿和5岁以下儿童死亡最常见的原因之一,也是引起精神、代谢、心血管和肾脏等疾病的重要危险因素[1]。根据2019年世界卫生组织报告,全球每年有1 480万早产儿,平均早产率10.6%,我国的早产率接近6.9%[2]。目前与早产相关的危险因素尚不明确,临床上难以预测早产的发生。甲状腺激素参与调节人体大部分组织的代谢、生长和发育,包括与早产有关的各种生理过程,如胎盘发育和功能、胚胎生长、临产时神经肽的分泌[3]。妊娠对甲状腺有多种影响,易引起甲状腺功能减退症、甲状腺功能亢进症以及亚临床甲状腺功能亢进症、亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)等疾病,其中SCH发病率相对更高[4]。越来越多的研究表明妊娠期孕妇患有SCH会增加早产风险,但对这一结果仍存在争议。本文采用系统评价和Meta分析的方法探讨未经治疗的SCH产妇与早产发生的相关性,以期为临床早期干预、减少早产发生率提供理论依据。
通过计算机检索PubMed、Embase、Web of Science、Cochrane图书馆、维普、中国知网、万方数据库和中国生物医学文献数据库发表的关于探讨妊娠期孕妇SCH与早产风险的文献,检索时间自建库至2019年11月30日,检索语种为中文和英文。采用主题词和自由词相结合的方式,并追溯纳入文献的参考文献。中文检索词:亚临床甲状腺机能减退症、亚临床甲减、亚临床甲状腺功能减低、婴儿、早产、妊娠结局;英文检索词:subclinical hypothyroidism,SCH,infant,preterm,premature,preterm delivery,pregnant outcome。
(1)研究类型:队列研究或病例对照研究;(2)研究对象:病例组为患有SCH且在研究期间未给予任何干预或治疗的孕妇,对照组为完全正常的孕妇;(3)病例组和对照组研究对象均不少于100例;(4)结局指标为是否发生早产;(5)可直接或间接计算OR值和95%CI。
(1)数据不全;(2)会议摘要、系统评价和综述;(3)重复发表的文献;(4)非中、英文文献;(5)对照组对象为临床显著性甲状腺功能减退症患者的研究;(6)动物实验。
由2名研究人员独立筛选文献、提取资料并交叉核对,如有分歧,则通过讨论或与第3方协商解决。资料提取内容包括:(1)纳入研究的基本信息:研究题目、第一作者、发表年份、研究类型等;(2)研究对象的基线特征和诊断标准;(3)偏倚风险评价的关键要素;(4)所关注的结局指标和结果测量数据。
纳入文献的质量评价分别参考队列研究和病例对照研究的纽卡斯尔-渥太华(Newcastle-Ottawa Scale,NOS)量表。队列研究从对象选择、组间可比性、结局3大方面进行评价,而病例对照研究则从对象选择、组间可比性、暴露3大方面进行评价。满分为9分,评分≥6分认为是高质量研究,纳入进行分析。由2名研究者独立评价纳入研究的质量,并交叉核对结果。如有分歧,则通过讨论或由第3人协商解决。
应用Stata 12.0软件进行Meta分析。用Q检验和I2检验评价文章之间的异质性,当I2>50%或PQ≤0.1时说明各研究间具有统计学异质性,采用随机效应模型进行分析;否则,使用固定效应模型。计算合并OR值及其95%CI,绘制森林图评价妊娠期孕妇SCH和发生早产的关系。进一步进行亚组分析明确研究间异质性来源。采用漏斗图和Egger’s检验评估发表偏倚,P>0.05认为不存在发表偏倚。敏感性分析采取依次排除单个文献后重新进行Meta分析,估计效应大小。
共检索到相关文献760篇,其中中文文献518篇(中国知网209篇,万方数据库183篇,维普数据库72篇,中国生物医学文献数据库54篇),英文文献242篇(PubMed 152篇,Embase 31篇,Cochrane library 40篇,Web of Science 19篇)。删除重复文献316篇;阅读题目和摘要后删除397篇;仔细阅读全文后,因病例组和对照组样本数少于100例排除17篇,因对照组研究对象为临床显著性甲状腺功能减退症患者排除9篇,最终纳入21篇[5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25]文献,其中英文文献11篇[5,6,7,8,9,10,11,12,13,14,15],中文文献10篇[16,17,18,19,20,21,22,23,24,25],队列研究9篇[5,6,7,8,9,10,11,12,14],病例对照研究12篇[13,15,16,17,18,19,20,21,22,23,24,25]。涵盖7个国家和地区,涉及研究对象SCH组7 562例,对照组100 016例。纳入文献的基本情况见表1。
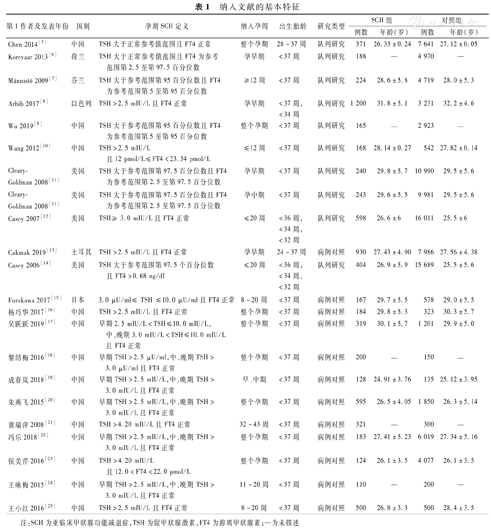
纳入文献的基本特征
纳入文献的基本特征
| 第1作者及发表年份 | 国别 | 孕期SCH定义 | 纳入孕周 | 出生胎龄 | 研究类型 | SCH组 | 对照组 | ||
|---|---|---|---|---|---|---|---|---|---|
| 例数 | 年龄(岁) | 例数 | 年龄(岁) | ||||||
| Chen 2014[5] | 中国 | TSH大于正常参考值范围且FT4正常 | 整个孕期 | 28~37周 | 队列研究 | 371 | 26.33±0.24 | 7 641 | 27.12±0.05 |
| Korevaar 2013[6] | 荷兰 | TSH大于正常参考值范围且FT4为参考范围第2.5至第97.5百分位数 | 孕早期 | <37周 | 队列研究 | 188 | — | 4 970 | — |
| Männistö 2009[7] | 芬兰 | TSH大于参考范围第95百分位数且FT4为参考范围第5至第95百分位数 | ≥12周 | <37周 | 队列研究 | 224 | 28.6±5.8 | 4 719 | 28.0±5.3 |
| Arbib 2017[8] | 以色列 | TSH>2.5 mIU/L且FT4正常 | 孕早期 | <37周,<34周 | 队列研究 | 1 200 | 31.8±5.1 | 3 231 | 32.2±4.6 |
| Wu 2019[9] | 中国 | TSH大于参考范围第95百分位数且FT4为参考范围第5至第95百分位数 | 整个孕期 | <37周 | 队列研究 | 165 | — | 2 923 | — |
| Wang 2012[10] | 中国 | TSH>2.5 mIU/L且12 pmol/L≤FT4<23.34 pmol/L | ≤12周 | <37周 | 队列研究 | 168 | 28.14±0.27 | 542 | 27.82±0.14 |
| Cleary-Goldman 2008[11] | 美国 | TSH大于参考范围第97.5百分位数且FT4为参考范围第2.5至第97.5百分位数 | 孕早期 | <37周 | 队列研究 | 240 | 29.8±5.7 | 10 990 | 29.5±5.6 |
| Cleary-Goldman 2008[11] | 美国 | TSH大于参考范围第97.5百分位数且FT4为参考范围第2.5至第97.5百分位数 | 孕中期 | <37周 | 队列研究 | 243 | 29.6±5.5 | 9 981 | 29.5±5.6 |
| Casey 2007[12] | 美国 | TSH≥ 3.0 mIU/L且FT4正常 | ≤20周 | <36周,<34周,<32周 | 队列研究 | 598 | 26.6±6 | 16 011 | 25.5±6 |
| Cakmak 2019[13] | 土耳其 | TSH>2.5 mIU/L且FT4正常 | 孕早期 | 24~37周 | 病例对照 | 930 | 27.43±4.90 | 7 986 | 27.56±4.38 |
| Casey 2006[14] | 美国 | TSH大于参考范围第97.5个百分位数且FT4>0.68 ng/dl | ≤20周 | <36周,<34周,<32周 | 队列研究 | 404 | 26.9±5.9 | 15 689 | 25.5±5.6 |
| Furukawa 2017[15] | 日本 | 3.0 μU/ml≤ TSH ≤10.0 μU/ml且FT4正常 | 8~20周 | <37周 | 病例对照 | 167 | 29.7 ± 5.5 | 578 | 29.0 ± 5.5 |
| 杨巧华2017[16] | 中国 | TSH>2.5 mIU/L且FT4正常 | 整个孕期 | <37周 | 病例对照 | 184 | 29.8±5.3 | 323 | 30.3±5.7 |
| 吴跃跃2019[17] | 中国 | 早期2.5 mIU/L<TSH≤10.0 mIU/L,中、晚期3.0 mIU/L<TSH≤10.0 mIU/L且FT4正常 | 整个孕期 | <37周 | 病例对照 | 319 | 30.1±5.7 | 1 201 | 29.9±5.0 |
| 黎结梅2016[18] | 中国 | 早期TSH>2.5 μU/ml,中、晚期TSH>3.0 μU/ml且FT4正常 | 整个孕期 | <37周 | 病例对照 | 200 | — | 150 | — |
| 成春岚2018[19] | 中国 | 早期TSH>2.5 mIU/L,中、晚期TSH>3.0 mIU/L且FT4正常 | 早、中期 | <37周 | 病例对照 | 128 | 24.91±3.76 | 135 | 25.12±3.95 |
| 朱燕飞2015[20] | 中国 | 早期TSH>2.5 mIU/L,中、晚期TSH>3.0 mIU/L且FT4正常 | 整个孕期 | <37周 | 病例对照 | 595 | 26.5±4.05 | 1 850 | 26.3±5.14 |
| 黄瑞萍2008[21] | 中国 | TSH>4.20 mIU/L且FT4正常 | 32~43周 | <37周 | 病例对照 | 321 | — | 300 | — |
| 冯乐2018[22] | 中国 | 早期TSH>2.5 mIU/L,中、晚期TSH>3.0 mIU/L且FT4正常 | 整个孕期 | <37周 | 病例对照 | 183 | 27.41±5.23 | 6 019 | 27.34±5.16 |
| 侯美芹2016[23] | 中国 | TSH>4.20 mIU/L且12.0<FT4<22.0 pmol/L | 整个孕期 | <37周 | 病例对照 | 124 | 26.1±3.5 | 4 077 | 26.1±3.5 |
| 王咏梅2015[24] | 中国 | 早期TSH>2.5 mIU/L,中、晚期TSH>3.0 mIU/L且FT4正常 | 11~20周 | <37周 | 病例对照 | 110 | — | 200 | — |
| 王小红2016[25] | 中国 | TSH>2.5 mIU/L且FT4正常 | 8~20周 | <37周 | 病例对照 | 500 | 26.8±3.3 | 500 | 28.4±3.5 |
注:SCH为亚临床甲状腺功能减退症,TSH为促甲状腺激素,FT4为游离甲状腺素;—为未描述
参照NOS量表分别对纳入的9篇队列研究[5,6,7,8,9,10,11,12,14]和12篇病例对照研究[15,16,17,18,19,20,21,22,23,24,25,13]进行质量评价,其中评分8分4篇[5,8,9,11],评分7分14篇[6,7,10,12,13,14,15,16,17,19,20,22,23,25],评分6分3篇[18,21,24],均为高质量文献。21篇文献中的SCH入选标准、孕妇纳入孕周均无统一标准。
对纳入的所有研究进行异质性检验,结果显示存在较大异质性(I2=57.1%,P<0.001),使用随机效应模型进行合并分析。Meta合并分析结果显示,妊娠期孕妇SCH与早产发病风险相关(OR=1.46,95%CI 1.25~1.71,P<0.001)。见图1、表2。
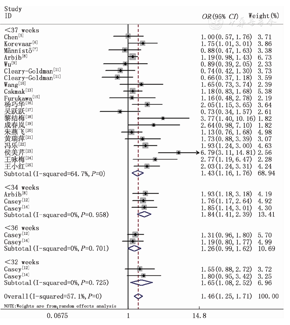

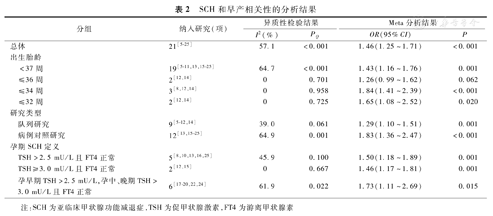
SCH和早产相关性的分析结果
SCH和早产相关性的分析结果
| 分组 | 纳入研究(项) | 异质性检验结果 | Meta分析结果 | |||
|---|---|---|---|---|---|---|
| I2(%) | PQ | OR(95%CI) | P | |||
| 总体 | 21[5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23,24,25] | 57.1 | <0.001 | 1.46(1.25~1.71) | <0.001 | |
| 出生胎龄 | ||||||
| <37周 | 19[5,6,7,8,9,10,11,13,15,16,17,18,19,20,21,22,23,24,25] | 64.7 | <0.001 | 1.43(1.16~1.76) | 0.001 | |
| ≤36周 | 2[12,14] | 0 | 0.701 | 1.26(0.99~1.62) | 0.062 | |
| ≤34周 | 3[8,12,14] | 0 | 0.958 | 1.84(1.41~2.39) | <0.001 | |
| ≤32周 | 2[12,14] | 0 | 0.725 | 1.65(1.08~2.52) | 0.020 | |
| 研究类型 | ||||||
| 队列研究 | 9[5,6,7,8,9,10,11,12,14] | 39.0 | 0.061 | 1.29(1.10~1.51) | 0.001 | |
| 病例对照研究 | 12[13,15,16,17,18,19,20,21,22,23,24,25] | 64.9 | 0.001 | 1.83(1.36~2.47) | <0.001 | |
| 孕期SCH定义 | ||||||
| TSH>2.5 mU/L且FT4正常 | 5[8,10,13,16,25] | 45.9 | 0.100 | 1.50(1.18~1.89) | 0.001 | |
| TSH≥3.0 mU/L且FT4正常 | 2[12,15] | 0 | 0.667 | 1.46(1.17~1.81) | 0.001 | |
| 孕早期TSH>2.5 mU/L,孕中、晚期TSH>3.0 mU/L且FT4正常 | 6[17,18,19,20,22,24] | 61.9 | 0.022 | 1.73(1.11~2.69) | 0.015 | |
注:SCH为亚临床甲状腺功能减退症,TSH为促甲状腺激素,FT4为游离甲状腺素
妊娠期孕妇SCH可增加出生胎龄<37周(OR=1.43,95%CI 1.16~1.76,P=0.001)、<34周(OR=1.84,95%CI 1.41~2.39,P<0.001)及<32周(OR=1.65,95%CI 1.08~2.52,P=0.020)的早产发生风险,但与出生胎龄<36周的早产发生风险不相关(OR=1.26,95%CI 0.99~1.62,P=0.062)。见图1、表2。
队列研究(OR=1.29,95%CI 1.10~1.51,P=0.001)和病例对照研究(OR=1.83,95%CI 1.36~2.47,P<0.001)的Meta分析结果一致,均表明妊娠期孕妇SCH会增加早产发病风险。见表2。
不论纳入的SCH孕妇其诊断标准为TSH>2.5 mIU/L且FT4正常(OR=1.50,95%CI 1.18~1.89,P=0.001)还是TSH≥3.0 mU/L且FT4正常(OR=1.46,95%CI 1.17~1.81,P=0.001)或孕早期TSH>2.5 mU/L,孕中、晚期TSH>3.0 mU/L且FT4正常(OR=1.73,95%CI 1.11~2.69,P=0.015),均会导致早产发生风险增加。见表2。
用漏斗图和Egger's检验来评价文献发表偏倚,漏斗图对称性较好,表明纳入研究不存在明显发表偏倚,见图2。Egger's检验也证实各研究结果之间没有明显的发表偏倚(P=0.097)。敏感性分析结果表明依次单独剔除1篇文献后,各合并效应量无明显改变,异质性未发生改变,结果与剔除前总体趋势一致,Meta分析结果稳定可靠。
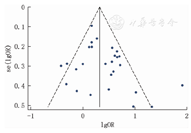

注:SCH为亚临床甲状腺功能减退症,OR为比值比,se(lgOR)为lgOR的标准误
早产是常见的妊娠期并发症,可对早产儿及其家庭造成巨大且长期的医疗和经济负担[2]。导致早产的因素众多,但目前早产的具体病因依然不明确。由于妊娠期甲状腺血供、免疫微环境等发生改变,孕妇甲状腺功能易出现较为明显的异常[22]。妊娠期孕妇SCH与早产的关系已引起学者的广泛关注,据报道这可能与孕期本身的炎症反应和甲状腺的自身免疫有关,一方面怀孕会导致局部胎盘蜕膜环境或胎儿发育过程中细胞因子调节网络发生改变,孕妇的局部炎症过程失调会直接破坏胎盘导致早产;另一方面甲状腺自身免疫可能通过促甲状腺激素(thyroid stimulating hormone,TSH)和非TSH依赖性机制增加早产风险[26]。在甲状腺功能正常的妇女中,甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)阳性妇女的TSH基线水平高于TPOAb阴性妇女,使其甲状腺功能相对于正常女性可有轻微异常,孕期不能对生理需求增加的甲状腺激素应激状态及时做出反应,导致甲状腺功能进一步恶化[26]。
本次Meta分析纳入了9项队列研究和12项病例对照研究,质量评分均较高,Meta分析结果显示SCH孕妇发生早产的可能性更高;这与Korevaar等[6]的研究结果一致,但与Wu等[9]的研究结果相悖。按照研究类型及SCH定义进行亚组分析亦得到相同的结果。各研究定义SCH的诊断标准不同,有6项研究[17,18,19,20,22,24]孕妇SCH的诊断是以中华医学会内分泌学分会/中华医学会围产医学分会制定的《妊娠和产后甲状腺疾病诊治指南(2012) 》[27]为参考,部分研究[6,7,9,11,14]根据该实验室参考区间的百分位数界定TSH和FT4的参考值来诊断SCH。妊娠早期胎盘分泌人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)增加,hCG的α亚单位与TSH相似,具有刺激甲状腺的作用;增多的甲状腺激素抑制TSH分泌,使妊娠早期血清TSH水平下降,少数妊娠妇女TSH甚至低至难以检出,妊娠中、晚期血清TSH逐渐升高[28],所以孕早期和晚期TSH参考值范围存在差别。一项荟萃分析纳入了国内的11项研究、5种不同的试剂制定的TSH参考范围,与每个相应的试剂盒提供的普通人群参考范围相比,妊娠早期TSH上限下降约22%,下限下降约85%,试剂盒提供的TSH参考范围上限下降22%的数值和4.0 mIU/L相近,所以,如果不能得到妊娠期特异性TSH参考范围,4.0 mIU/L也可以作为中国妇女妊娠早期TSH上限的切点值[29]。
进一步按照出生胎龄进行的亚组分析显示孕妇妊娠期SCH增加了胎龄<34周、<37周早产的发病风险,但不增加胎龄<36周的早产发病风险,这与Casey等[12,14]和Arbib等[8]的研究结论一致;同时亚组分析显示妊娠期孕妇SCH增加出生胎龄<32周的早产发病风险,这与Casey[12,14]的研究结论不一致,但该分析仅纳入2篇文献,不具有代表性,该结论尚需进一步验证。
本研究中进行的漏斗图和Egger’s检验均显示不存在明显的发表偏倚,但也存在一些局限:(1)纳入的文献仅限于中文和英文,虽然本文限定了纳入研究的样本量,但是仍有部分研究的样本量较少;(2)不同的研究所选择的研究因素如孕周、年龄、种族等有差异,可能会造成选择偏倚;(3)各个研究用于SCH诊断的界值不完全一致,且不同实验室间存在检测差异,必然会影响结果;(4)本研究未考虑SCH孕妇是否存在甲状腺自身免疫的情况,关于TPOAb阳性和阴性的孕妇与早产的关系还需要进一步的研究;(5)按照出生胎龄以及SCH定义进行亚组分析,部分亚组纳入的研究较少,结果还需要进一步验证。因此,本研究结论有必要在质量更高、样本量更大的研究中进行验证。
综上所述,妊娠期合并SCH的孕妇,其发生早产的风险可能增加。因此临床应定期对孕妇的甲状腺功能进行监测,并给予适当的干预措施。
所有作者均声明不存在利益冲突



























